中国猪瘟净化之路:离我们还有多远?
孙元,仇华吉
中国猪瘟净化之路:离我们还有多远?
孙元,仇华吉
(中国农业科学院哈尔滨兽医研究所/兽医生物技术国家重点实验室,哈尔滨 150069)
猪瘟是由猪瘟病毒引起猪的一种以高热、出血和高死亡率为主要特征的接触性传染病,给疫区国家的养猪业造成严重的经济损失。该病被世界动物卫生组织(OIE)列入须申报的动物疫病目录,我国将其列为一类动物疫病。《国家中长期动物疫病防治规划(2012-2020年)》将猪瘟列为5种优先防治和重点防范的动物疫病之一。我国老一辈科学家于上世纪50年代研制出闻名于世的猪瘟兔化弱毒疫苗(C株),该疫苗安全、有效,对我国及世界范围内猪瘟的防控和根除发挥了关键作用。截止目前,全球共有30多个国家和地区根除了猪瘟。养猪业在我国畜牧业中占有主导地位,猪瘟对我国生猪及猪肉产品贸易具有重大影响。因此,我国必须走猪瘟净化之路。自上世纪中期我国提出了猪瘟根除战略,时至今日猪瘟仍未净化,主要原因有,我国地域辽阔、养猪环境复杂、养殖模式多样、动物疫病种类繁多、养猪从业人员素质和意识水平参差不齐、生物安全防控水平低等。目前我国已进入新时代,综合国力稳步提升,养殖业也朝着科学化、规模化、绿色环保化方向发展,科研支撑能力日益增强,已完全具备净化猪瘟条件:当前猪瘟的流行率较低;猪瘟疫苗生产工艺不断改进,质量也不断提升;新型猪瘟标记疫苗的研制取得突破性进展;相应的猪瘟检测、监测方法及与标记疫苗配套的鉴别诊断技术也已趋于成熟。更关键的是,我国养猪企业和养殖户也意识到了猪瘟净化的必要性,政府部门也在积极采取行动,制定相应的法规和政策,联合企业、养殖户、各级兽医部门等实施区域性净化。本文详细介绍了猪瘟在全球及我国的流行现状,探讨了我国猪瘟净化的重大意义及有利与不利条件,深入分析了我国猪瘟净化的成本及效益,全面总结了欧盟等国家净化猪瘟的成功经验,并对我国猪瘟净化思路和方案进行了探讨。笔者认为,中国猪瘟净化具有历史必然性、战略必要性、现实可能性、技术可行性,这一天的到来并非遥不可及。
猪瘟;猪瘟病毒;净化;中国
猪瘟(classical swine fever,CSF)是由猪瘟病毒(classical swine fever virus,CSFV)引起猪的一种以高热、出血和高死亡率为主要特征的接触性传染病[1],可造成严重的经济损失[2]。该病被世界动物卫生组织(OIE)列入须申报的动物传染病目录[3],我国将其列为一类动物疫病。《国家中长期动物疫病防治规划(2012-2020年)》将猪瘟列为5种优先防治和重点防范的一类动物疫病之一。我国老一辈科学家于上世纪50年代研制出闻名于世的猪瘟兔化弱毒疫苗(C株),该疫苗对我国乃至世界范围内猪瘟的防控和根除发挥了至关重要的作用[4]。多个国家通过应用该疫苗结合科学合理的生物安全措施根除了猪瘟。我国早在上世纪中期就提出了消灭猪瘟的战略,数十年过去了,猪瘟仍在我国广泛存在,甚至局部流行,原因何在?中国的猪瘟净化之路还有多远?本文对世界和中国猪瘟的流行现状进行了介绍,深入分析了我国猪瘟净化的必要性和可行性,总结了欧美部分国家猪瘟净化的成功经验和再次暴发的教训,并对我国猪瘟净化思路和方案进行了探讨,以期为我国猪瘟的净化提供参考。
1 世界猪瘟分布和中国猪瘟的流行现状
猪瘟是严重危害养猪业的一种急性传染病,出现于200多年前[5]。世界各国对该病的防控和净化做出了巨大努力。2017年OIE发布的CSF全球流行报告显示,美国、加拿大、澳大利亚、欧盟等部分国家和地区已经成功根除了猪瘟[6],该病仍持续对亚洲、东欧、中南美洲大部及加勒比海地区造成严重危害,尤其对发展中国家的养猪业和食品安全影响较大,一些无猪瘟国家也面临着传入该病的高风险[7-8]。目前,猪瘟3大流行区为中南美洲、欧洲和亚洲。其中,中南美洲为疫情稳定区;东欧地区为流行活跃区;亚洲属于老疫区,由于控制措施不力,疫情形势依然严峻。资料表明,除南非、马达加斯加和毛里求斯外,非洲其他国家未见猪瘟爆发[2, 9-10]。
猪瘟病毒有3个基因型和11个基因亚型。基因1型主要分布在南美、亚洲和俄罗斯;基因2型主要分布于欧洲、亚洲等。目前,我国流行的猪瘟病毒以2.1、2.2和1.1基因亚型为主,偶有2.3和3.4亚型,其中2.1亚型占优势[7, 11-20]。全球猪瘟亚型分布见表1。
当前世界范围内猪瘟的流行发生了很大变化,经典强毒株引起的猪瘟在成年猪中少见,中等、低毒力猪瘟病毒引起的非典型猪瘟和持续性感染比较常见,造成的经济损失不容小视[3, 21-22]。当前我国猪瘟的流行形势和发病特点主要表现为:流行范围广,全国范围内均有流行,但以散发流行为主。目前猪瘟多见于仔猪,成年猪很少出现发病症状,但可持续带毒,并且可通过水平和垂直传播在猪场内恶性循环。非典型症状和繁殖障碍型猪瘟增多,临床上持续性感染(亚临床感染)和隐性感染增多,成为猪瘟流行最危险的传染源。另外,猪瘟与猪繁殖与呼吸综合征、伪狂犬病、猪细小病毒病、猪圆环病毒病等混合感染十分严重和普遍[23]。

表1 全球猪瘟病毒基因亚型分布
该表中数据根据近20年已发表文献整理[7]
The data of this table comes from references published past 20 years
2 中国猪瘟净化的必要性
2.1 养猪业在我国的重要地位
“粮猪安天下”,养猪业是攸关国计民生和“三农”问题的支柱产业。我国生猪屠宰量占全球近6成,猪肉消费量占全球的一半。2017年我国猪肉产量5 340万吨,生猪存栏43 325万头,出栏68 861万头,是全球第一大猪肉消费市场。
据海关统计,2017年,我国累计进出口猪肉126.8万吨,进出口总额168.2亿元人民币。其中,进口猪肉121.7万吨,出口猪肉5.1万吨[24]。因此,我国猪肉出口有巨大空间。
2.2 猪瘟是制约养猪业发展的重大疫病之一
我国是世界第一养猪大国。随着养猪业的发展,规模化、集约化程度不断提高,由于种猪的引进、生猪转运量的增加,猪的传染病越来越多,疫病的控制难度越来越大,造成的经济损失也越来越严重。由于传染性强、致死率高等特点,猪瘟成为养殖户重点防范的主要疫病。如果防控不到位,一旦发病,损失将是巨大的。因此,养殖企业每年为防控猪瘟耗费了大量的人力、物力和财力。其中,种公猪、母猪一年要免疫2—4次,仔猪从出生到出栏要进行2次以上的免疫,防疫成本相当高。猪瘟疫苗免疫程序及成本分析见表2。
2.3 猪瘟对我国猪肉及相关制品贸易的巨大阻碍作用
猪瘟是世界各国重点防控的重大动物疫病之一,该病严重影响世界各国的猪肉及相关制品贸易。以美国为例,1962年暴发猪瘟后,有12个国家禁止从美国进口猪产品,其潜在市场价值估计每年有2 000万美元。猪瘟根除后,美国获得了这个潜在市场的准入机会,所获利润远大于根除猪瘟的开支。
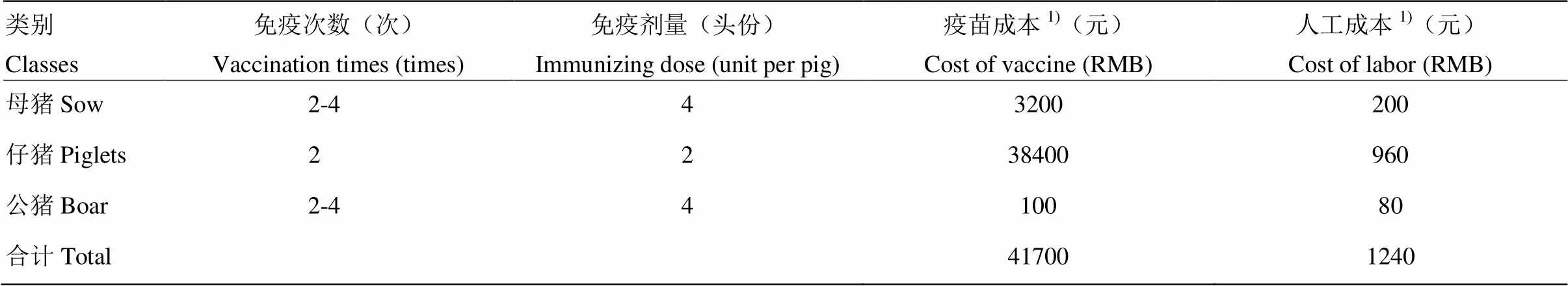
表2 猪场进行猪瘟疫苗免疫的程序及成本
1)规模为1000头母猪的猪场,每年进行猪瘟疫苗免疫的成本
1)The cost of vaccination against classical swine fever in a herd of 1000 sows per year
由于我国是猪瘟疫区,猪肉出口受到极大限制,目前只有少量猪肉产品销往港澳和俄罗斯等地。因此,猪瘟净化对提升我国的国际竞争力、开拓国际猪肉市场十分必要。
2.4 只有采取净化措施才能从根本上控制我国猪瘟的流行
猪瘟兔化弱毒疫苗由我国创制,很多国家应用该疫苗结合生物安全措施成功净化了猪瘟。而我国应用该疫苗60余年,为何至今未能根除猪瘟?分析主要有以下几点原因:(1)带毒种猪是主要根源;(2)先天性感染的仔猪产生免疫耐受;(3)混合感染与继发感染造成免疫抑制;(4)疫苗及免疫程序混乱;(5)生物安全防控措施不到位;(6)饲养管理、人员素质水平低;(7)相应的政策、法规等不健全。除此之外,C株疫苗不具有标记特性,不能够区分疫苗免疫和野毒感染,这给猪瘟的净化造成了较大的困难[25-27]。
猪瘟在我国屡防不绝,其根源主要在于母猪带毒,临床上有3%—33%的种猪带毒,常导致免疫失败,造成我国猪瘟长期持续存在和散发流行。猪瘟病毒可通过胎盘传播给胎儿,这种先天性感染经常导致母猪流产、产木乃伊胎、死胎、弱仔。而且先天感染猪瘟的仔猪往往产生免疫耐受,变成持续性感染的带毒猪。如果这些猪用作后备种猪就可成为传染源。带毒母猪及先天感染仔猪可不断排毒,污染环境,感染其他健康猪。垂直传播与水平传播同时在一个猪场反复交替进行,造成了猪瘟感染的恶性循环。只有通过猪瘟的净化结合加强饲养管理和生物安全等综合性防控措施,才能彻底解决这一难题[23]。
猪瘟净化的效益非常可观,以美国根除猪瘟为例,在执行根除计划的16年间,共支出经费约1.40亿美元。在执行该计划前,美国由于猪瘟引起的年度损失5 740万美元,从1962年到1977年的损失共计约9.20亿美元,如果将通货膨胀的因素考虑在内,实际损失可能超过15亿美元,成功实施猪瘟根除计划的效益/成本约为13.2,这意味着在成功的根除计划中每投入1美元将会节约13.2美元的猪瘟防控支出。如果以一个更保守的折扣率(6%)计算,每1美元的花费将产生高达21.1美元的收益[23]。因此,投入必要的人力、物力开展猪瘟净化,是目前国内养猪业迫在眉睫的任务和使命。
3 欧美净化猪瘟的经验
欧盟于上世纪80年代实施了猪瘟净化项目,该项 目首先采用C株疫苗免疫,当感染率降低到一定程度后,再采取非免疫结合扑杀策略,另外限制猪及猪产品的流通,从而使一些国家净化了猪瘟[28]。然而,在1997年,荷兰、德国、比利时、西班牙和意大利再次暴发了猪瘟。比利时当局立即扑杀了7个感染猪群和55个接触感染的猪群,在40 d内恢复猪瘟无疫状态,意大利利用同样方式取得了成功。这些国家猪瘟的再次暴发主要是由野猪及进口猪制品所引起[15, 28-29]。
目前,宣布无猪瘟的国家和地区包括北美洲:加拿大、美国、墨西哥;南美洲:智利、巴拉圭以及巴西和哥伦比亚部分区域;大洋洲:澳大利亚、新西兰、新客利多尼亚;欧洲:法国、荷兰、比利时、卢森堡、瑞士、列支敦士登、奥地利、德国、波兰、斯洛伐克、捷克、罗马尼亚、丹麦、挪威、芬兰、瑞典、爱尔兰、英国、葡萄牙、西班牙、意大利、斯洛文尼亚。
总结欧美等国家成功净化猪瘟的经验,包括以下几方面:(1)早期疫苗免疫结合后期扑杀:开始使用疫苗密集免疫,当感染率降低到一定程度后,减少直至停止使用疫苗,主要依靠检测和扑杀[15];(2)持续监测:包括主动监测和被动监测,及时、快速地查出和清除感染猪,特别是持续感染带毒猪;(3)早、快、严、小反应机制:一旦出现疫情,需要迅速、果断处置,包括隔离疫点、扑杀病猪、限制动物流动、全面消毒等紧急措施;(4)生物安全措施:包括圈舍、人员、车辆、器具消毒,防止野猪散毒,采取猎杀、饵料免疫措施;(5)各方联动协作:政府、兽医主管部门、猪场、检测机构和科研单位等相互配合。
欧盟个别国家再次暴发猪瘟主要是由野猪感染传播所引起,家猪逃逸后与野猪接触增加了猪瘟感染与流行的机会。虽然欧盟采取了一些措施如投放口服诱饵疫苗来对野猪免疫,但是野猪猪瘟的感染率仍很高,主要由于诱饵疫苗大多被成年猪捕获,而易感性更高的仔猪获取的机会较小。另一方面,对野猪的监测和扑杀存在一定难度,致使猪瘟从野猪传入家畜的风险增大,如果防范不到位,就会导致猪瘟的再次暴发。
4 中国猪瘟净化的技术支撑
目前,我国已初步具备猪瘟净化的条件。当前猪瘟的流行率处于较低水平,猪瘟疫苗的生产工艺不断改进,质量不断提升;新型猪瘟标记疫苗的研制进展也非常顺利;相应的猪瘟检测、监测方法及与标记疫苗配套的鉴别诊断技术也已达到了国际水平。目前,我国已经有一项猪瘟标记疫苗即猪瘟病毒E2重组杆状病毒灭活疫苗获得了新兽药证书,另有数项猪瘟标记疫苗进入临床试验,包括猪瘟基因工程活疫苗(rAdV-SFV-E2株)、猪瘟基因工程亚单位疫苗(293T-E2)和猪瘟病毒E2重组杆状病毒载体灭活疫苗(WH-09株)等。
除技术支撑外,我国养猪企业也意识到了猪瘟净化的重要性和必要性。养猪企业的生物安全水平也在不断提升,小型和散养模式不断减少。政府部门也在积极采取行动,制定相应的法规和政策,联合养殖户、企业、各地兽医部门等实施区域性的猪瘟净化。
5 中国猪瘟净化的挑战
虽然我国已初步具备了猪瘟净化的条件,但还有许多制约因素。目前,我国养猪模式多样化,养殖水平和条件、生物安全防控措施、人员素质和意识水平参差不齐,相应的政策法规等还不够完善。我国猪瘟的净化依然面临着巨大挑战。
5.1 养殖模式多样化
我国的养猪业是由传统的家庭散养户发展起来的,目前正逐步地向规模化、专业化和集约化的现代养殖方向转型,但是发展的历史较短[30]。我国最大的养猪企业温氏集团发展规模化养猪也只有二三十年。目前我国的养猪模式包括散养、中小规模养殖及大型规模化养殖。散户和中小养殖户规模不一,养殖条件差,抵抗疾病风险的能力较低,养殖过程缺乏标准,一旦发病,缺乏有效的疫病防控手段和监管措施[31]。
5.2 猪传染病种类复杂、混合感染多
目前,我国猪传染病的种类繁多,旧病未除,新病又增,疫病防控压力较大[28]。20世纪90年代以前,我国流行的主要猪病仅十余种,如猪瘟、猪丹毒、猪肺疫、仔猪副伤寒、猪支原体肺炎、仔猪大肠杆菌病、伪狂犬病、猪传染性萎缩性鼻炎等。改革开放以来,由于贸易及人员流通频繁,一些猪传染病传入我国(如猪繁殖与呼吸综合征、猪圆环病毒病等),并快速传播、蔓延,给养猪业造成了巨大损失。另外,由于免疫压力及其他因素,使某些疫病非典型化,且发生了变异,如高致病性猪繁殖与呼吸综合征、伪狂犬病、猪流行性腹泻等。
另一方面,多重感染、继发感染、混合感染已成为我国猪场较为普遍的发病形式,这给疫病的诊断及防控带来了很大困难。当前多数猪场同时存在多种病原的混合感染,其中猪瘟与猪繁殖与呼吸综合征、伪狂犬病、猪圆环病毒病及其他细菌病的混合感染较为普遍,这非常不利于猪瘟的防控和净化。另外。猪瘟的非典型性、隐性带毒、持续感染和免疫失败也是养猪生产中普遍存在的问题。
5.3 养猪从业人员素质和意识水平参差不齐
我国从事养猪产业的相关人员水平差别较大,大规模企业的人员素质较高,中小型规模以下养殖场的人员素质水平较低。散养户多以农户为主,文化水平低,效益差,对传染病的危害理解不到位,疫病防控意识淡薄且饲养管理能力低下。一旦有疫病暴发,很难有效控制,造成迅速流行。
5.4 生物安全防控水平低
生物安全防控系统是控制动物疫病的最主要防线。我国中小型养猪企业,特别是散养户,几乎没有严格的隔离措施和消毒设施,很难抵抗疫病的侵袭。另外,动物调运管理、疫苗质量监管、疫苗审批制度等也严重影响着我国猪瘟的净化。
6 中国猪瘟净化的思路
党的第十九次全国代表大会明确指出,我国已经进入了中国特色社会主义新时代。“两个一百年”奋斗目标与“中国梦”一起成为引领中国前行的时代号召。十九大报告已清晰擘画出全面建成社会主义现代化强国的时间表、路线图。
在把我国建成富强、民主、文明、和谐、美丽的社会主义现代化强国的征程上,动物疫病的防控对我国畜牧业的发展起着非常关键的作用。因此,我们要以习近平新时代中国特色社会主义思想为指导,将我国猪瘟净化的使命投映到“两个一百年”奋斗目标的坐标系中。在猪瘟的防控和净化上,我们同样牢固树立并切实贯彻“创新、协调、绿色、开放、共享”的发展理念,走中国特色的猪瘟净化之路。
6.1 中国猪瘟净化策略与模式
猪瘟净化具有重大意义,这是国家战略需求、产业需要,是大势所趋、势在必行。我国猪瘟净化过程有别于其他国家,猪瘟标记疫苗及相应配套的鉴别诊断技术对我国猪瘟的净化十分必要。净化前期还会大规模、高密度地使用猪瘟兔化弱毒疫苗,配合完善的生物安全防控措施,在提高养殖人员对猪瘟等猪病防控意识的前提下,将猪瘟的感染率及流行率控制在一定范围之内。随后要逐步使用猪瘟标记疫苗及配套的鉴别诊断方法,结合淘汰措施,逐渐达到猪瘟的净化。对我国来说,猪瘟净化状态的维持相当重要,相应的监测手段、方法、方案、措施等要进行充分地优化。
6.2 中国猪瘟净化策略与方案
我国猪瘟净化的策略及方案要结合我国国情、养殖模式、养猪规模等,在借鉴欧美猪瘟净化经验的基础上,走中国特色的猪瘟净化之路。按照准备阶段→控制阶段→强制净化阶段→监测阶段→认证阶段程序,通过对猪瘟快速诊断试剂盒、疫苗毒株和致病毒株鉴别诊断方法的筛选和整合,免疫程序的调整,生物安全措施的综合实施,进行我国猪瘟的净化。
6.2.1 基于C株疫苗的猪瘟净化
(1)疫苗的筛选:检验疫苗含量是否足够?有无牛病毒性腹泻病毒(BVDV)污染?接种后是否有异常反应?
(2)抗体监测:猪瘟疫苗免疫后不同时间点采血分离血清,检测猪瘟特异性抗体,根据血清学检测结果,将猪群进行分群,对抗体水平低和阴性的猪群加强免疫,抗体阳转则将其转入相应的抗体阳性群;淘汰抗体水平依然不合格的猪只。
(3)种猪筛查:在种猪群免疫时,对整个种猪群进行活体采集扁桃体或抗凝血样,然后应用荧光定量RT-PCR、RT-PCR或荧光抗体染色法对种猪和后备种猪进行猪瘟病毒野毒的检测。其中,抗原阳性的猪,需用另一种方法复核,如仍为阳性则淘汰。同时对血清样品进行抗体检测,阴性者需再次免疫。
(4)再次免疫:对于抗体为阴性的猪,接种猪瘟疫苗,3周后应用间接ELISA或阻断ELISA检测抗体,抗体仍为阴性者,坚决淘汰。
(5)重复上述程序:每半年或一年1次,3—4个循环。
当猪群抗原阳性率逐步下降,抗体合格率逐步提高后,对母猪开展抽查,商品猪的抽查比例可以逐步降低(1‰—5‰)。
(6)巩固和维持:逐步净化猪瘟,建立清净猪群。
6.2.2 基于标记疫苗的猪瘟净化
对于种猪群,最好使用标记疫苗和配套鉴别诊断进行猪瘟净化[32]。
(1)首先应用猪瘟标记疫苗对猪群进行全群免疫;
(2)应用配套的鉴别诊断方法(如Erns抗体检测试剂盒)对猪群进行抗体检测;
(3)剔除Erns抗体为阳性的猪;
(4)Erns抗体为阴性的猪,再用E2抗体检测试剂盒进行检测,E2抗体为阴性,则需要再次免疫,如果仍为阴性则淘汰;
(5)Erns抗体为阴性,E2抗体为阳性的猪,则需要用抗原检测方法进行验证,结果为阳性的直接淘汰,阴性的留为种用。
应用猪瘟标记疫苗进行猪瘟净化的流程见图1。

图1 应用标记疫苗净化猪瘟示意图
7 结语与展望
我国是世界第一养猪大国,但不是养猪强国,在畜牧业发展和动物疫病防控上,我国要体现大国的责任和担当,特别是在猪瘟净化上,我们不能无所作为,更不能把它带入下一个世纪,贻害子孙后代。
猪瘟是危害养猪业的重大疫病。我国曾经研制出非常优秀的猪瘟兔化弱毒疫苗C株,该疫苗也为世界范围内许多国家猪瘟的净化做出了巨大贡献[29]。我们也憧憬有朝一日将我国猪瘟净化。我国猪瘟的净化需要多方的参与和协作,包括政府机构、养猪业者、科研机构、生物制品企业、兽医部门等,他们要在猪瘟净化的过程中各司其职,发挥各自的作用。政府机构颁布相应的政策、法规,建立市场准入机制,完善动物调运管理和疫苗质量监管、疫苗审批制度;养猪业者需提高生物安全意识、完善疫病防控措施,建立科学、合理的饲养管理模式;科研机构要投入大量的人力和物力进行相应疫苗、药物、诊断技术的研发和研制;同时对该病防控技术及知识进行普及和宣传;生物制品厂也要发挥作用,以生产和销售合格的生物制品为首要任务;兽医部门也要在疫病防控、技术指导和示范上发挥主体作用。
猪瘟仍然是当前制约我国养猪业发展的主要疫病,是当前规模化猪场必须面对和重点防控的疫病之一,但是只要从源头入手,抓好种猪群和后备猪群的猪瘟净化,就能切断猪瘟在猪场的循环链,结合科学合理的生物安全管理措施,我国定能实现猪瘟的净化。从历史必然性、战略必要性、现实可能性、技术可行性上分析,我们坚信,在多方的共同努力下,中国的猪瘟净化之路并不遥远。
致谢:感谢南京农业大学周斌教授对本文提出的建议和校阅。
[1] MOENNIG V. Introduction to classical swine fever: virus, disease and control policy., 2000, 73: 93-102.
[2] EDWARDS S, FUKUSHO A, LEFÈVRE PC, LIPOWSKI A, PEJSAK Z, ROEHE P, WESTERGAARD J. Classical swine fever: the global situation., 2000, 73(2/3): 103-119.
[3] MOENNIG V, FLOEGEL-NIESMANN G, GREISER-WILKE I. Clinical signs and epidemiology of classical swine fever: a review of new knowledge., 2003, 165(1): 11-20.
[4] 仇华吉, 童光志, 沈荣显. 猪瘟兔化弱毒疫苗¾半个世纪的回顾. 中国农业科学, 2005, 38(8): 1675-1685.
QIU H J, TONG G Z, SEN R X. The lapinized Chinese strain of classical swine fever virus: a retrospective review spanning half a century., 2005, 38(8): 1675-1685. (in Chinese)
[5] RIOS L, CORONADO L, NARANJO-FELICIANO D, MARTÍNEZ- PÉREZ O, PERERA C L, HERNANDEZ-ALVAREZ L, DÍAZ D E ARCE H, NÚÑEZ J I, GANGES L, PÉREZ L J. Deciphering the emergence, genetic diversity and evolution of classical swine fever virus., 2017, 7(1): 17887.
[6] POSTEL A, MOENNIG V, BECHER P. Classical swine fever in Europe-the current situation., 2013, 126(11-12): 468-475.
[7] BEER M, GOLLER KV, STAUBACH C, BLOME S. Genetic variability and distribution of classical swine fever virus., 2015, 16(1): 33-39.
[8] POSTEL A, AUSTERMANN-BUSCH S, PETROV A, MOENNIG V, BECHER P. Epidemiology, diagnosis and control of classical swine fever: Recent developments and future challenges., 2017 Aug 10. doi: 10. 1111/tbed. 12676.
[9] 涂长春. 猪瘟国际流行态势、我国现状及防制对策. 中国农业科学, 2003, 36(8): 955-960.
TU C C. Prevalence situation and control strategies of classical swine fever in the world and China., 2003, 36(8): 955-960. (in Chinese)
[10] OIE. WAHID home page. http://www.oie.int/wahis_2/public/wahid. php/Diseaseinformation/Diseasetimelines. 2016.
[11] PATON D J, MCGOLDRICK A, GREISER-WILKE I, PARCHARIYANON S, SONG J Y, LIOU P P, STADEJEK T, LOWINGS J P, BJÖRKLUND H, BELÁK S. Genetic typing of classical swine fever virus., 2000, 73(2/3): 137-157.
[12] BLACKSELL S D, KHOUNSY S, BOYLE D B, GLEESON L J, WESTBURY H A, MACKENZIE J S. Genetic typing of classical swine fever viruses from Lao PDR by analysis of the 5' non-coding region., 2005, 31(3): 349-355.
[13] LI X, XU Z, HE Y, YAO Q, ZHANG K, JIN M, CHEN H, QIAN P. Genome comparison of a novel classical swine fever virus isolated in China in 2004 with other CSFV strains., 2006, 33(2): 133-142.
[14] Postel A, Schmeiser S, Bernau J, Meindl-BOEHMER A, PRIDOTKAS G, DIRBAKOVA Z, MOJZIS M, BECHER P. Improved strategy for phylogenetic analysis of classical swine fever virus based on full-length E2 encoding sequences., 2012, 43: 50.
[15] POSTEL A, SCHMEISER S, PERERA C L, RODRÍGUEZ L J, FRIAS-LEPOUREAU M T, BECHER P. Classical swine fever virus isolates from Cuba form a new subgenotype 1.4., 2013, 161(3/4): 334-338.
[16] LUO Y, JI S, LEI J L, XIANG G T, LIU Y, GAO Y, MENG X Y, ZHENG G, ZHANG E Y, WANG Y, DU M L, LI Y, LI S, HE X J, SUN Y, QIU H J. Efficacy evaluation of the C-strain-based vaccines against the subgenotype 2.1d classical swine fever virus emerging in China.2017, 201: 154-161.
[17] LUO Y, LI S, SUN Y, QIU H-J. Classical swine fever in China: a minireview., 2014, 172(1/2): 1-6.
[18] TITOV I, TSYBANOV S, MALOGOLOVKIN A. Genotyping of classical swine fever virus using high-resolution melt analysis., 2015, 224: 53-57.
[19] GONG W, WU J, LU Z, ZHANG L, QIN S, CHEN F, PENG Z, WANG Q, MA L, BAI A, GUO H, SHI J, TU C. Genetic diversity of subgenotype 2.1 isolates of classical swine fever virus.2016, 41: 218-226.
[20] ZHANG H, LENG C, FENG L, ZHAI H, CHEN J, LIU C, BAI Y, YE C, PENG J, AN T, KAN Y, CAI X, TIAN Z, TONG G. A new subgenotype 2.1d isolates of classical swine fever virus in China, 2014.2015, 34: 94-105.
[21] DEWULF J, KOENEN F, MINTIENS K, DENIS P, RIBBENS S, DE KRUIF A. Analytical performance of several classical swine fever laboratory diagnostic techniques on live animals for detection of infection., 2004, 119(2): 137-143.
[22] MUÑOZ-GONZÁLEZ S, RUGGLI N, ROSELL R, PÉREZ L J, FRÍAS-LEUPOREAU M T, FRAILE L, MONTOYA M, CORDOBA L, DOMINGO M, EHRENSPERGER F, SUMMERFIELD A, GANGES L. Postnatal persistent infection with classical Swine Fever virus and its immunological implications., 2015, 10(5): e0125692.
[23] 王琴, 涂长春. 猪瘟. 北京: 中国农业出版社, 2015.
Wang Q, Tu C C.. Beijing: China Agriculture Press, 2015. (in Chinese)
[24] 国家统计局. 中华人民共和国国民经济与社会发展报告. 2017, http: //www. stats. gov. cn/english/PressRelease/.
National Bureau of Statistics of China. Statistical Communiqué of the People's Republic of China on the National Economic and Social Development. 2017, http: //www. stats.gov.cn/english/ PressRelease/. (in Chinese)
[25] DONG X N, CHEN Y H. Marker vaccine strategies and candidate CSFV marker vaccines., 2007, 25(2): 205-230.
[26] REIMANN I, DEPNER K, UTKE K, LEIFER I, LANGE E, BEER M. Characterization of a new chimeric marker vaccine candidate with a mutated antigenic E2-epitope., 2010, 142(1/2): 45-50.
[27] HOLINKA L G, FERNANDEZ-SAINZ I, SANFORD B, O'DONNELL V, GLADUE D P, CARLSON J, LU Z, RISATTI G R, BORCA M V. Development of an improved live attenuated antigenic marker CSF vaccine strain candidate with an increased genetic stability., 2014, 471-473: 13-18.
[28] VANDEPUTTE J, CHAPPUIS G. Classical swine fever: the European experience and a guide for infected areas., 1999, 18(3): 638-647.
[29] RIBBENS S, DEWULF J, KOENEN F, LAEVENS H, DE KRUIF A. Transmission of classical swine fever. A review., 2004, 26(4): 146-155.
[30] 王飞. 中国养猪业当前存在的问题及未来的大趋势. 猪业科学, 2017, 34(5): 128
WANG F. The current problems and future trend of pig industry in China., 2017, 34(5): 128. (in Chinese)
[31] 甘孟侯. 目前我国猪传染病的流行特点及防治对策. 兽医导刊, 2010, 7: 28-30.
GAN M H. Epidemic characteristics and control strategy of swine infectious diseases in China., 2010, 7: 28-30. (in Chinese)
[32] PASICK J. Application of DIVA vaccines and their companion diagnostic tests to foreign animal disease eradication., 2004, 5(2): 257-262.
Eradication of Classical Swine Fever in China: is It Far Away?
SUN Yuan, QIU HuaJi
(State Key Laboratory of Veterinary Biotechnology, Chinese Academy of Agricultural Sciences /Harbin Veterinary Research Institute, Harbin 150069)
Classical swine fever (CSF), caused by classical swine fever virus (CSFV), is one of the most devastating diseases to the pig industry worldwide from both economic and sanitary points of view. CSF is notifiable to the World Organization for Animal Health (OIE) and classified as a List-I animal infectious disease in China. The National Middle- to Long-Term Plan for the Prevention and Control of Animal Infectious Diseases (2012-2020) has listed CSF as one of five priority animal diseases to be prevented. C-strain, a lapinized attenuated live vaccine developed by Chinese scientists in the 1950s, is highly safe and efficacious, which plays an important role in the control and eradication of CSF all over the world. Up to now, CSF has been eradicated in more than 30 countries and regions in the world. CSF has a high consequence on the pork industry in China. Therefore, we must be committed to eradicate CSF in China. In the middle of the last century, China had put forward a strategy to eradicate CSF. Now sixty years have passed, however, CSF is still endemic in most parts of China. Some factors seriously restrict the eradication of CSF in China, such as vast territory, complex pig-raising environment, diversified pig-raising modes, various animal diseases, and low-level biosecurity measures, etc. At present, China has entered a new era, the overall national strength has grown considerably, the breeding industry is developing towards a scientific, large-scale and environment-friendly direction, and the scientific research is being gradually improved. The current prevalence of CSF is pretty low and the vaccine manufacturing technologies are being improved. New CSF marker vaccines and companion differential diagnosis techniques have been developed. Some pig-raising enterprises in China are also aware of the importance and significance of the eradication of CSF. The government is also actively taking actions to formulate corresponding regulations and policies and to organize farmers, pig-raising enterprises and veterinary administrative departments to carry out local CSF eradication. All these make the eradication of CSF possible and practical. This review summarized the recent situation concerning CSF in China and the world. The importance of the eradication of CSF in China and the favorable and unfavorable conditions for the eradication of CSF were discussed. The cost and benefit of the eradication of CSF in China was also analyzed. This review also summarized the eradication experiences of CSF in Europe and USA and discussed the ideas and plans for the eradication of CSF in China. Considering its historical inevitability, strategic necessity, realistic possibility, and technical feasibility, we believe that the eventual eradication of CSF in China is never so far away from us.
classical swine fever; classical swine fever virus; eradication; China
10.3864/j.issn.0578-1752.2018.21.015
2018-01-24;
2018-05-04
国家重点研发计划(2017YFD0500601)
孙元,E-mail:sunyuan@caas.cn。通信作者仇华吉,E-mail:qiuhuaji@caas.cn
(责任编辑 林鉴非)

