葡萄LBD基因家族的鉴定与表达分析
何红红,马宗桓,张元霞,张娟,卢世雄,张志强,赵鑫,吴玉霞,毛娟
葡萄LBD基因家族的鉴定与表达分析
何红红,马宗桓,张元霞,张娟,卢世雄,张志强,赵鑫,吴玉霞,毛娟
(甘肃农业大学园艺学院,兰州 730070)
【目的】通过生物信息学分析明确LBD转录因子在葡萄基因组中的数量、结构和非生物胁迫差异表达,为探究LBD转录因子在葡萄非生物胁迫中的作用奠定理论基础。【方法】根据已经报道的拟南芥LBD基因,利用葡萄基因组数据库中的BLAST软件鉴定葡萄基因组中的LBD基因。采用DNAMAN5.0、Clustalx、MapInspect、MEME、GSDS2.0、ExPASy和MEGA5.0等软件进行生物信息学分析。利用PLEXdb中葡萄Affymetrix GeneChip 16K基因芯片数据绘制芯片表达谱。采用qRT-PCR方法检测VvLBD基因家族在逆境胁迫中的表达情况。【结果】从葡萄(L.)全基因组中鉴定得到30个LBD基因家族成员,可分为ClassⅠ和ClassⅡ两类,ClassⅠ分为5个亚族,分别是Ⅰa、Ⅰb、Ⅰc、Ⅰd和Ⅰe,ClassⅡ分为2个亚族,分别是Ⅱa和Ⅱb。理化性质分析表明,VvLBD基因家族编码氨基酸数目介于127—386,理论等电点分布在4.77—9.28。定位分析发现,该基因家族的30个基因分布于葡萄19条染色体中的11条染色体上,其中第13染色体上分布最多,有7个基因。多序列比对和motif分析结果表明,VvLBD基因家族具有特定的3个保守结构域,分别是类锌指结构、亮氨酸拉链结构和甘氨酸-丙氨酸-丝氨酸(GAS)结构。亚细胞定位分析表明,VvLBD基因家族主要在叶绿体、线粒体和细胞核中进行表达。VvLBD基因家族的二级结构主要以α-螺旋和不规则卷曲为主。VvLBD基因芯片表达谱分析发现,大部分基因在盐胁迫和PEG胁迫下表达量上升,并且胁迫时间的长短对该基因家族成员的表达也存在差异。qRT-PCR分析结果表明,VvLBD基因家族成员中、、、、、在400 mmol·L-1NaCl处理条件下呈上调表达,表达量分别是对照的3、1、8、4、5和13倍,和在10% PEG处理条件下呈上调表达,表达量分别是对照的4和26倍。【结论】从葡萄基因组中一共鉴定出30个LBD基因家族成员,分布于11条染色体上,并且结构进化高度保守;所有成员都与逆境相关,但是该基因家族成员在不同逆境胁迫下的响应程度存在一定的差异。
葡萄;LBD基因家族;进化分析;表达谱;实时荧光定量PCR
0 引言
【研究意义】葡萄()是一个重要的经济作物,在全世界具有很高的经济价值,种植区域广泛。然而中国西北地区存在许多不利于葡萄生长和结果的因素(如寒冷、干旱、盐碱等)[1],有针对性地进行非生物胁迫基因的研究和改造,可以抵御不利于葡萄生长的自然环境,从而提高和改善葡萄的产量和品质。【前人研究进展】转录因子(transcription factors,TF)基因家族在植物的一些生物合成过程(如生长、发育、信号转导和对环境压力胁迫反应)中起着重要的作用。利用生物信息学研究葡萄基因家族的功能已在葡萄中大量报道,如、、、、、和等基因家族[2-8]。侧生器官边界域(lateral organ boundaries domain,LBD)基因也称作AS2/LOB基因,是一类植物中所特有的转录因子基因家族[9],该基因家族参与高等植物侧生器官形态建成,特别是在侧生器官与顶端分生组织之间边界的形态建成起到关键作用[10-15]。在调控植物生长发育进程中,尤其在响应逆境胁迫中具有积极作用[16-18]。LBD基因包含3个特定的保守结构域,分别是类似锌指的CX2CX6CX3C结构域、类似亮氨酸拉链(LX6LX3LX6L)的“螺旋卷曲”(coiled coil)二级结构和甘氨酸-丙氨酸-丝氨酸(GAS)区域[18-19]。目前,LBD基因已经在许多植物中被鉴定,如拟南芥43个[10]、玉米44个[20]、毛果杨57个[21]、大麦24个[22]、辣椒45个[18]、番茄46个[16]和蒺藜苜蓿56个[23]。在拟南芥中,()可调控拟南芥叶片早期的发育,()可抑制近轴面区域的细胞增殖[24],使叶片发育成两面对称的平展叶,受生长素和细胞分裂素诱导并调控拟南芥的激素响应[25-30],通过响应硝酸盐的合成,影响花青苷形成和氮素代谢[31-32]。在柑桔中,同源物可能通过调控参与扩增、生物合成和降解的细胞壁代谢基因的表达进而调控对细菌溃疡病的耐药性[33-34]。多种植物关于LBD基因芯片的表达分析表明该基因家族会响应不同的生物或非生物胁迫。番茄中,LBD基因在调控非生物胁迫时发挥重要作用[16]。苎麻中,16个BnLBDs能够增加植株在高温环境下的耐受力[35]。苜蓿中,幼苗期进行干旱处理,有一部分LBD基因在根的形态建成过程中变化差异较大[23]。辣椒中,LBD基因中ClassⅠ在响应高温胁迫时明显低于ClassⅡ,且在不同时长的高温胁迫下其表达量存在差异[17]。大豆中,受干旱、低温、盐碱和各种激素的强烈诱导[36]。【本研究切入点】目前,葡萄LBD基因家族虽有报道[37-38],但其主要是对基因芯片表达谱数据的分析研究,定量分析研究较少[38],尤其是对逆境胁迫下表达的分析鲜见报道。【拟解决的关键问题】本研究利用生物信息学方法探究VvLBD基因家族的分布、基因结构与表达分析,通过芯片表达谱进行基因在非生物胁迫下的功能预测,分析VvLBD基因家族在试管苗葡萄叶片中的表达情况,为VvLBD基因家族响应逆境胁迫时的功能奠定理论基础。
1 材料与方法
1.1 试验材料
试验于2016—2017年进行。荧光定量所用试验材料为‘红地球’葡萄(‘Red Globe’)试管苗,保存于甘肃农业大学果树生理与生物技术实验室。将试管苗单芽茎段接于固体GS培养基上,分别置于LED白光下培养35 d后,分别用50 μmol·L-1ABA、400 mmol·L-1NaCl以及10%PEG处理24 h,每个处理设置3组重复,等体积蒸馏水处理为对照。
基因芯片表达谱所用试验数据取自于GEO数据库中的GSE31594和GSE31662,其试验材料为‘赤霞珠’葡萄()。GSE31662数据是‘赤霞珠’软化的绿色浆果在培养皿中离体培养,在培养皿中加入0.3 mol·L-1蔗糖+脱落酸(ABA)作为处理,未处理的作为对照(CK1),每个处理设置3个重复,在处理后的3和10 d分别进行取样。GSE31594数据是‘赤霞珠’生长在水培滴灌系统中,用120 mmol·L-1(10﹕1 NaCl﹕CaCl)、聚乙二醇(PEG)和低温(5℃)分别进行处理,未处理的作为对照(CK2),每个处理设置3个重复。分别在1、4、8和24 h采集叶片,其中24 h不用低温处理。
1.2 葡萄LBD基因家族成员鉴定
根据文献获得拟南芥()的LBD基因ID[18]。并从NCBI网站(https://www.ncbi.nlm. nih.gov/nuccore/NM_113577.4)获得每一条基因对应的CDS与Full-length的序列。将获得的CDS序列提交到葡萄基因库中,同源搜索VvLBD基因,获取已知序列的基因号、CDS长度、氨基酸数目、cDNA和Full-length,保留长度大于1 000 bp的序列。并运用DANMAN进行多重比对,依据LBD基因家族所具有的特定结构域,手动去除不含有LBD特定结构域或者结构域不完整的序列。利用ExPASy(http://web.expasy.org/protparam/)在线软件对葡萄LBD蛋白的分子量和等电点进行预测。从葡萄基因组网站获取染色体基本信息,选取LBD基因的位置信息,利用MapInspect程序绘制其染色体物理位置图。
1.3 葡萄LBD基因家族进化、基因结构、motif和亚细胞定位分析
利用Clustal x对葡萄和TAIR(http://www. arabidopsis.org/)中拟南芥LBD蛋白进行多序列比对,使用MEGA5.0构建LBD家族系统发育树[35],Bootstrap值设置为1 000。在线软件GSDS2.0(http://gsds.cbi.pku.edu.cn/)用于分析基因结构[39]。用DNAMAN进行结构域序列多重比对,采用(http://meme-suite.org/tools/meme)进行motif序列分析;采用WoLF PSORT进行亚细胞定位(http://www. genscript.com/wolf-psort.html)。
1.4 葡萄LBD基因家族基因芯片表达模式分析
从NCBI的GEO数据库中下载葡萄RNASeq数据,登录号为GSE31662和GSE31594,用核酸序列为探针检索出序列相同的Affymetrix GeneChip 16K基因ID,然后提取在各种非生物胁迫下的RNASeq数据,通过Excel对数据进行log2转换,最后用HemI制作表达热图(heatmap)。
1.5 实时荧光定量PCR
对VvLBD基因家族的CDS序列进行引物设计(表1)。cDNA合成用Prime Script RT reagent Kit(Perfect Real Time)试剂盒(TaKaRa)。反转录产物-20℃保存备用。实时荧光定量PCR(real-time fluorescent quantitative polymerase chain reaction, qRT-PCR)应用Bio-Rad iCycler iQ实时定量PCR仪进行扩增,以葡萄为内参[40],扩增体系为2 μL cDNA、上下游引物各1 μL、SYBR 10 μL反应MIX和6 μL ddH2O。反应程序为95℃ 30 s;95℃ 5 s,60℃ 34 s,95℃ 15 s,60℃ 60 s,95℃ 15 s,共40个循环。3次重复,数据用Excel软件分析。
1.6 试验数据统计与分析
采用Excel进行数据统计与分析,采用单因素(One-way ANOVO)的Duncan’s法进行显著性差异分析,显著性水平为<0.05,并作图。
2 结果
2.1 葡萄LBD基因家族的蛋白质理化性质分析
经同源搜索获得30个,分别命名为—。通过对染色体进行定位分析(图1),发现该家族30个基因分布于葡萄11条染色体上(Chr.01、Chr.03、Chr.06、Chr.07、Chr.08、Chr.13、Chr.14、Chr.15、Chr.16、Chr.17和Chr.18),其中第13染色体上有7个基因(、、、、、和)。在第3、第8和第18染色体上分别含有1个基因,有2个基因分布在未知染色体上。VvLBD1蛋白序列最长,包含386个氨基酸残基,VvLBD13蛋白序列最短,含127个氨基酸残基。分子量为14.19636—43.30087 kD;等电点介于4.77—9.28。外显子数介于1—4,的外显子数是4,的外显子数是1,外显子数为2的有18个基因,外显子数为3的有10个基因(表2)。说明该转录因子基因家族是一个相对保守的基因家族。
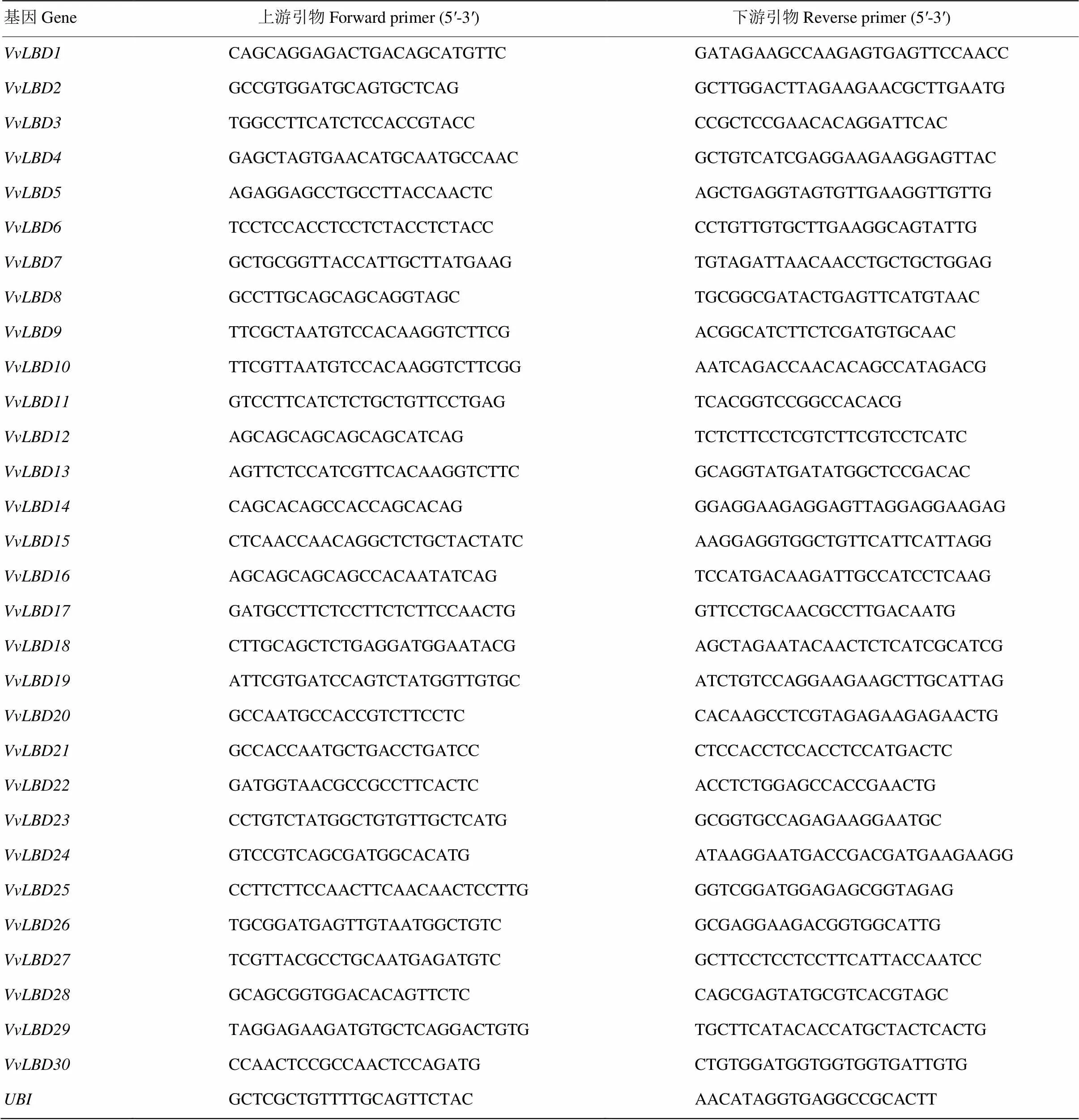
表1 VvLBD基因家族表达分析的实时荧光定量引物
2.2 葡萄LBD基因家族多序列比对分析
通过对30个VvLBD蛋白序列进行多序列比对,发现VvLBD蛋白序列的N端都含有1个由15个氨基酸组成的保守CX2CX6CX3C序列(图2),预测其可能直接参与下游基因顺式元件的结合,说明30个基因家族功能域完整。ClassⅠ类蛋白结构域C端含有赖氨酸组成的类似亮氨酸拉链LX6LX3LX6L螺旋卷曲结构(图2)。大部分VvLBD蛋白都具有GAS保守结构,—、—、、—的序列是GAS结构,GAS保守结构区域中,、、、、和的序列是GRA,的序列是GRS结构,进一步说明该基因家族序列高度保守,在葡萄体内可能行使相似的功能。

图1 葡萄LBD基因家族在染色体上的位置
2.3 葡萄LBD基因家族基因结构和进化分析
通过对VvLBD基因家族基因进行结构分析,结果表明,30个VvLBD基因分为两类,分为为ClassⅠ和ClassⅡ,分别含有23个和7个LBD蛋白。在葡萄LBD基因家族中有10个旁系同源系基因,其中有4对旁系同源系基因/、/、/、/的自展值高于90。如图3所示,基因结构分析发现葡萄LBD基因结构内含子数均小于3个,外显子数约为4个,但不含内含子。有18个基因(、—、—、—、—、—)仅含1个内含子,有10个基因(、、、—、—、—)含有2个内含子,只有含有3个内含子。聚类关系较近的基因具有相似的基因结构,如7个ClassⅡ基因中的、和含有1个内含子,、、和含有2个内含子,且内含子结构高度相似。在10个旁系同源系中自展值大于90的4对基因结构也高度相似,分别为/、/、/和/。
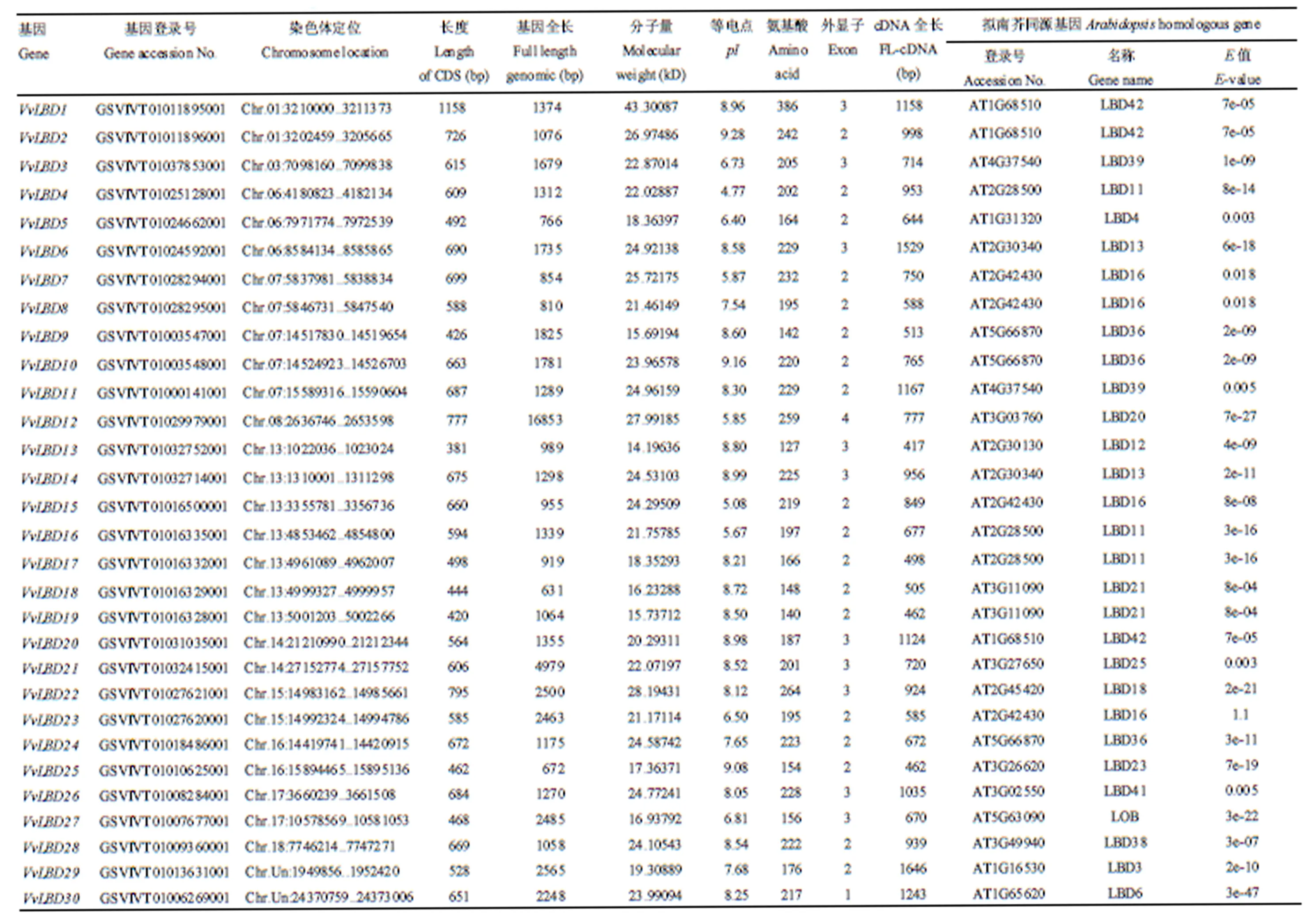
表2 葡萄中LBD转录因子家族信息
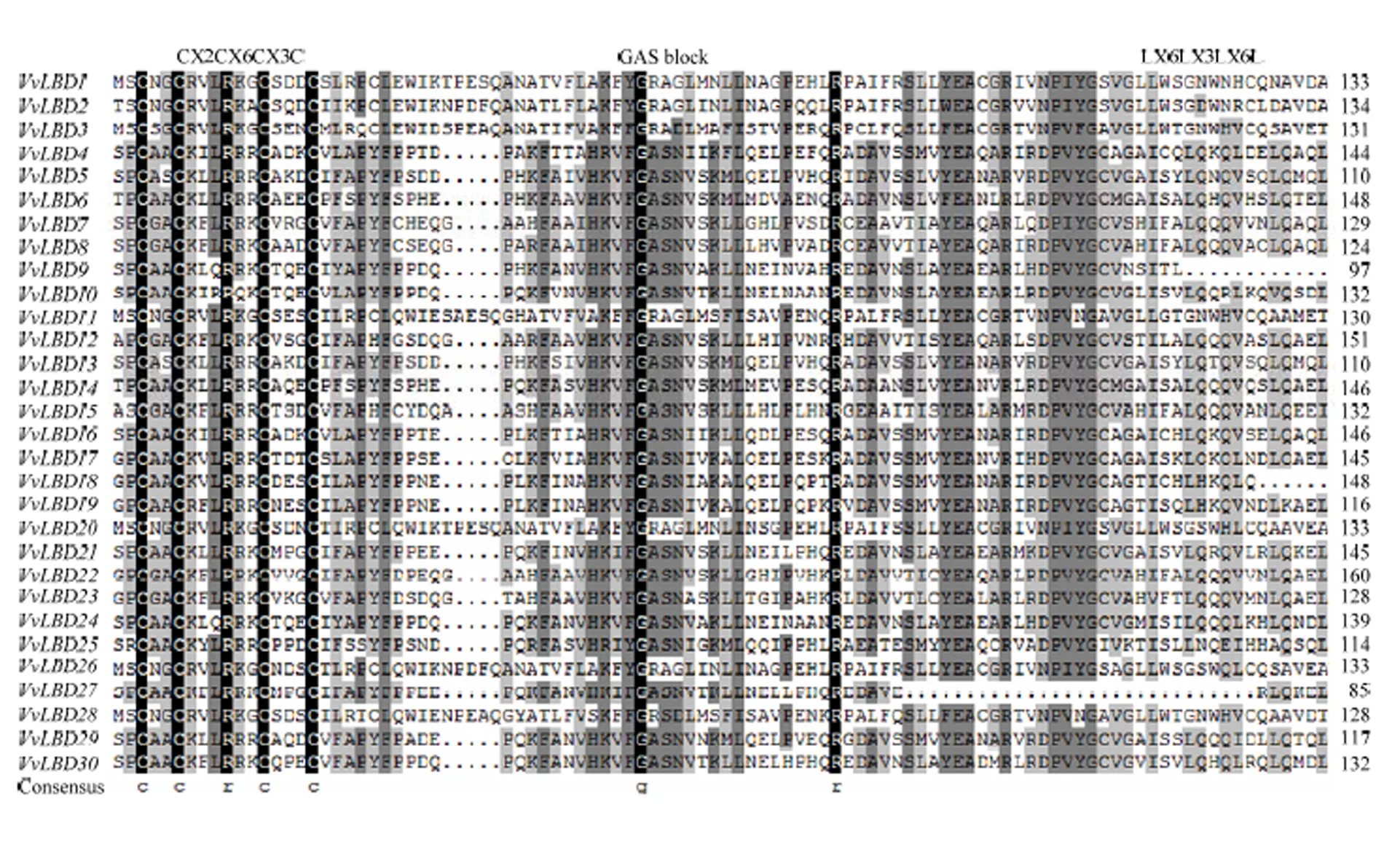
图2 葡萄LBD家族保守结构域比对
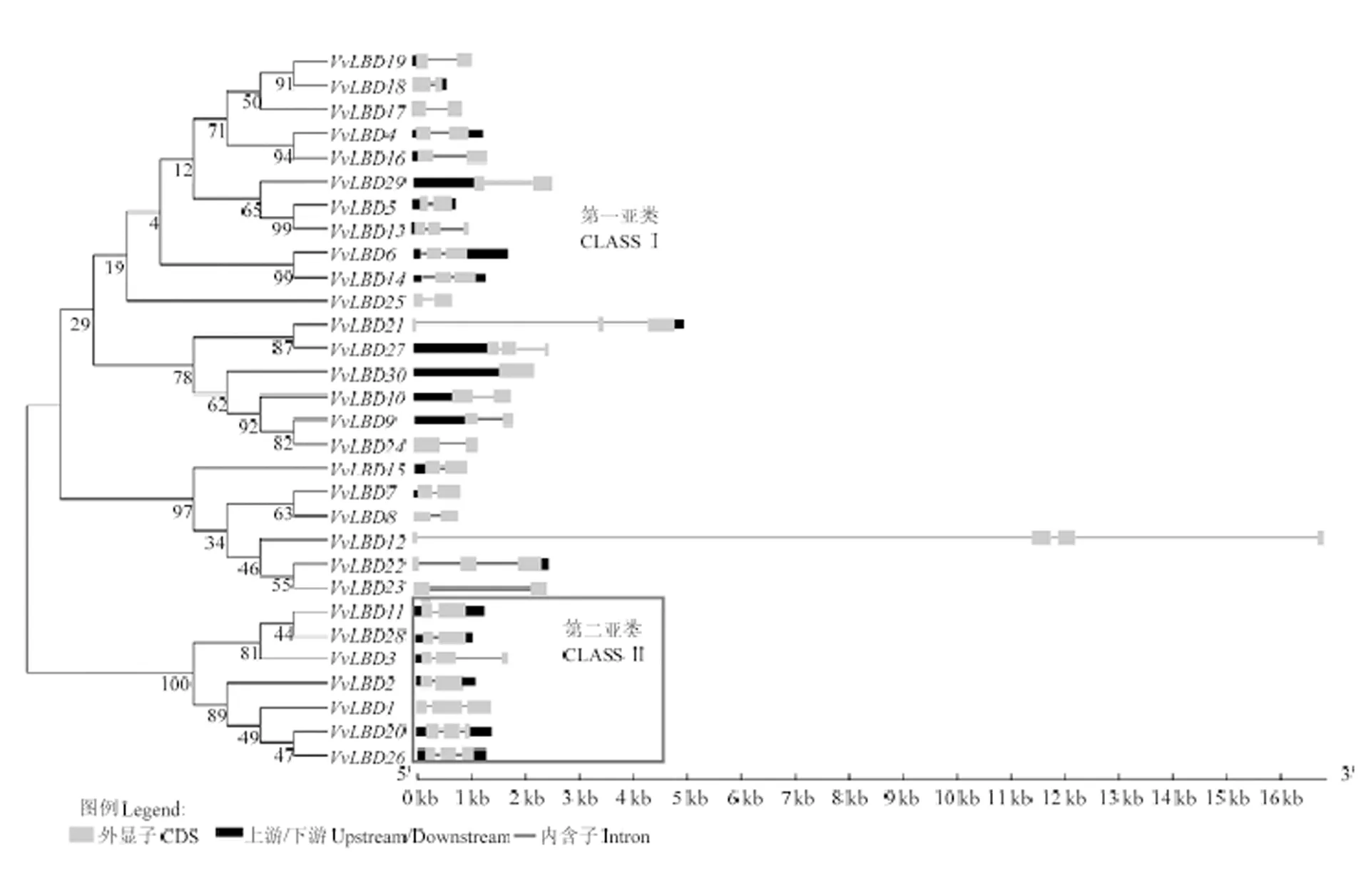
图3 葡萄LBD家族进化树及基因结构
为进一步了解VvLBD基因家族的进化特性,利用拟南芥LBD基因家族成员与葡萄LBD基因家族成员构建系统进化树(图4)。将葡萄ClassⅠ分为Ⅰa、Ⅰb、Ⅰc、Ⅰd和Ⅰe等5个亚类,分别包含6、2、6、4和5个VvLBD家族成员,ClassⅡ分为Ⅱa和Ⅱb 2个亚类,分别包含3和4个VvLBD家族成员,说明VvLBD基因家族成员之间即高度保守,又存在一定的差异,这与基因家族的功能有相似之处。
2.4 葡萄LBD基因家族motif序列分析
VvLBD基因家族中最主要的motif有3个(图5-A):C端均含有一个保守的半胱氨酸残基组成的锌指结构CX2CX6CX3C(motif 2)基序,推测其可能直接与基因顺式作用元件相接合;一个完全保守的GAS(Gly-Ala-Ser)保守结构(motif 1);N端为一个类似亮氨酸拉链的螺旋卷曲结构亮氨酸拉链式基序LX6LX3LX6L(motif 3),可能参与转录因子的二聚化过程。图5-B为MEME搜索得到的8个模体,motif 1和motif 2在所有成员中均有出现,motif 3只出现在大多数ClassⅠ成员当中,motif 4分布在ClassⅡ的所有成员中,motif 5出现在ClassⅡ的4个基因中,motif 6出现在ClassⅡ的3个基因中,motif 7主要出现在ClassⅠ中的部分成员中,motif 8只出现在ClassⅠ中的第四对旁系同源系的2个基因中。虽然不同亚族中包含motif种类和motif的排列顺序不同,但是同一亚族中,均包含相同的motif排列,这可能与该基因家族功能的表达方面有很大的关系。
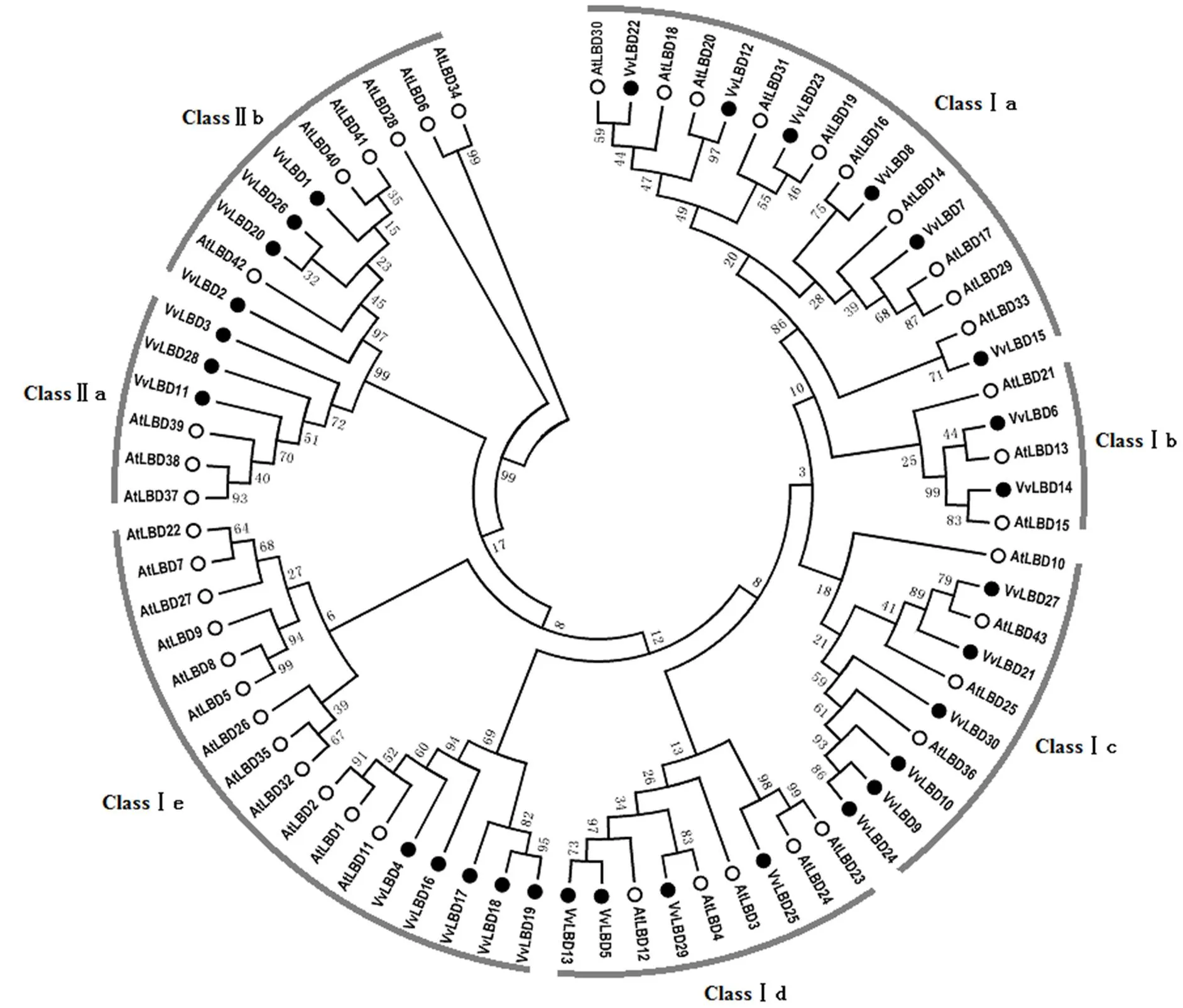
图4 葡萄(●)与拟南芥(○)LBD转录因子的系统进化树分析
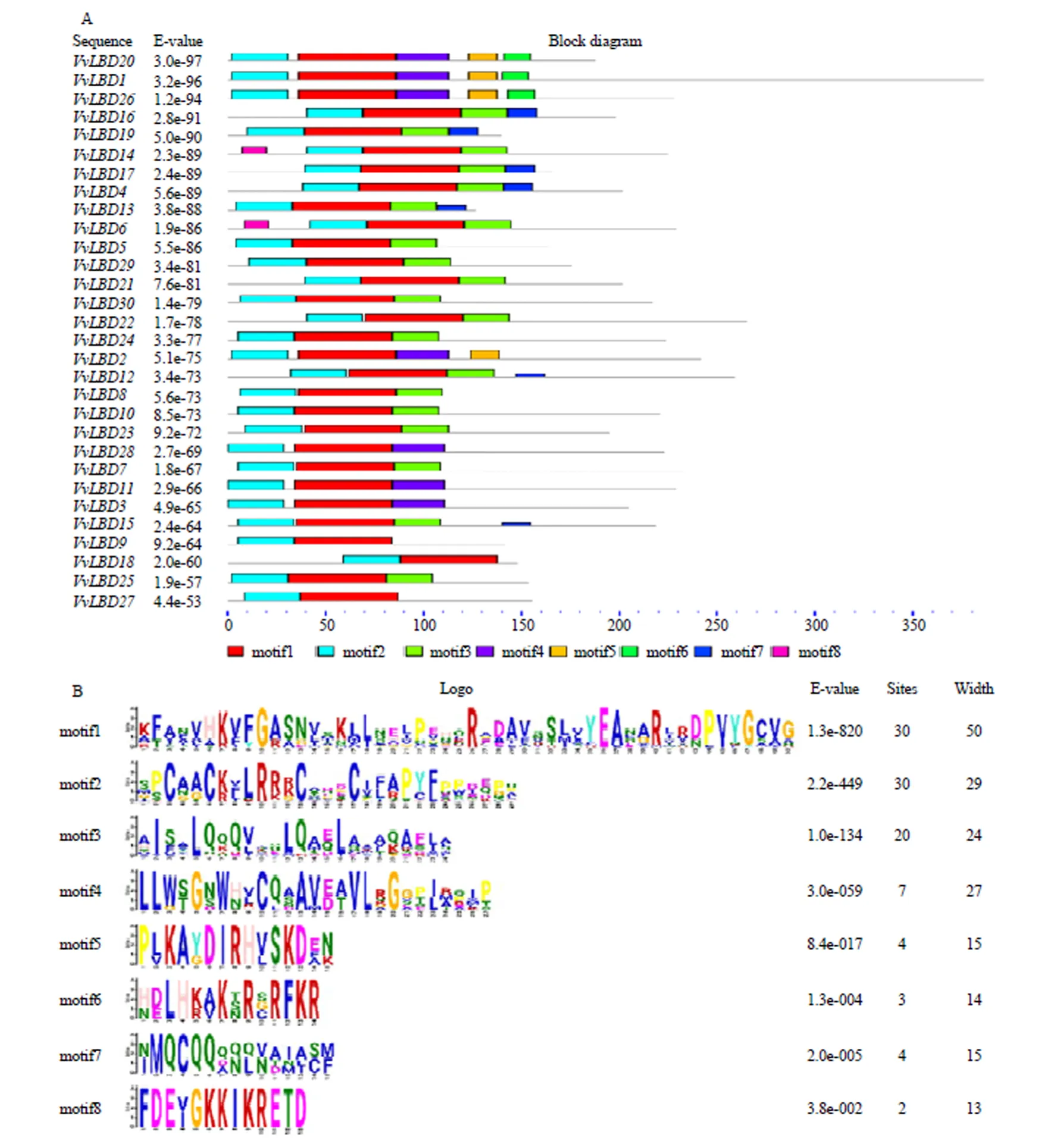
A:葡萄LBD基因家族motif分析;B:MEME预测的8个保守位点LOGO图
2.5 葡萄LBD基因家族亚细胞定位和蛋白质二级结构分析
VvLBD基因家族主要集中在叶绿体、线粒体和细胞核中进行表达(表3),说明该基因家族主要存在于光合、呼吸代谢较强的器官中。其中VvLBD基因家族在细胞质中表达的基因只有、、、、、、和;在叶绿体中除了和没有表达外,其余基因均有表达;在细胞核中除了、、、中没有表达,其余基因均有表达;在线粒体中除了、、、、、、、、和这10个基因没有表达外,其他基因均有表达;在过氧化物酶体、液泡、内质网、高尔基体和细胞基中都没有表达;在细胞骨架中表达的基因只有,说明其可能参与了细胞壁的形成。
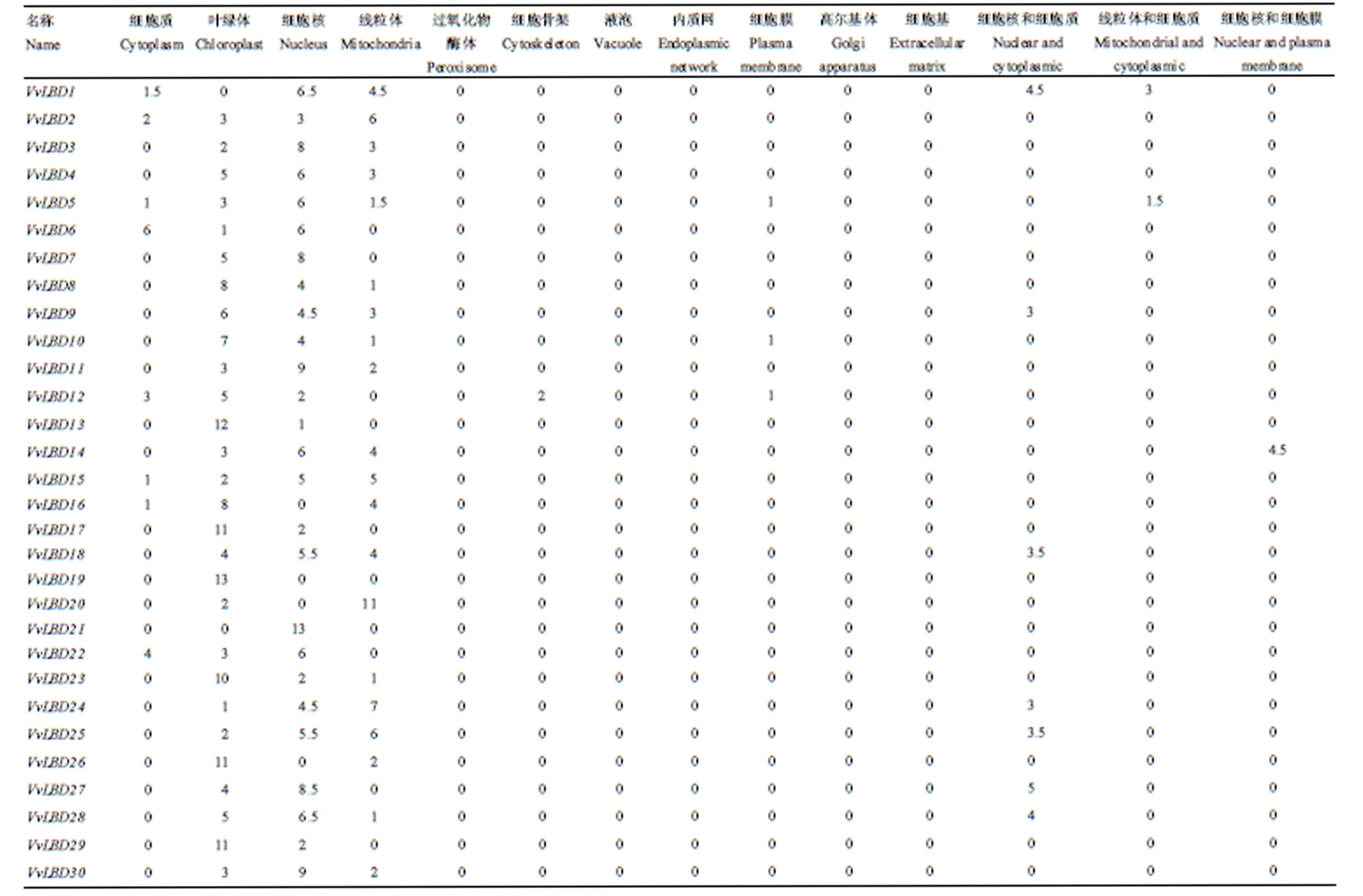
表3 葡LBD基因亚细胞定位预测
VvLBD基因家族编码蛋白质的二级结构主要有α-螺旋、β-转角与不规则卷曲。VvLBD基因家族编码的30个蛋白主要是α-螺旋(20.66%—56.36%)和不规则卷曲(26.77%—53.72%),β-转角较少(0— 12.96%)(表4)。
2.6 葡萄LBD基因家族表达模式分析
从葡萄基因组数据库中克隆出30个LBD基因,对其中29条VvLBD(未在芯片数据检索到)基因进行芯片表达模式的分析(图6),在ABA胁迫下,和的表达量明显上调,而、、、、、的表达量明显下调;在盐、PEG、低温胁迫下,、、、、、、、、、和的表达量明显上调,、和的表达量明显下调。此外,逆境胁迫时间的长短对VvLBD基因家族的表达也存在不同的影响,如在ABA胁迫4 h的表达和对照(CK1)无差异,而在ABA处理8 h的表达量明显比对照(CK1)下调趋势;在盐和PEG处理24 h后表达量明显高于对照(CK2)。在1 h盐胁迫下的表达量和对照(CK2)相同,而在4、5和6 h盐胁迫下的表达量明显比对照(CK2)有所下调,说明该基因家族成员响应不同逆境胁迫和不同胁迫时间的反应机制之间存在差异。
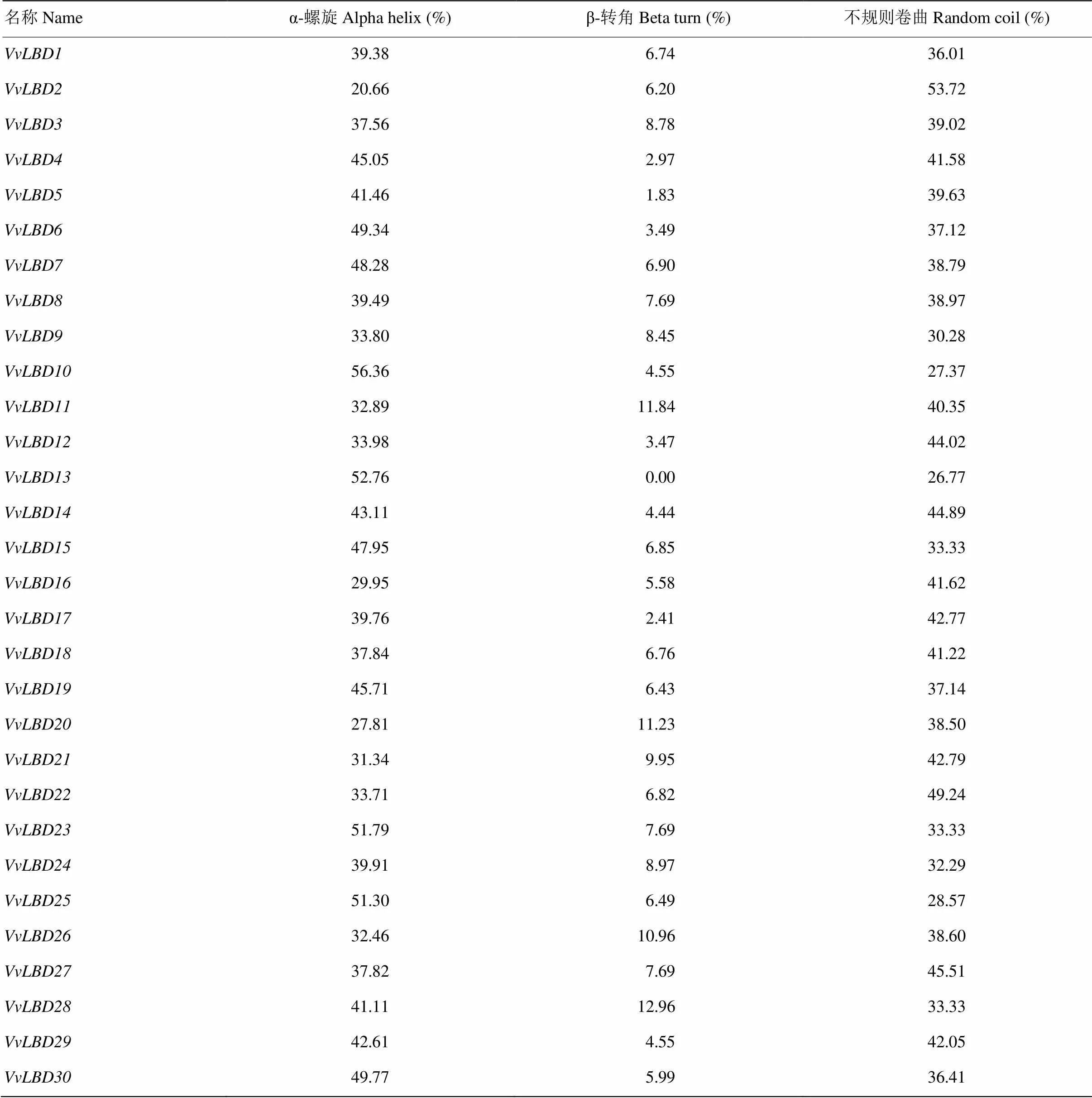
表4 葡萄LBD蛋白二级结构分析
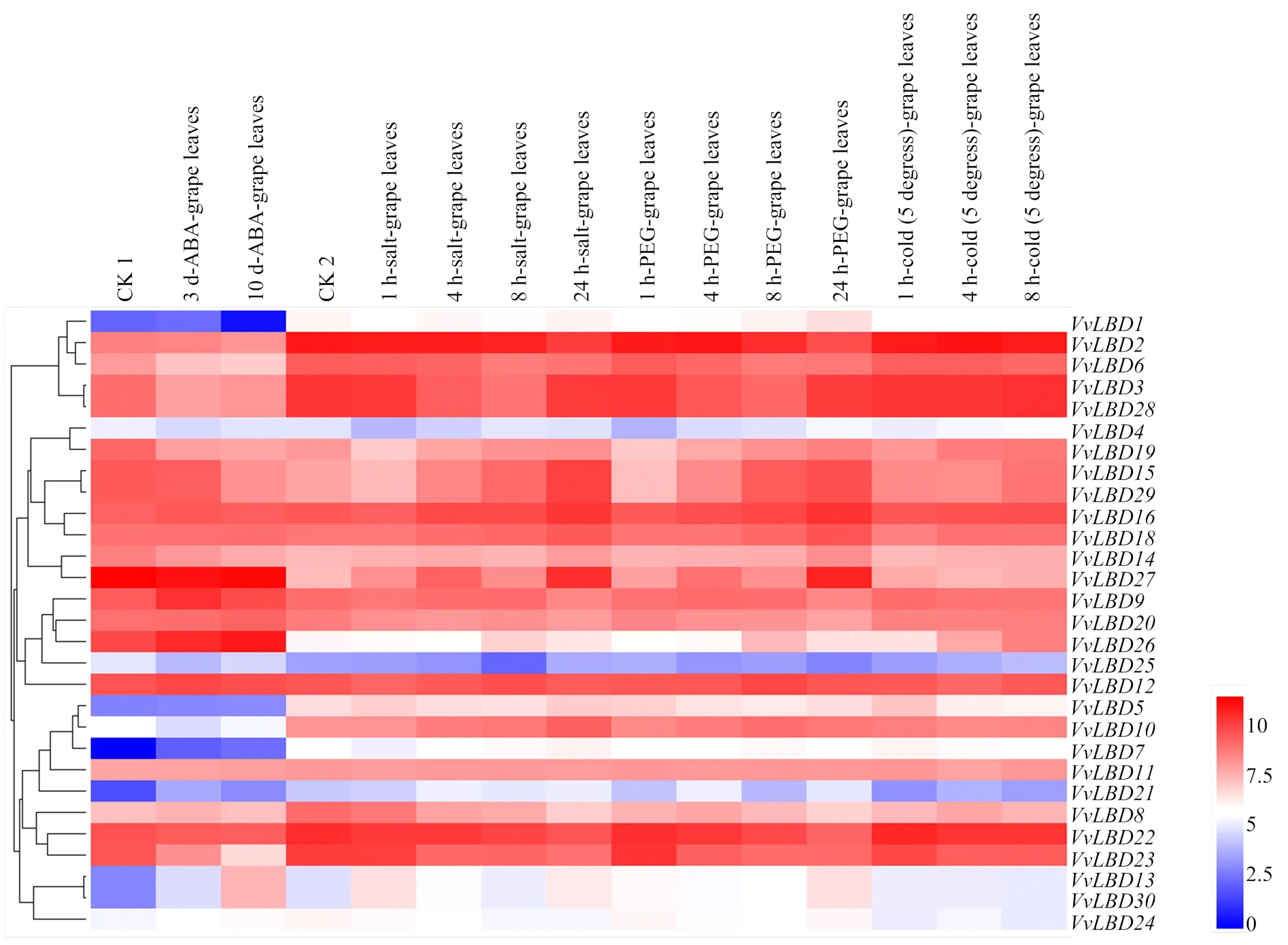
图中用深蓝、浅蓝、无色、浅红、深红五色代表基因表达水平。蓝色表示基因表达弱,红色表示基因表达强
2.7 葡萄LBD基因的实时荧光定量分析
VvLBD基因家族受NaCl、ABA和PEG的诱导,各处理间表达量具有较显著的差异,在400 mmol·L-1NaCl处理24 h条件下,VvLBD基因家族明显上调表达(图7)。—、—、—、—、—、、—在50 μmol·L-1ABA、400 mmol·L-1NaCl和10% PEG处理24 h后,均呈下调表达。和在ABA、NaCl和PEG处理后,均呈上调表达。在PEG处理后,呈上调表达。、—、—在NaCl处理后,呈现出明显上调表达,而在ABA和PEG处理后,呈现出明显下调表达。在ABA、NaCl和PEG处理24 h后,均呈上调表达,且在NaCl处理后,表达量是对照的8倍;在ABA处理后,表达量是对照的5倍;在PEG处理后,表达量是对照的3倍。结果表明,在VvLBD基因家族成员中,部分基因受400 mmol·L-1NaCl、50 μmol·L-1ABA、10%PEG的强烈诱导;部分基因对400 mmol·L-1NaCl、50 μmol·L-1ABA和10%PEG的胁迫并不敏感。

A:对照;B:400 mmol·L-1NaCl处理24 h;C:50 μmol·L-1ABA处理24 h;D:10%PEG处理24 h
A: Control; B: 24 h treatment by 400 mmol·L-1NaCl; C: 24 h treatment by 50 μmol·L-1ABA; D: 24 h treatment by 10%PEG
图7 葡萄LBD基因在不同处理下的表达
Fig.7gene expression under different treatment
3 讨论
本研究通过已知拟南芥LBD蛋白序列从葡萄基因组数据库中同源搜索到30个VvLBD基因,Grimplet等[38]研究结果表明,VvLBD基因家族成员有50个,并对VvLBD基因家族的生物信息学分析,利用基因芯片数据分析、组织表达和逆境胁迫等多方面功能的预测,但是通过比较分析发现,其中大部分基因结构是不完整的,因此未对基因的功能进行确切的验证。本研究通过去掉一些结构域不存在的序列后,用实时荧光定量法对葡萄试管苗进行了非生物胁迫的相关功能验证。结果表明,30个VvLBD基因在染色体上所处的位置均有所差异,理化性质也存在一定的差异。通过VvLBD基因家族多序列比对,发现它与拟南芥、玉米、番茄具有相似的结构域,推测VvLBD基因与它们可能具有相似的功能[16, 20-21]。在ClassⅠ的VvLBD基因家族成员中,LOB 结构域的C端大部分包含有一个类似亮氨酸拉链的LX6LX3LX6L螺旋卷曲二级结构,这可能与转录因子间的二聚化相关[16-17],而VvLBD基因家族中7个ClassⅡ成员均不含该结构域,这与普通烟草中研究结果有相似的特点[41]。本试验对VvLBD基因家族和拟南芥基因家族进行聚类分析,结果表明,在葡萄中ClassⅠ有对自展值在95以上的直系同源系基因/。Thatcher等[15]研究结果表明,在拟南芥中对尖孢镰刀杆菌的防御过程中发挥着负调控作用。Zhu等[43]认为()和()的表达在拟南芥中受生长素诱导,同时聚类于ClassⅠ中,相对应的葡萄LBD同源基因和可能具有相似的功能。VvLBD基因结构分析表明聚类关系较近的基因具有相似的基因结构,这与番茄LBD基因家族的聚类分析结果相近[16]。对VvLBD基因家族编码蛋白质二级结构进行预测,发现该基因编码蛋白质以α-螺旋和不规则卷曲为主。motif序列分析表明,在VvLBD基因家族中主要存在3个保守序列,分别是GAS保守结构域、锌指结构域和亮氨酸拉链卷曲螺旋基序[10,41-42]。说明该基因家族与水稻、玉米和大麦的LBD基因家族高度相似。
本研究对葡萄LBD基因芯片数据进行分析,结果表明,在非生物胁迫条件下,该基因家族在葡萄果皮和叶片中表达,在ABA胁迫下,‘赤霞珠’浆果果皮中的表达量最高。在盐、ABA、PEG和低温胁迫下,在‘赤霞珠’叶片中,、、和的表达量最高,其中、和都在ClassⅡ亚族中,研究结果与拟南芥、水稻等植物LBD家族的表达模式相似[17,43]。但是,不同时长的逆境胁迫可以使葡萄LBD基因有不一样的表达情况,如:在ABA胁迫4 h的表达和对照(CK1)无差异,而在ABA处理8 h的表达量明显比对照(CK1)下调;在1 h盐胁迫下的表达量和对照(CK2)一样,而在4、5和6 h盐胁迫下的表达量明显比对照(CK2)有所下调(图6)。
AtLBD蛋白参与调控植物生长发育的多种过程,在胚胎形成、侧生组织发育、花青苷合成以及氮代谢过程报道的较多[44-45],然而对于LBD基因应对非生物胁迫响应的研究较少。在ClassⅠa亚族中的和ClassⅠd亚族中的,在50 μmol·L-1ABA、400 mmol·L-1NaCl和10% PEG处理24 h后,各处理间的表达没有显著差异。葡萄、、—,在400 mmol·L-1NaCl处理24 h后呈现明显上调趋势,葡萄—、—、—、、—、、,在50 μmol·L-1ABA、400 mmol·L-1NaCl和10%PEG处理24 h后呈现出下调趋势。只在10%PEG处理24 h后基因表达呈现上调趋势,且表达量是对照的26倍。Grimplet等[38]研究结果表明5在浆果果皮中表达,并且在外源ABA处理下表现出正调控作用,而在本文的定量分析中发现在外源ABA处理下的表达量并没有显著的变化(对应着本文研究的)。以上研究结果与Cao等[37]有关VvLBD基因家族关于逆境胁迫的研究成果有相似之处。本研究表明,在ClassⅠ和ClassⅡ2个亚族中的VvLBD基因对400 mmol·L-1NaCl胁迫24 h后上调表达较为强烈,而对于ABA、PEG的胁迫下的相对表达下调趋势较为明显。推测VvLBD基因家族的ClassⅠ和ClassⅡ 2个亚族都参与了逆境胁迫应答,且在不同植物中LBD基因存在不同的调控机制。
4 结论
获得30个VvLBD基因家族成员,且含有保守结构域,可分为2大类和7个亚类。除在细胞骨架中表达以外,其他基因主要在叶绿体、线粒体和细胞核中表达。在响应不同时长不同逆境胁迫时,不同的基因起到不同的表达调控作用。
[1] 康天兰, 郑平生, 王艳玲. 甘肃葡萄栽培的历史、现状与未来发展趋势. 中外葡萄与葡萄酒, 2009(5): 77-79.
KANG T L, ZHENG P S, WANG Y L. The history, present situation and future trend of grape cultivation in gansu province., 2009(5): 77-79. (in Chinese)
[2] DÍAZ-RIQUELME J, LIJAVETZKY D. MARTÍNEZ-ZAPATER J M, CARMONA M J. Genome-wide analysis of MIKCCtype MADS box genes in grapevine., 2009, 149(1): 354-369.
[3] WAN S B, LI W L, ZHU Y Y, LIU Z M, HUANG W D, ZHAN J C. Genome-wide identification, characterization and expression analysis of the auxin response factor gene family in, 2014, 33(8): 1365-1375.
[4] Guo C L, Guo R R, Xu X Z, Gao M, Li X Q, Song J Y, Zheng Y, Wang X P. Evolution and expression analysis of the grape (L.)gene family., 2014, 65(6): 1513-1528.
[5] 马宗桓, 毛娟, 李文芳, 杨世茂, 吴金红, 陈佰鸿. 葡萄SnRK2家族基因的鉴定与表达分析. 园艺学报, 2016, 43(10): 1891-1992.
MA Z H, MAO J, LI W F, YANG S M, WU J H, CHEN B H. Identification and expression analysis of grape SnRK2 family genes., 2016, 43(10): 1891-1992. (in Chinese)
[6] 闫朝辉, 李桂荣, 扈岩松, 周瑞金, 扈惠灵, 苗卫东, 朱自果. 欧洲葡萄中CIPK基因的克隆及表达分析. 园艺学报, 2017, 44(8): 1463-1476.
YAN C H, LI G R, HU Y S, ZHOU R J, HU H L, MIAO W D, ZHU Z G. Cloning and expression analysis of CIPK genes in grapevine., 2017, 44(8): 1463-1476. (in Chinese)
[7] 袁月, 张亚光, 高世敏, 陶建敏. 葡萄基因家族生物信息学及表达. 中国农业科学, 2016, 49(19): 3786-3797.
YUAN Y, ZHANG Y G, GAO S M, TAO J M. Bioinformatics and expression of thegene family in grape., 2016, 49(19): 3786-3797. (in Chinese)
[8] 尹欢, 蔡斌, 李成慧, 陈飞. 葡萄转录因子家族全基因组分析. 江西农业学报, 2013, 25(9): 1-6.
YIN H, CAI B, LI C H, CHEN F. Genome-wide analysis oftranscription factor family in grape., 2013, 25(9): 1-6. (in Chinese)
[9] 邢光伟, 王梦醒, 马小飞, 赵贤, 张婷, 聂小军, 宋卫宁. 小麦LBD基因家族的全基因组鉴定、表达特性及调控网络分析.麦类作物学报, 2017, 37(7): 855-863.
XING G W, WANG M X, MA X F, ZHAO X, ZHANG T, NIE X J, SONG W N. Genome analysis, expression characteristics and regulation network ofgene family in Bread wheat (L)., 2017, 37(7): 855-863. (in Chinese)
[10] SHUAI B, REYNAGA-PENA C G, SPRINGER P S. Thegene defines a novel, plant-specific gene family., 2002, 129(2): 747-761.
[11] LIN W C, SHUAI B, SPRINGER P S. The-domain genefunctions in the repression ofgene expression and in adaxial-abaxial patterning., 2003, 15(10): 2241-2252.
[12] GOMBOS M, ZOMBORI Z, SZÉCSÉNYI M, SÁNDOR G, KOVÁCS H, GYÖRGYEY J. Characterization of the LBD gene family in: a phylogenetic and transcriptional study., 2016, 36(1): 1-19.
[13] YANG Y, YU X B, WU P. Comparison and evolution analysis of two rice subspeciesdomain gene family and their evolutionary characterization from., 2006, 39(1): 248-262.
[14] BORGHI L, BUREAU M, SIMON R.is expressed in boundaries and coordariesandactivity., 2007, 19(6): 1795-1808.
[15] THATCHER L F, POWELL J J, AITKEN E A, KAZAN K, MANNERS J M. The lateral organ boundaries domain transcription factor LBD20 functions in Fusarium wilt susceptibility and jasmonate signaling in., 2012, 160(1): 407-418.
[16] 王小非, 刘鑫, 苏玲, 孙永江, 张世忠, 郝玉金, 由春香. 番茄LBD基因家族的全基因组序列鉴定及其进化和表达分析. 中国农业科学, 2013, 46(12): 2501-2513.
WANG X F, LIU X, SU L, SUN Y J, ZHANG S Z, HE Y J, YOU C X. Identification, evolution and expression analysis of the LBD gene family in tomato.,2013, 46(12): 2501-2513. (in Chinese)
[17] 郑忠凡, 张亚利, 胡灿, 戴雄泽, 刘峰, 袁祖华. 辣椒全基因组中LBD转录因子的鉴定与表达分析. 园艺学报, 2016, 43(4): 683-694.
ZHENG Z F, ZHANG Y L, HU C, DAI X Z, LIU F, YUAN Z H. Genome-wide identification and expressing analysis of LBD transcription factors in pepper., 2016, 43(4): 683-694. (in Chinese)
[18] Majer C, Hochholdinger F. Defining the boundaries: structure and function of LOB domain proteins., 2011, 16(1): 47-52.
[19] Shuai B, Reynaga-Pena C G, Springer P S. The lateral organ boundaries gene defines a novel, plant-specific gene family., 2002, 129(2): 747-761.
[20] ZHANG Y M, ZHANG S Z. ZHENG C C. Genomewide analysis of LATERAL ORGAN BOUNDARIES domain gene family in, 2014, 93(1): 79-91.
[21] 芦强. 巨桉、毛果杨、雷蒙德氏棉基因家族的研究[D]. 北京: 中国林业科学院, 2017.
LU Q. Studies on the lateral organ boundaries domain() gene family in,and[D]. Beijing: China academy of forestry sciences, 2017. (in Chinese)
[22] GUO B J, WANG J, LIN S, TIAN Z, ZHOU K, LUAN H y, LYU C, ZHANG X Z, XU R G. A genome-wide analysis of thegene family in barleyL., 2016, 17(10): 763.
[23] 贾喜涛, 刘文献, 谢文刚, 刘志鹏, 刘志敏, 王彦荣. 蒺藜苜蓿转录因子基因家族全基因组分析. 西北植物学报, 2014, 34(10): 2176-2187.
JIA X T, LIU W X, XIE W G, LIU Z P, LIU Z M, WANG Y R. Genome-wide analysis of thetranscription factor gene family in., 2014, 34(10): 2176-2187. (in Chinese)
[24] MA Y, WANG F, GUO J, ZHANG X. Ricegene, a member of LOB domain family, functions in the regulation of shoot differentiation and leaf development., 2009, 52(5): 374-381.
[25] OKUSHIMA Y, FUKAKI H, ONODA M, THEOLOGIS A, TASAKA M. ARF7 and ARF19 regulate lateral root formation via direct activation ofgenes in., 2007, 19(1): 118-130.
[26] LEE H W, KIM M J, KIM N Y, LEE S H, KIM J. LBD18 acts as a transcriptional activator that directly binds to thepromoter in promoting lateral root emergence of., 2013, 73(2): 212-224.
[27] OKUSHIMA Y, OVERVOORDE P J, ARIMA K, ALONSO J M, CHAN A, CHANG C, ECKER J R, HUGHES B, LUI A, NGUYEN D, ONODERA C, QUACH H, SMITH A, YU X, THEOLOGIS A. Functional genomic analysis of thegene family members in: unique and overlapping functions ofand., 2005, 17(2): 444-463.
[28] FENG Z H, ZHU J, DU X L, CUI X H. Effects of three auxin- inducible LBD members on lateral root formation in., 2012, 236(4): 1227-1237.
[29] GOH T, JOI S, MIMURA T, FUKAKI H. The establishment of asymmetry inlateral root founder cells is regulated by LBD16/ASL18 and related LBD/ASL proteins., 2012, 139(5): 883-893.
[30] NAITO T, YAMASHINO T, KIBA T, KOIZUMI N, KOJIMA M, SAKAKIBARA H, MIZUNO T. A link between cytokinin and ASL9 (ASYMMETRIC LEAVES 2 LIKE 9) that belongs to the AS2/LOB (LATERAL ORGAN BOUNDARIES) family genes in.,,, 2007, 71(5): 1269-1278.
[31] RUBIN G, TOHGE T, MATSUDA F, SAITO K, SCHEIBLE W R. Members of thefamily of transcription factors repress anthocyanin synthesis and affect additional nitrogen responses in., 2009, 21(11): 3567-3584.
[32] XU C Z. LUO F. HOCHHOLDINGER F. LOB domain proteins: beyond lateral organ boundaries., 2016, 21(2): 159-167.
[33] HU Y. ZHANG J L. JIA H G. SOSSO D. LI T. FROMMER W B. YANG B. WHITE F F. WANG N. JONES J B.is a disease susceptibility gene for citrus bacterial canker disease., 2014, 111(4): 521-529.
[34] LI Z, ZOU L, YE G, XIONG L, JI Z, ZAKRIA M, HONG N, WANG G, CHEN G. A potential disease susceptibility geneof citrus is targeted by a major virulence effector PthA ofsubsp. citri., 2014, 7(5): 912-915.
[35] HUANG X, BAO Y N, WANG B, LIU L J, CHEN J, DAI L J, PENG D X. Identification and expression of Aux/IAA, ARF, and LBD family transcription factors in., 2016, 60(2): 244-250.
[36] Yang H, Shi G X, Du H Y, Wang H, Zhang Z Z, Hu D Z, Wang J, Huang F, Yu D Y. Genome-wide analysis of soybean-containing genes: A functional investigation of., 2017, 10(1): 1-19.
[37] CAO H, LIU C Y, LIU C X, ZHAO Y L, Xu R R. Genomewide analysis of the lateral organ boundaries domain gene family in, 2016, 95(3): 515-526.
[38] GRIMPLET J, PIMENTEL D, AGUDELO-ROMERO P, MARTINEZ- ZAPATER J M, FORTES M. Thegene family in grapevine: genome-wide characterization and expression analyses during developmental processes and stress responses., 2017, 7(1): 15968.
[39] ZHANG Z B, ZHANG J W, CHEN Y J, LI R F, WANG H Z, WEI J H. Genome-wide analysis and identification of HAK potassium transporter gene family in maize (L.)., 2012, 39(8): 8465-8473.
[40] 许明, 伊恒杰, 赵帅, 张玉文, 杨志坚, 郑金贵. 显齿蛇葡萄实时荧光定量PCR内参基因的筛选与验证. 中草药, 2017, 48(6): 1192–1198.
XU M, YI H J, ZHAO S, ZHANG Y W, YANG Z J, ZHENG J G. Screening and validation of reference genes for quantitative RT-PCR analysis in, 2017, 48(6): 1192 –1198. (in Chinese)
[41] 孙亭亭, 龚达平, 张磊, 陈雅琼, 赵维, 向小华, 孙玉合. 普通烟草LBD基因家族的全基因组序列鉴定与表达分析. 植物遗传资源学报, 2016, 17(2): 316-325.
SUN T T, GONG D P, ZHANG L, CHEN Y Q, ZHAO W, XIANG X H, SUN Y H. Genome-wide sequence identification and expression analysis of the LBD gene family in., 2016, 17(2): 316-325. (in Chinese)
[41] LEE H W, KIM N Y, LEE D J, KIM J.regulates lateral root formation in combination withdownstream ofand., 2009, 151(3): 1377-1389.
[42] SEMIARTI E,UENO Y, TSUKAYA H, IWAKAWA H, MACHIDA C, MACHIDA Y. Thegene ofregulates formation of a symmetric lamina, establishment of venation and repression of meristem-related homeobox genes in leaves., 2001, 128(10): 1771-1783.
[43] ZHU Q H, GUO A Y, GAO G, ZHONG Y F, XU M, HUANG M, LUO J. DPTF: a database of poplar transcription factors., 2007, 23(10): 1307-1308.
[44] FAN M Z, XU C Y, XU K, HU Y X. LATERAL ORGAN BOUNDARIES DOMAIN transcription factors direct callus formation inregeneration., 2012, 22(7): 1169-1180.
[45] FENG Z H, ZHU J, DU X L, CUI X H. Effects of three auxin- inducible LBD members on lateral root formation in., 2012, 236(4): 1227-1237.
Identification and Expression Analysis of LBD Gene Family in Grape
HE HongHong, MA ZongHuan, ZHANG YuanXia, ZHANG Juan, LU ShiXiong, ZHANG ZhiQiang, ZHAO Xin, WU YuXia, MAO Juan
(College of horticulture, Gansu Agricultural University, Lanzhou, 730070)
【Objective】The objectives of this research are to identify the Lateral Organ Boundaries Domain(LBD) family genes from grape() genome, to know the profile of LBD family such as gene number, gene structure and abiotic stress expression characteristics in grape, and to provide theoretical basis for exploring what roles the LBD transcription factors play in abiotic stress of grape.【Method】The LBDgenes in grape genome-wide were identified by BLAST software in the grape genome database based ongenes have been reported from.DNAMAN5.0, Clustalx, MapInspect, MEME, GSDS2.0, ExPASy and MEGA5.0 software were used for carry out various bioinformatics analysis of LBD. The expression profile chip was draw by the data comes from Affymetrix Gene Chip 16K in PLEXdb.The qRT-PCR was used to detect the expression of grape LBD gene family in abiotic stress.【Result】Total of 30 LBD genes were identified from grape genome, which can be divided into ClassⅠand ClassⅡ. The classⅠcan be divided into 5 subtribe which are namedⅠa,Ⅰb,Ⅰc,Ⅰd andⅠe. ClassⅡ can be divided into Ⅱa and Ⅱb. The number of amino acids is between 127 and 386, and the theoretical equivalence point is between 4.77 and 9.28 in the VvLBD gene family by physicochemical analysis. The analysis of the gene's location on the chromosome revealed that the 30 genes in this family were distributed on 11 of the 19 chromosomes of the grape, and the chromosome 13 contains 7 genes. Multiple sequence alignments and Motif analysis showed that the VvLBD gene family has three conserved domains, namely the sinusoidal structure, the leucine zipper structure, and the Glycine-alanine-serine (GAS) structure. The VvLBD gene family is mainly expressed in chloroplast, mitochondria and nucleus through the sub-cellular location analyzing. The alpha-helix and irregular curl are the main structure of the secondary structure in thegene family. The expression of the most gene was increased under the salt and PEG stress, and the expression characteristic was changed by the stress time change in the chip expression profile. The qRT-PCR results showed the expression of,,,,,were raised to the 3, 1, 8, 4, 5, and 13 times compared the control under the 400 mmol.L-1NaCl treatment. The expression ofandwas raised to the 4 and 26 times compared the controlunder 10% PEG treatment.【Conclusion】30 LBD gene family members were identified from the grape genome. These members distributed on 11 of the 19 chromosomes of the grape and the evolution of VvLBDis highly conservative. The LBD gene family is related to the abiotic stress, but the different expression were existed between the different members when the encountered the adversity environments.
; LBD gene family; evolutionary analysis; expression profile; qRT-PCR
10.3864/j.issn.0578-1752.2018.21.009
2018-04-28;
2018-06-25
甘肃农业大学大学生科研训练项目、国家自然科学基金(31460500)
何红红,E-mail:1152420683@qq.com。通信作者毛娟,E-mail:maojuan@gsau.edu.cn
(责任编辑 李莉)

