吡唑醚菌酯及三唑类杀菌剂对番茄颈腐根腐病的防治效果
曹海潮,李秀环,王晓坤,白海秀,慕卫,刘峰
吡唑醚菌酯及三唑类杀菌剂对番茄颈腐根腐病的防治效果
曹海潮1,李秀环1,王晓坤1,白海秀2,慕卫1,刘峰1
(1山东农业大学植物保护学院/山东省蔬菜病虫生物学重点实验室/山东省高校农药毒理与应用技术重点实验室,山东泰安 271018;2山东医药技师学院,山东泰安 271016)
【目的】评价吡唑醚菌酯与戊唑醇、丙环唑、氟硅唑等防治番茄颈腐根腐病的应用潜力。【方法】采用菌丝生长速率法和孢子萌发法分别测定吡唑醚菌酯、戊唑醇、丙环唑、氟硅唑4种杀菌剂抑制番茄颈腐根腐病菌(f. sp.)菌丝生长、分生孢子萌发及芽管伸长的毒力。通过温室盆栽试验,采用灌根处理法,于施药后7、15 d测定番茄幼苗株高和茎粗的增加量,评价杀菌剂对番茄植株生长的安全性;在室内,利用盆栽番茄,采用先接菌后施药的方法,测定施药后7、15和30 d药剂对番茄颈腐根腐病的防治效果;在田间,同样采用灌根处理,分别于施药后60、90和150 d调查番茄颈腐根腐病发病情况及最终番茄产量,评价不同杀菌剂对番茄颈腐根腐病的防治效果以及对番茄产量的影响。【结果】吡唑醚菌酯对番茄颈腐根腐病菌菌丝生长、孢子萌发及芽管伸长均表现出较高的毒力,EC50分别为0.055、0.012、0.010 μg·mL-1,其次为丙环唑,EC50分别为0.058、0.060、0.011 μg·mL-1。戊唑醇抑制菌丝生长的作用强,对孢子萌发及芽管伸长的毒力较低,EC50分别为0.075、0.255、0.455 μg·mL-1;氟硅唑抑制分生孢子芽管伸长的毒力高,而抑制菌丝生长与孢子萌发毒力相对较低,EC50分别为0.013、0.078、0.457 μg·mL-1。戊唑醇25、50 mg a.i./株、丙环唑5、10 mg a.i./株、氟硅唑5、10 mg a.i./株均显著抑制番茄幼苗株高,增加茎粗,吡唑醚菌酯30、60 mg a.i./株处理则均无影响。温室盆栽接种试验中,药后30 d,吡唑醚菌酯60 mg a.i./株防治效果最高,为87.12%,丙环唑10 mg a.i./株次之,防治效果为82.17%,戊唑醇50 mg a.i./株与氟硅唑10 mg a.i./株的防治效果分别为79.40%与71.67%。田间施药后90 d,吡唑醚菌酯60 mg a.i./株防治效果最高,为90.36%,戊唑醇50 mg a.i./株与丙环唑10 mg a.i./株次之,分别为84.20%与82.55%,氟硅唑5 mg a.i./株防治效果最低,为65.06%。而至施药后150 d,各处理防治效果均显著降低,戊唑醇50 mg a.i./株最高,为40.40%。最终产量统计,吡唑醚菌酯60 mg a.i./株处理增产率最高,为50.63%,丙环唑5 mg a.i./株最低,为-2.61%。【结论】吡唑醚菌酯、戊唑醇、丙环唑、氟硅唑4种杀菌剂抑制番茄颈腐根腐病菌菌丝生长的毒力相近,吡唑醚菌酯对孢子萌发及芽管伸长的毒力高于3种三唑类药剂。吡唑醚菌酯、丙环唑及戊唑醇均可用于设施内番茄颈腐根腐病的防治,吡唑醚菌酯60 mg a.i./株的防治效果最高,对植株安全且增产显著,而丙环唑与戊唑醇应注意控制使用剂量。
番茄颈腐根腐病;吡唑醚菌酯;三唑类杀菌剂;毒力;防治效果
0 引言
【研究意义】番茄颈腐根腐病是由尖镰孢番茄颈腐根腐病专化型(f. sp.-)侵染引起且危害日益严重的土传病害,发病严重时死亡率高达100%,降低番茄产量及品质[1]。该病在32个国家均有报道[2]。随着保护地番茄面积扩大及种植年限的增加,颈腐根腐病已成为影响番茄种植的重要病害之一[3]。目前对于该病害化学防治的研究报道较少,也未见防治药剂登记[4],所以明确化学防治手段的有效性及寻找高效杀菌剂对于该病害的防治具有重要意义。【前人研究进展】番茄颈腐根腐病菌致病力强,寄主范围广[5-6],通常与番茄枯萎病(致病菌f. sp.)混合发生,设施环境容易满足该病害需要的适宜温湿度条件,在一个生长季节可形成单周期、多周期循环侵染,导致苗期和成株番茄发病死亡[7]。甲氧基丙烯酸酯类(strobilurins)的吡唑醚菌酯(pyraclostrobin)为线粒体呼吸抑制剂[8],具有保护、治疗、铲除、渗透、强内吸活性[9],可防治小麦赤霉病[10]、花生根腐病[11]、草莓枯萎病[12]等多种由镰孢菌引起的病害,尤其对尖镰孢有较高的毒力[13-14]。戊唑醇(tebuconazole)、氟硅唑(flusilazole)、丙环唑(propiconazole)等三唑类杀菌剂为细胞膜麦角甾醇生物合成抑制剂(EBIs),内吸性强,具有保护、治疗和铲除作用,在镰孢菌病害防治中也有应用[15],如戊唑醇能防治小麦赤霉病、大豆枯萎病、小麦茎基腐病[16-18]等,丙环唑、氟硅唑虽鲜见田间防治镰孢菌病害的报道,但对尖镰孢有较高的毒力[13,19]。【本研究切入点】上述杀菌剂在防治番茄颈腐根腐病上均未见登记[4]。笔者实验室初步研究发现戊唑醇、氟硅唑对控制番茄颈腐根腐病的发生有效[20],但在药剂作用特性、施药技术和对番茄安全性等方面未进行深入探讨。【拟解决的关键问题】明确吡唑醚菌酯、戊唑醇等杀菌剂对番茄颈腐根腐病菌菌丝生长、孢子萌发及芽管伸长3个重要阶段的毒力差异,明确各药剂在试验剂量下对番茄植株的影响,为设施栽培条件下番茄颈腐根腐病的防治提供技术支持。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株及番茄 菌株分离及鉴定方法参考BENAOUALI等[1,7]并加以改进。于山东省泰安市岱岳区采集病株,使用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基进行分离培养,进行单孢分离纯化,观察菌落、菌丝及小型分生孢子形态;在VBC培养基[21]上培养,观察大型分生孢子及厚垣孢子形态。依照柯赫氏法则进行回接,分别比较病菌分离物在18℃与27℃对番茄幼苗的致病力,该分离物在18℃下的致病力明显大于27℃下的致病力,从发病植株上再次分离和纯化病原菌,获得番茄颈腐根腐病病原菌,将其保存在PDA斜面上,置于4℃备用。番茄品种为金鹏11-8抗病毒品种,购于山东省泰安市房村镇红星种苗繁育基地。
1.1.2 供试杀菌剂 95%戊唑醇原药,江苏七洲绿色化工股份有限公司;430 g·L-1戊唑醇悬浮剂,拜耳作物科学中国有限公司;95%氟硅唑原药,山东潍坊润丰化工股份有限公司;8%氟硅唑水乳剂,中国农业科学院植物保护研究所廊坊农药中试厂;91.2%丙环唑原药、50%丙环唑水乳剂,陕西汤普森生物科技有限公司。98.47%吡唑醚菌酯原药,25%吡唑醚菌酯乳油,山东康乔生物科技有限公司。各原药使用丙酮溶解,分别配制成5%的溶液,然后用0.1%吐温-80水溶液配制成质量浓度为1×103μg·mL-1的母液,现配现用。
1.1.3 培养基 PDA培养基:马铃薯200 g、葡萄糖20 g、水琼脂20 g,加水1 L,用于菌株的分离、纯化、培养、保存以及菌丝生长速率的测定;水琼脂(water agar,WA)培养基:葡萄糖20 g、琼脂20 g,加水1 L,用于孢子萌发及芽管伸长的测定;VBC培养基[21]。
1.1.4 仪器 BX43型光学显微镜,日本Olympus公司;RXZ智能型人工气候箱,宁波江南仪器厂。
1.2 试验方法
1.2.1 杀菌剂对病菌菌丝生长的影响 采用菌丝生长速率法测定[22]。在预试验的基础上,将4种供试杀菌剂母液稀释成系列浓度,与加热后冷却至50℃左右的PDA培养基混合,制成含系列浓度药剂的PDA平板。其中,戊唑醇、氟硅唑浓度为0.01875、0.0375、0.075、0.3、0.6、1 μg·mL-1,丙环唑、吡唑醚菌酯浓度为0.01、0.05、0.1、0.5、1 μg·mL-1,并以含丙酮最高浓度的吐温-80稀释液PDA平板为空白对照。将分离纯化所得颈腐根腐病菌在PDA平板上25℃培养7 d后,用打孔器在菌落边缘打取直径为8 mm的菌饼,接种在对照及含药PDA平板上,每处理重复4次。25℃下培养,待空白对照培养皿中菌丝生长至2/3时调查病原菌菌丝生长情况。使用十字交叉法测量菌落直径,计算各药剂处理对菌丝生长的抑制率,并以毒力最低的药剂为基准药剂计算其他药剂的相对毒力比值。
菌落增长直径(mm)=菌落直径-菌饼直径
菌丝生长抑制率(%)=100×(对照菌落增长直径-处理菌落增长直径)/对照菌落增长直径
毒力比值=测试药剂EC50(或EC90)/基准药剂EC50(或EC90)
1.2.2 杀菌剂对分生孢子萌发的影响 采用孢子萌发法测定[22]。将番茄颈腐根腐病菌在PDA平板上25℃的条件下培养14 d,用灭菌去离子水10 mL洗下分生孢子,经灭菌纱布过滤到孢子悬浮液,用血球计数板将孢子悬浮液浓度调制为1×106个/mL。在预试验的基础上,将4种供试杀菌剂母液稀释成系列浓度,与加热后冷却至50℃左右的WA培养基混合,制成含系列浓度药剂的WA平板。其中,吡唑醚菌酯的浓度梯度为0.00032、0.0016、0.008、0.04、0.2、1μg·mL-1,丙环唑的浓度梯度为0.0032、0.016、0.08、0.4、2、10 μg·mL-1,氟硅唑、戊唑醇的浓度梯度为0.016、0.08、0.4、2、10、50 μg·mL-1,并以含相应溶剂最高浓度的吐温-80稀释液PDA平板为空白对照,每处理重复2次。利用移液器吸取100 μL的孢子悬浮液滴到WA平板中,使用涂布器将孢子悬浮液涂布均匀。25℃黑暗培养,当对照平板内孢子萌发率达80%以上时进行镜检,芽管长度超过孢子长度的一半时视为萌发,每重复随机调查3个视野,共调查孢子总数不少于200个,最后计算孢子萌发的相对抑制率。
孢子萌发率(%)=100×孢子萌发数/孢子总数
处理组校正孢子萌发率(%)=100×处理组孢子萌发率/对照孢子萌发率
孢子萌发相对抑制率(%)=100×(对照孢子萌发率-处理组校正孢子萌发率)/对照孢子萌发率
1.2.3 杀菌剂对分生孢子芽管伸长的影响 试验方法同1.2.2,其中,氟硅唑的浓度梯度为0.0016、0.008、0.04、0.2、1、5 μg·mL-1,其他3种杀菌剂带药平板的浓度梯度不变,每处理重复2次。将分生孢子悬浮液涂布均匀后,25℃黑暗培养16 h后进行镜检,每重复随机调查20个分生孢子,记录分生孢子的芽管长度并计算芽管伸长的抑制率。
芽管伸长抑制率(%)=(对照芽管长度-处理芽管长度)/对照芽管长度
1.2.4 杀菌剂对番茄植株的安全性测定 盆栽用土均取自发病严重的温室大棚,后进行130℃灭菌72 h。使用430 g·L-1戊唑醇悬浮剂、8%氟硅唑水乳剂、50%丙环唑水乳剂和25%吡唑醚菌酯乳油4种杀菌剂进行安全性测定。按照每盆用土2 kg将灭菌土装填于花盆中。当金鹏11-8番茄幼苗长至3—5叶期时,选择长势一致的植株移栽到花盆中继续培养。待其生长稳定后,测定植株的株高及茎粗,将定量杀菌剂溶于500 ml水中并进行灌根处理,设计清水对照处理,每处理设计3组重复,每组10株幼苗。4种杀菌剂的安全性及田间试验剂量均参考范怀峰田间施用剂量并在田间预试验下进行改进[20]。其中,戊唑醇剂量设为25、50 mg a.i./株,氟硅唑和丙环唑剂量设为5、10 mg a.i./株,吡唑醚菌酯剂量设为30、60 mg a.i./株,定植后施药一次。施药后7 d及15 d分别测量植株的株高及茎粗,同时观察药剂对叶色、植株形态的影响。计算株高及茎粗的增加量。
1.2.5 杀菌剂对番茄颈腐根腐病的温室盆栽防治效果 接种方法参考BENAOUALI等[1]。选取长势一致的3—5叶期番茄,在幼苗的茎基部切一个7 mm伤口,将伤口及植株根系在分生孢子悬浮液(分生孢子悬浮液的准备方法同1.2.2)中浸泡15 min,以无菌水接种为空白对照,将处理番茄盆栽置于18℃,相对湿度60%的RXZ智能型人工气候箱培养3 d,之后将番茄幼苗取出,移栽至花盆后进行灌根施药,施药剂量及方法按照1.2.4设计进行。处理完毕后,置于25℃日光温室进行培养观察。接菌7、15、30 d后调查发病植株数,统计病株率并计算防治效果。
病株率(%)=100×发病株数/调查总株数
防治效果(%)=100×(空白对照组病株率-药剂处理组病株率)/空白对照组病株率
1.2.6 杀菌剂对番茄颈腐根腐病的田间防治效果 田间药效试验在泰安市岱岳区大汶口镇番茄颈腐根腐病发病严重的日光温室进行,依据GB/T 17980.113—2004准则。试验于2015年8月16日开始,4种杀菌剂的安全性及田间试验剂量均参考范怀峰田间施用剂量并在温室盆栽安全性试验及田间预试验基础上进行[20]。番茄幼苗选用6—8叶期幼苗。于番茄定植后,将430 g·L-1戊唑醇悬浮剂稀释至16.7、33.3 mg·L-1,8%氟硅唑水乳剂与50%丙环唑水乳剂均稀释至3.3、6.7 mg·L-1,25%吡唑醚菌酯乳油稀释至20、40 mg·L-1,保证杀菌剂有效成分用量不变,单株用水量由500 mL增至1.5 L,分3次进行浇灌,每次500 mL,以增加药剂扩散范围。设置清水对照。每处理4次重复,每重复50株,完全随机区组设计,设保护行。分别于施药后60、90、150 d进行全区调查,记录各处理的发病情况,计算病株率及防治效果。在番茄生长过程中记录单果重、单株结果数及产量,计算增产率。
病株率(%)=100×发病株数/调查总株数
防治效果(%)=100×(空白对照区病株率-药剂处理区病株率)/空白对照区病株率
1.3 数据分析
试验相关数据使用Excel 2003进行处理,采用DPSV6.55软件进行分析。各杀菌剂对番茄颈腐根腐病菌不同生长阶段的室内毒力数据,通过分别计算杀菌剂质量浓度对数值与菌丝生长、孢子萌发及芽管伸长抑制率机率值之间的线性回归关系,求出毒力回归方程、相关系数、有效中浓度(EC50)、90%最大有效浓度(EC90)及95%置信限。温室盆栽试验及田间药效试验所测数据进行单因素方差分析,用平均值±标准误表示测定结果,并应用Duncan氏新复极差法对处理间的差异显著性进行检验,<0.05表示差异显著。
2 结果
2.1 4种杀菌剂对不同发育阶段番茄颈腐根腐病菌的毒力
2.1.1 对菌丝生长的抑制作用 4种杀菌剂抑制番茄颈腐根腐病菌菌丝生长的毒力相近,EC50(95%置信区间)的分布范围为0.055—0.078 μg·mL-1,其中,吡唑醚菌酯与丙环唑的毒力较高,EC50分别为0.055和0.058 μg·mL-1,戊唑醇与氟硅唑次之,EC50分别为0.075与0.078 μg·mL-1;综合各药剂的EC50、EC90,吡唑醚菌酯、戊唑醇对菌丝生长的抑制作用强,EC90分别为4.421与5.057 μg·mL-1,毒力比值分别为2.72与2.38(表1)。
2.1.2 对分生孢子萌发的抑制作用 4种杀菌剂对番茄颈腐根腐病菌分生孢子萌发的毒力差异较大,吡唑醚菌酯毒力最高,EC50为0.012 μg·mL-1,EC90为0.284 μg·mL-1,毒力比值分别为38.10、113.52;其次为丙环唑,EC50为0.060 μg·mL-1,EC90为10.603 μg·mL-1,毒力比值分别为7.62、3.21;而戊唑醇与氟硅唑的抑制作用相对低,EC50、EC90分别为0.255、32.239 μg·mL-1与0.457、13.885 μg·mL-1(表2)。
2.1.3 对分生孢子芽管伸长的抑制作用 吡唑醚菌酯、丙环唑、氟硅唑对分生孢子芽管伸长的抑制作用均高于戊唑醇,EC50分别为0.010、0.011、0.013 μg·mL-1,毒力比值分别为45.50、41.36、35.00,EC90分别为0.513、3.091、1.503 μg·mL-1,毒力比值分别为22.57、3.75、7.70;戊唑醇EC50为0.455 μg·mL-1,EC90为11.577 μg·mL-1,毒力较低(表3)。
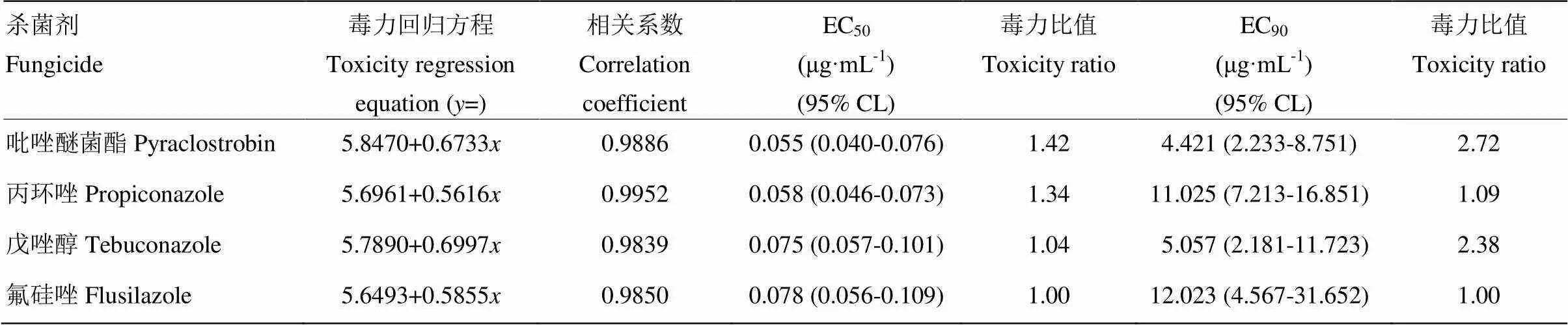
表1 4种杀菌剂对番茄颈腐根腐病菌菌丝生长的毒力
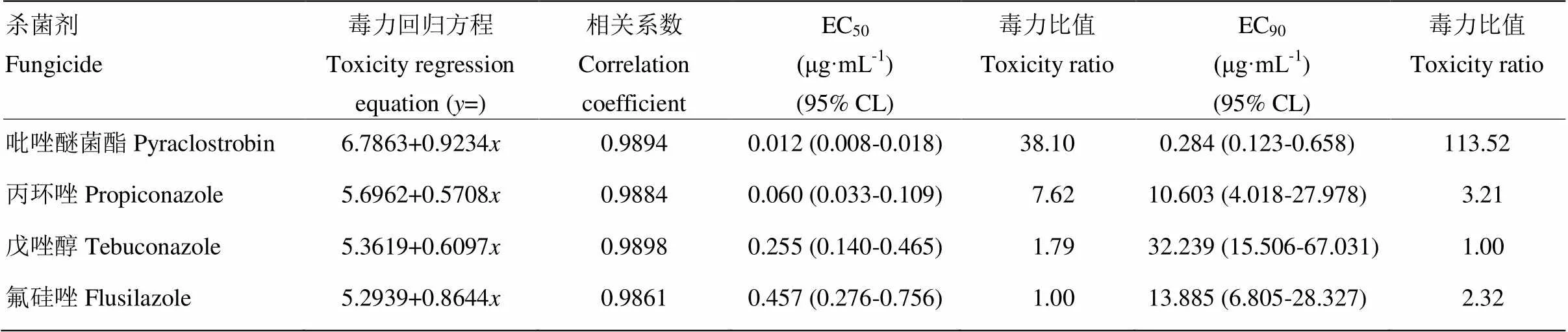
表2 4种杀菌剂对番茄颈腐根腐病原菌分生孢子萌发的毒力
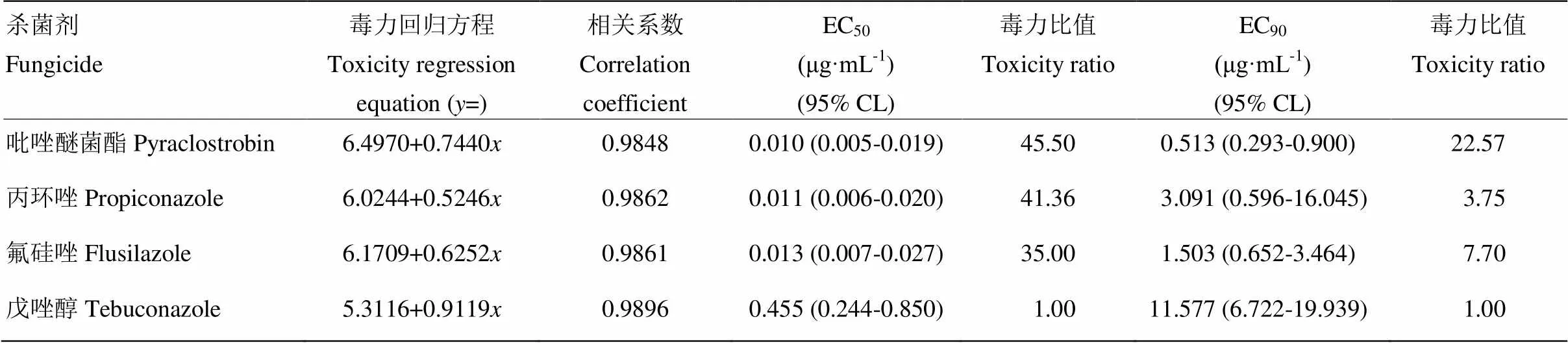
表3 4种杀菌剂对番茄颈腐根腐病原菌芽管伸长的毒力
2.2 4种杀菌剂对番茄植株的安全性评价
番茄幼苗使用戊唑醇、丙环唑、氟硅唑灌根处理后7 d的株高与对照处理差异显著;15 d后,50 mg a.i./株戊唑醇与10 mg a.i./株丙环唑的抑制作用最显著,株高增加量分别为4.51、3.98 cm,显著低于清水对照8.81 cm的株高增加量,只有吡唑醚菌酯处理无显著抑制效果。在药剂处理7 d时,戊唑醇、丙环唑、氟硅唑各处理对番茄植株的茎粗增加有显著促进作用。15 d时,仅戊唑醇25、50 mg a.i./株、丙环唑10 mg a.i./株与氟硅唑10 mg a.i./株处理对茎粗还存在显著的促进作用,茎粗的增加量分别为0.1567、0.2015、0.1713、0.1798 cm。所有药剂对株高抑制作用与对茎粗促进作用均表现为高剂量处理>低剂量处理(图1)。
2.3 4种杀菌剂对番茄颈腐根腐病的温室盆栽防治效果
各药剂施用后7 d的防治效果均在79%以上,其中吡唑醚菌酯60 mg a.i. /株与戊唑醇50 mg a.i. /株的防治效果分别达到97.62%与97.22%;施药后15 d,戊唑醇、吡唑醚菌酯60 mg a.i./株与丙环唑10 mg a.i./株表现出较高的防治效果,其中吡唑醚菌酯60 mg a.i./株的防治效果最高,为94.87%,显著高于其30 mg a.i./株、丙环唑5 mg a.i./株与氟硅唑5、10 mg a.i./株处理的防治效果;施药后30 d,吡唑醚菌酯、戊唑醇50 mg a.i./株与丙环唑10 mg a.i./株的防治效果较高,其中吡唑醚菌酯60 mg a.i./株的防治效果最高,为87.12%,丙环唑10 mg a.i./株、戊唑醇50 mg a.i./株的防治效果分别为82.17%、79.40%。氟硅唑5 mg a.i./株的防治效果最低,仅为58.82%,10 mg a.i. /株的防治效果为71.67%;吡唑醚菌酯60 mg a.i./株、戊唑醇50 mg a.i./株、丙环唑10 mg a.i./株均表现出较高和较稳定的防治效果,而氟硅唑相对较低(表4)。
2.4 4种杀菌剂对番茄颈腐根腐病的田间防治效果
各药剂施用后60 d,吡唑醚菌酯60 mg a.i./株与戊唑醇50 mg a.i./株的防治效果较高,分别为94.10%与89.14%;施药后90 d,吡唑醚菌酯60 mg a.i. /株的防治效果最高,达90.36%,其次是戊唑醇50 mg a.i./株处理和丙环唑10 mg a.i./株处理,分别为84.20%、82.55%。氟硅唑的防治效果最低,5、10 mg a.i./株的防治效果分别为65.06%与72.69%,显著低于吡唑醚菌酯60 mg a.i./株、戊唑醇50 mg a.i./株、丙环唑10 mg a.i./株的防治效果。施药150 d后,各处理组防治效果均显著降低,除戊唑醇50 mg a.i./株防治效果为40.40%外,其他3种杀菌剂防治效果均低于30%(表5)。从清水对照处理的累积发病率来看(图2),番茄颈腐根腐病在番茄的整个生长期内均可发病,总体呈现出番茄生长发育中期(61—90 d)的发病速度要快于前期(1—60 d)与后期(91—150 d)发病速度的现象。施药后60 d内所有药剂处理发病较轻,61—90 d各药剂处理表现出高剂量处理发病率要低于低剂量处理发病率的规律,表明各药剂高剂量处理对番茄颈腐根腐病的防治效果较稳定。91—150 d各药剂处理发病率普遍上升,其中,吡唑醚菌酯与氟硅唑处理高剂量的发病率要低于低剂量。根据图3,吡唑醚菌酯60 mg a.i./株的番茄产量最高,增产率高达50.63%,丙环唑5 mg a.i./株处理的产量最低,增产率为-2.61%,除戊唑醇处理外,其余各药剂处理均表现为高剂量处理产量要高于低剂量处理产量。各三唑类杀菌剂处理的成熟番茄单果重无显著差异,吡唑醚菌酯60 mg a.i./株处理的结果数最多,平均单株结果数达16.33个,显著高于戊唑醇50 mg a.i./株,丙环唑5、10 mg a.i./株以及氟硅唑5 mg a.i./株处理。

相同颜色深度的不同字母表示经Duncan氏新复极差法检验在P<0.05水平差异显著。图3同
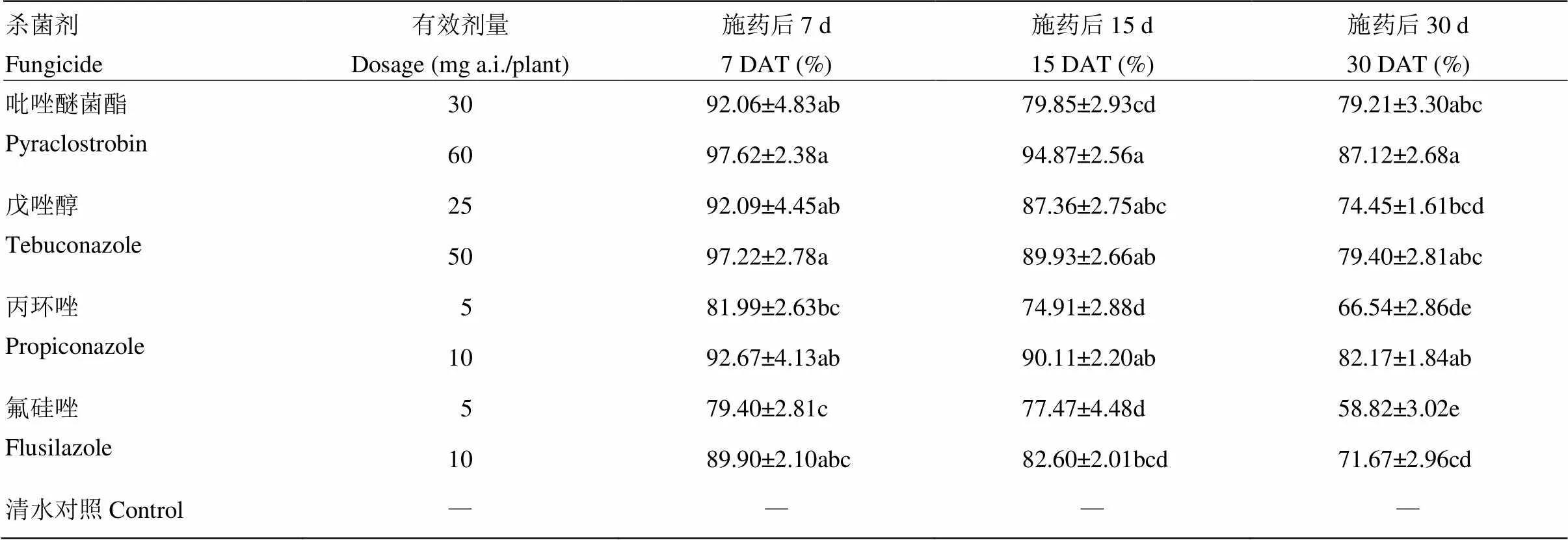
表4 4种杀菌剂对番茄颈腐根腐病的温室盆栽防治效果
表中数据均为平均数±标准误。同列不同字母表示经Duncan氏新复极差法检验在<0.05水平差异显著。表5同Date are mean±SE. Different letters in the same column indicate significant differences at<0.05 level by Duncan’s new multiple range test. The same as table 5
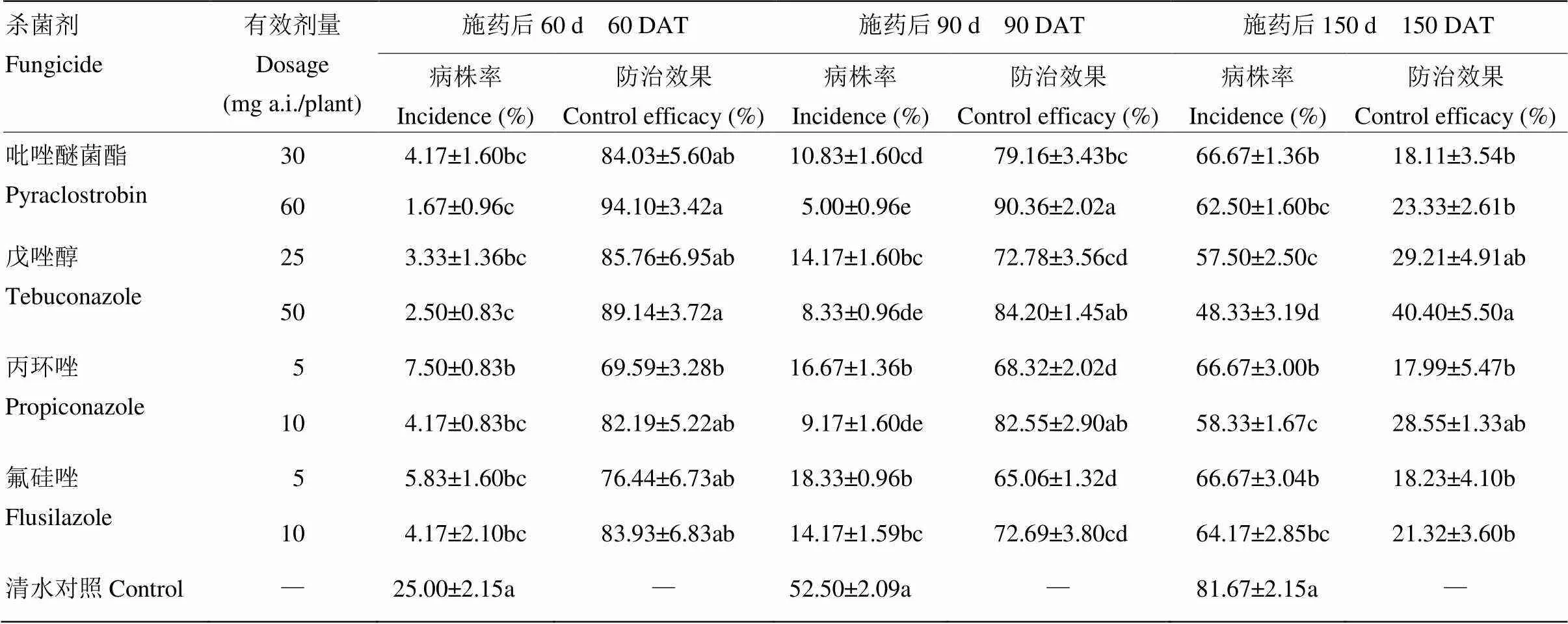
表5 4种杀菌剂对番茄颈腐根腐病的田间防治效果
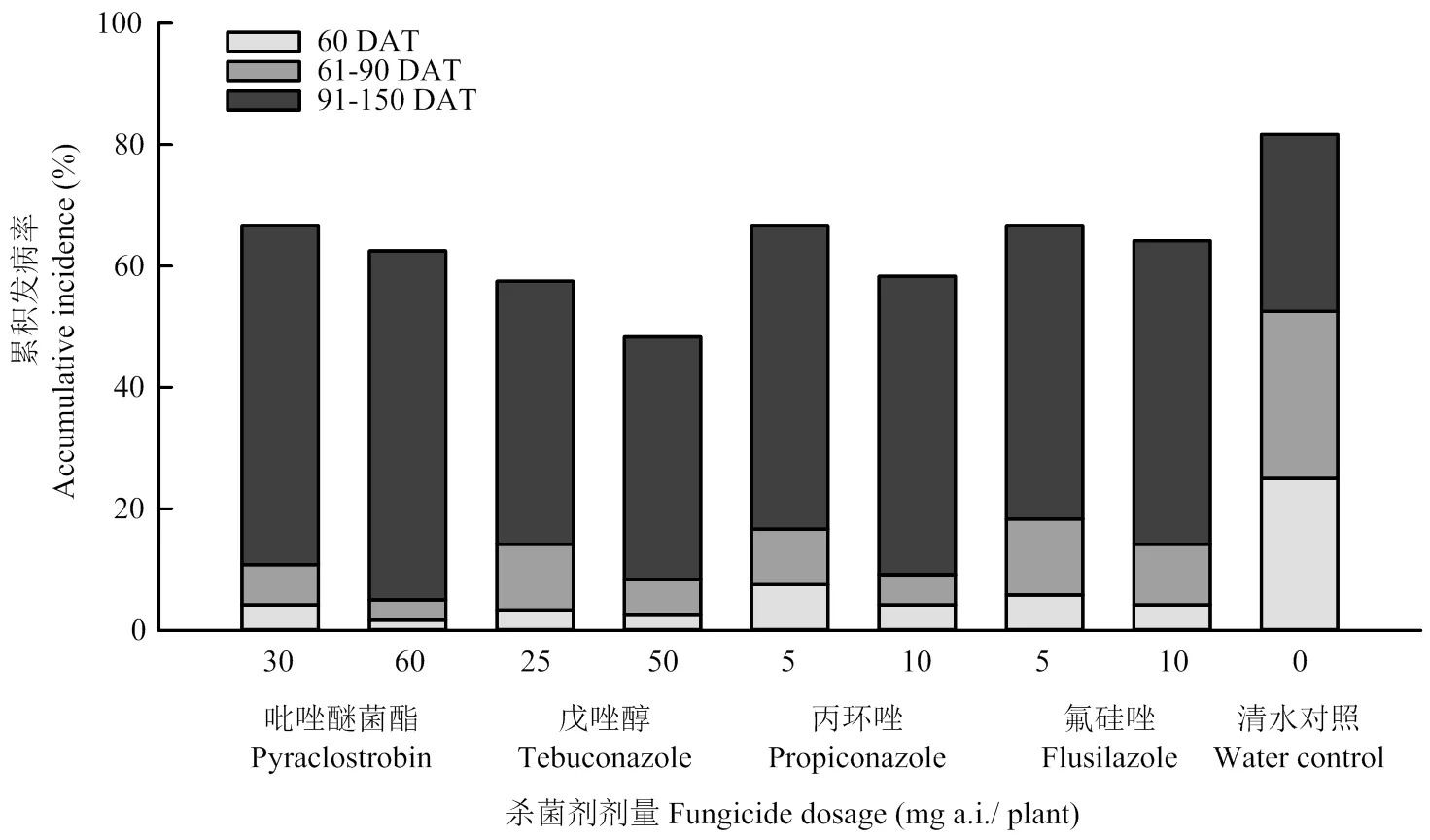
图2 4种杀菌剂处理后田间番茄颈腐根腐病的累积发病率
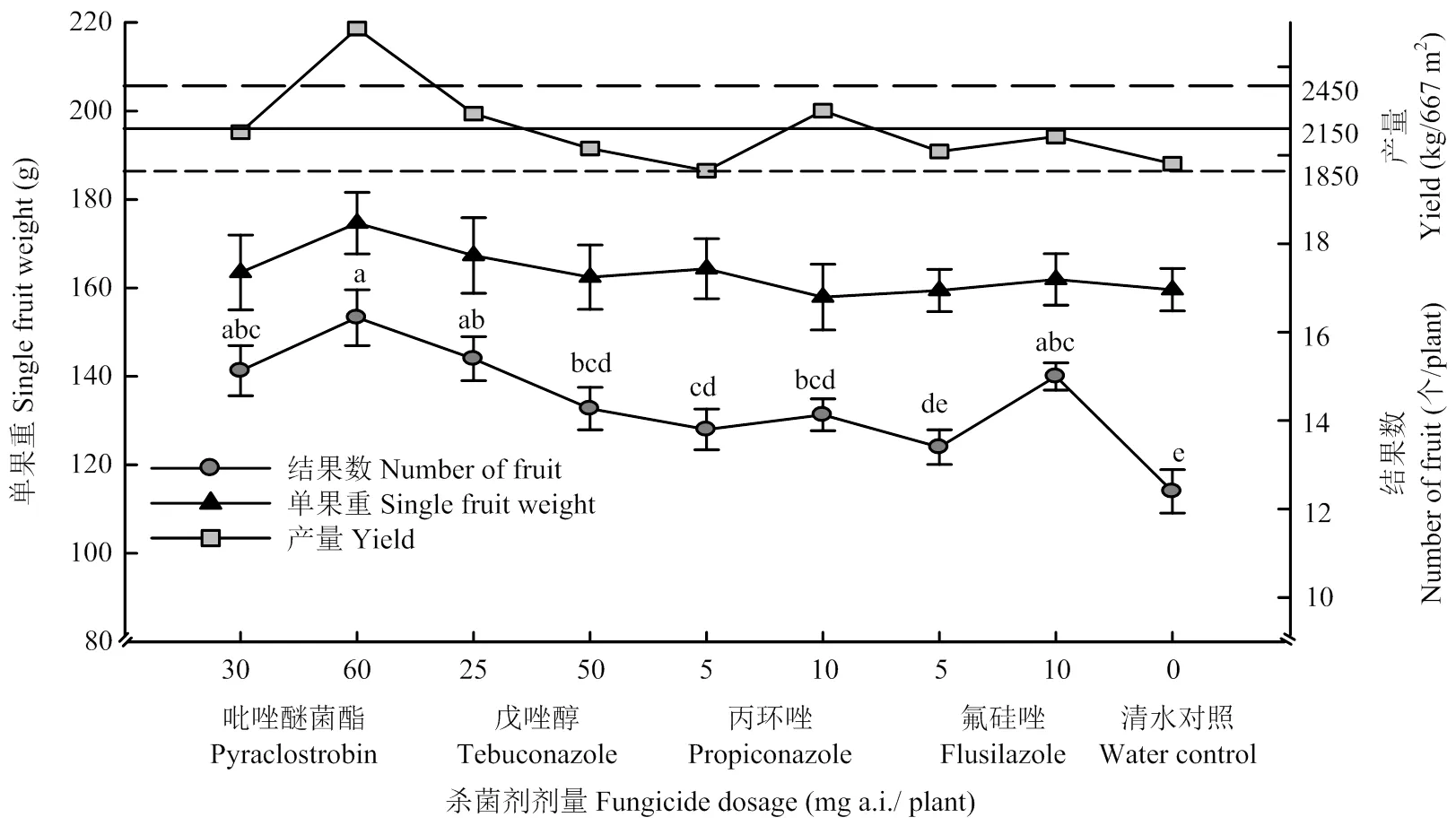
图3 4种杀菌剂处理对番茄产量的影响
3 讨论
吡唑醚菌酯通过抑制线粒体能量的合成对病原真菌产生抑制作用,丙环唑、戊唑醇、氟硅唑通过干扰细胞膜重要成分麦角甾醇的合成抑制病原菌生长[9,15]。病原菌的孢子萌发是一个涉及到信号传导、水分吸收、大量物质代谢的复杂过程[23],孢子萌发过程中对能量的需求量很大,阻断其病原菌的能量合成是药剂产生抑制作用的关键,因此吡唑醚菌酯对孢子萌发的抑制毒力要显著高于3种三唑类药剂。芽管伸长与菌丝生长均属于细胞增长的过程,虽二者都涉及到能量的合成与细胞膜的形成,但芽管伸长试验调查时间较短,仅在涂布后16 h,可以忽略孢子对药剂的代谢,而菌丝生长试验周期较长,存在病菌对药剂的代谢,并且菌丝体与分生孢子对不同药剂的敏感程度存在差异[24],因此造成了各药剂对病原菌的3个生长阶段毒力不一致的现象,另外,3种三唑类杀菌剂虽然作用机理相同,但由于自身结构差异,造成病菌对药剂吸收能力、代谢能力等性质的差异,同样会造成毒力不一致的现象。
吡唑醚菌酯抑菌谱广,对包括镰孢菌在内的多种病原菌均有较强的抑制作用。李梦娇等[13]研究表明,吡唑醚菌酯对芝麻尖镰孢菌丝生长的抑制作用较强,EC50为0.759 μg·mL-1;吴祥等[12]研究表明,吡唑醚菌酯EC在250 μg·mL-1剂量下对草莓枯萎病菌()的防治效果最高。在本研究中,吡唑醚菌酯对番茄颈腐根腐病菌的菌丝生长与孢子萌发均存在显著抑制作用;盆栽试验和田间试验中,以60 mg a.i./株的试验剂量对番茄进行定点灌根处理,吡唑醚菌酯均表现出较高的防治效果,对番茄植株安全且增产作用明显。据报道,吡唑醚菌酯增产的原因是提高硝酸盐还原酶的活性,增加作物对氮的吸收;降低乙烯合成,减缓植物衰老等[9]。陈雨等[25]报道了吡唑醚菌酯防治大豆炭疽病的同时对大豆也有显著增产作用,这与本研究吡唑醚菌酯对番茄颈腐根腐病防治效果高且增产结果是一致的。
三唑类的戊唑醇、丙环唑、氟硅唑等近年来也开始用于防治包括镰孢菌等病原菌引起的多种作物土传病害,氟硅唑与丙环唑对辣椒根腐病的防治效果优良[26],戊唑醇种衣剂对小麦纹枯病、全蚀病和根腐病有较高的防治效果[27]。在本研究中,戊唑醇、丙环唑对番茄颈腐根腐病的防治效果较高,且戊唑醇50 mg a.i./株的持效期长于吡唑醚菌酯60 mg a.i./株,展现出一定的应用潜力。不过三唑类杀菌剂能够抑制植物赤霉素和生长素的合成,引起矮化,根冠比增加[15],因此其对作物生长的抑制作用不可忽视。在盆栽试验中,戊唑醇、丙环唑、氟硅唑处理番茄幼苗对株高的抑制作用高于田间试验,其原因一方面是盆栽的苗龄(3—5叶期)低于田间(6—8叶期),另一方面是在不改变单株施药量的前提下,田间试验用水量高,降低了土壤中药剂的相对浓度,不过这样也有利于扩大药剂在土壤中的分布范围。所以在保证防治效果的前提下,各处理单果重与清水对照相比无显著差异,而单株结果数显著提高,除丙环唑5 mg a.i./株处理外,均表现出一定的增产作用。因此,未来研究应侧重于药剂浓度的控制,如开发微囊缓释剂型并对用水量、施药部位等施药技术细节进行优化。
药剂在土壤中的稳定性影响其持效期。有报道吡唑醚菌酯在土壤中的消解半衰期为13.1—16.5 d[28],丙环唑为22.4 d[29],氟硅唑为5.59—7.13 d[30],戊唑醇为15.6 d[31],这也解释了氟硅唑与丙环唑对番茄颈腐根腐病菌的毒力相当,而盆栽及田间试验中对番茄颈腐根腐病的防治效果低于后者,并在番茄花果盛期无法有效控制病情的原因。由此可见,施药后随着时间的推移,防治效果逐步下降是由各药剂在土壤中的降解造成的,所以在实际生产中,为减轻番茄颈腐根腐病对生长中后期番茄的危害,还应在定植期施药后 50 d及100 d左右分别再次施药。根据本研究结果,初步形成的用药策略是在番茄颈腐根腐病发生严重的地块,幼苗定植期施用吡唑醚菌酯,在番茄盛花期后施用戊唑醇或丙环唑,以兼顾施药防治效果和对番茄植株的安全性。
吡唑醚菌酯作用位点单一,被杀菌剂抗性委员会(Fungicide Resistance Action Committee,FRAC)认定为“高抗性风险杀菌剂”,而戊唑醇、丙环唑抗性风险相对较低,为“中抗性风险杀菌剂”[32]。目前,尚无有关吡唑醚菌酯与三唑类杀菌剂存在交互抗性的报道。因此,可通过吡唑醚菌酯与三唑类药剂混用以延缓病原菌抗药性的产生。有报道吡唑醚菌酯与苯醚甲环唑混合使用对引起马铃薯早疫病的茄丝核菌()有较高的联合毒力[33],对花生褐斑病也有较好的防治效果[34]。Spolti等[35]报道了吡唑醚菌酯与叶菌唑混用可提高对小麦赤霉病的防治效果。因此,吡唑醚菌酯与丙环唑、戊唑醇等三唑类杀菌剂混用防治番茄颈腐根腐病的可行性值得进一步探究。
由于连作等原因,番茄颈腐根腐病目前在山东潍坊、泰安等地蔬菜产区普遍发生,且呈逐年加重之势。而该病在国内尚未引起足够重视,生产上亟需高效、安全的防治技术。本研究表明,吡唑醚菌酯、丙环唑、戊唑醇灌根处理对防治番茄颈腐根腐病具有较大的应用潜力。从施药手段上分析,目前大水漫灌施药与单株定点灌根施药是防治设施蔬菜土传病害的常用手段。不过大水漫灌费水、费药,环境风险高,而单株定点灌根处理相对省水、省药,但费时、费力,人工成本高。因此,如果能够通过滴灌设施进行施药,实现水药一体化可以兼顾两者的优点,但在滴灌条件下药剂对番茄颈腐根腐病的防治效果仍需进一步评价。
4 结论
吡唑醚菌酯、戊唑醇、丙环唑、氟硅唑4种杀菌剂抑制尖镰孢番茄颈腐根腐病专化型菌丝生长的毒力相近,吡唑醚菌酯对孢子萌发及芽管伸长的毒力高于其他3种三唑类药剂。吡唑醚菌酯、丙环唑及戊唑醇均可用于设施内番茄颈腐根腐病的防治,其中,吡唑醚菌酯60 mg a.i./株对该病害的防治效果相对较高,可以维持番茄的产量并对植株安全,而丙环唑与戊唑醇使用时应注意控制剂量。
[1] BENAOUALI H, HAMINI-KADAR N, BOURAS A, BENICHOU S L, KIHAL M, HENNI E. Isolation, pathogenicity test and physicochemical studies off. sp.., 2014, 8(810): 36-49.
[2] JONES J B, JONES J P, STALL R E, ZITTER T A. Compendium of tomato disease., 1992, 84(1): 133.
[3] SZCZECHURA W, STANIASZEK M, HABDAS H.f. sp.–the cause of Fusarium crown and root rot in tomato cultivation., 2013, 53(2): 172-176.
[4] 中国农药信息网. www.chinapesticide.gov.cn.
China Pesticide Information Network. www.chinapesticide.gov.cn. (in Chinese)
[5] ROWE R C. Comparative pathogenicity and host ranges ofisolates causing crown and root rot of greenhouse and field-grown tomatoes in North America and Japan., 1980, 70(12): 1143-1148.
[6] MENZIES J G, KOCH C, SEYWERD F. Additions to the host range off. sp.., 1990, 74(8): 569-572.
[7] 耿丽华, 李常保, 迟胜起, 王丽君, 柴敏. 番茄颈腐根腐病病原鉴定及不同条件对其生长的影响. 植物病理学报, 2012, 42(5): 449-455.
GENG L H, Li C B, CHI S Q, WANG L J, CHAI M. Identification of the pathogen causing Fusarium crown and root rot of tomato and its growth affecting factors., 2012, 42(5): 449-455. (in Chinese)
[8] 左文静, 主艳飞, 庄占兴, 崔蕊蕊, 郭雯婷, 刘钰, 范金勇. 吡唑醚菌酯研究开发现状与展望. 世界农药, 2017, 39(1): 22-25.
ZUO W J, ZHU Y F, ZHUANG Z X, CUI R R, GUO W T, LIU Y, FAN J Y. Research status and prospects of pyraclostrobin., 2017, 39(1): 22-25. (in Chinese)
[9] 杨丽娟, 柏亚罗. 甲氧基丙烯酸酯类杀菌剂——吡唑醚菌酯. 现代农药, 2012, 11(4): 46-50.
YANG L J, BAI Y L. Strobilurin fungicide——pyraclostrobin., 2012, 11(4): 46-50. (in Chinese)
[10] CHEN Y, ZHANG A F, GAO T C, ZHANG Y, WANG W X, DING K J, CHEN L, SUN Z, FANG X Z, ZHOU M G. Integrated use of pyraclostrobin and epoxiconazole for the control of Fusarium head blight of wheat in Anhui Province of China., 2012, 96(10): 1495-1500.
[11] 管磊. 防治花生土传真菌病害种子处理药剂的筛选[D]. 泰安: 山东农业大学, 2015.
GUAN L. Screening for controlling peanut soilbrone fungal diseases on peanut by seed-coating[D]. Taian: Shandong Agriculture University, 2015. (in Chinese)
[12] 吴祥, 姚克兵, 吉沐祥, 陈宏州, 杨敬辉, 李金凤, 王莉莉. 句容地区草莓枯萎病病原菌的分离鉴定及田间防治.江苏农业学报, 2015, 31(4): 764-770.
WU X, YAO K B, JI M X, CHEN H Z, YANG J H, LI J F, WANG L L. Isolation and identification and field control of strawberry fusarium wilt in Jurong, Jiangsu province., 2015, 31(4): 764-770. (in Chinese)
[13] 李梦姣, 王振军, 刘红彦. 8种杀菌剂对芝麻尖孢镰刀菌的室内毒力测定. 安徽农业科学, 2014, 42(16): 5010-5011.
LI M J, WANG Z J, LIU H Y. Toxicity test of eight fungicides toin laboratory.,2014, 42(16): 5010-5011. (in Chinese)
[14] JL M X, YAO K B, LI G P, WU X, CHEN H Z, ZHUANG Y Q. Control effects ofDJ-6 and pyraclostrobin alone and in combination against.2014, 15(11): 2020-2025.
[15] 周子燕, 李昌春, 高同春, 檀根甲. 三唑类杀菌剂的研究进展. 安徽农业科学, 2008, 36(27): 11842-11844.
ZHOU Z Y, LI C C, GAO T C, TAN G J. Research progress of triazole fungicides., 2008, 36(27): 11842-11844. (in Chinese)
[16] SUN H Y, ZHU Y F, LIU Y Y, DENG Y Y, LI W, ZHANG A X, CHEN H G. Evaluation of tebuconazole for the management of Fusarium head blight in China., 2014, 43(6): 631-638.
[17] 陈志谊, 任海英, 刘永锋, 许志刚. 戊唑醇和枯草芽孢杆菌协同作用防治蚕豆枯萎病及增效机理初探. 农药学学报, 2002, 4(4): 40-44.
Chen Z Y, Ren H Y, Liu Y F, XU Z G. Synergism between tebuconazole andagainst faba bean Fusarium wilt and mechanism of increasing effect., 2002, 4(4): 40-44. (in Chinese)
[18] Balmas V, Delogu G, Sposito S, Rau D, Migheli Q. Use of a complexation of tebuconazole with beta-cyclodextrin for controlling foot and crown rot of durum wheat incited by., 2006, 54(2): 480-484.
[19] 王翠霞, 纪莉景, 栗秋生, 李聪聪, 孔令晓. 西瓜枯萎病药剂筛选及其防效研究. 北方园艺, 2013(13): 154-157.
WANG C X, JI L J, LI Q S, LI C C, KONG L X. Study on screening of fungicide and control effect of Fusarium wilt in watermelon., 2013(13): 154-157. (in Chinese)
[20] 范怀峰. 山东番茄土传病害调查与化学防治技术研究[D]. 泰安: 山东农业大学, 2014.
FAN H F. Investigation and chemical control on tomato soil-borne diseases techniques in Shandong province[D]. Taian: Shandong Agriculture University, 2014. (in Chinese)
[21] 王拱辰, 刘文军, 陈辉珍. 镰孢属李瑟组研究——促进李瑟组产孢的VBC培养基. 浙江农业大学学报, 1995, 21(4): 353-356.
WANG G C, LIU W J, CHEN H Z. Studies on the section Liseola of Fusarium-The VBC medium for promoting sporulation of section Liseola., 1995, 21(4): 353-356. (in Chinese)
[22] 孙广宇, 宗兆锋. 植物病理学实验技术. 北京: 中国农业出版社, 2002: 139-146.
SUN G Y, ZONG Z F.. Beijing: China Agriculture Press, 2002: 139-146. (in Chinese)
[23] D’Enfert C. Fungal spore germination: Insights from the molecular genetics ofand., 1997, 21(2): 163-172.
[24] Yanagita T, Yamagishi S. Comparative and quantitative studies of fungitoxicity against fungal spores and mycelia., 1958, 6(6): 375-381.
[25] 陈雨, 张爱芳, 夏本勇, 王文相. 吡唑醚菌酯对大豆炭疽病防效及保健增产作用. 农药, 2011, 50(9): 697-699.
CHEN Y, ZHANG A F, XIA B Y, WANG W X. Efficacy of pyraclostrobin in controlling soybean anthracnose and their effects on the health protection and yield increase., 2011, 50(9): 697-699. (in Chinese)
[26] 陈彦, 刘长远, 王晓红, 孙柏欣. 纪明山, 赵奎华, 苗则彦, 梁春浩. 辣椒根腐病化学防治田间试验. 植物保护, 2008, 34(6): 150-152.
CHEN Y, LIU C Y, WANG X H, SUN B X, JI M S, ZHAO K H, MIAO Z Y, LIANG C H. field experiment on chemical control of pepper root rot., 2008, 34(6): 150-152. (in Chinese)
[27] 毕秋艳, 马志强, 韩秀英, 张小风, 王文桥, 赵建江. 5种种衣剂防治小麦主要土传病害研究. 植物保护, 2014, 40(4): 171-176.
BI Q Y, MA Z Q, HAN X Y, ZHANG X F, WANG W Q, ZHAO J J. control effect of five kinds of seed coating formulations on soil-borne diseases in wheat., 2014, 40(4): 171-176. (in Chinese)
[28] ZHANG F Z, WANG L, ZHOU L, WU D, PAN H J, PAN C P. Residue dynamics of pyraclostrobin in peanut and field soil by QuEChERS and LC-MS/MS., 2012, 78: 116-122.
[29] 崔滢, 王晓环, 姚加加, 黄安香. 丙环唑土壤降解影响因素研究. 广州化工, 2015, 43(9): 115-117, 138.
CUI Y, WANG X H, YAO J J, HUANG A X. Degradation of propiconazol in soil and its affecting factors., 2015, 43(9): 115-117, 138. (in Chinese)
[30] 王春伟, 王燕, 许允成, 崔丽丽, 高洁. SPE-HPLC-MS/MS法测定人参及土壤中氟硅唑的残留及风险评估. 华南农业大学学报, 2014, 35(6): 58-62.
WANG C W, WANG Y, XU Y C, CUI L L, GAO J. Residue determination by SPE-HPLC-MS/MS and risk assessment of flusilazole in the ginseng and soil., 2014, 35(6): 58-62. (in Chinese)
[31] 丁蕊艳. 戊唑醇在苹果、水稻及土壤上的残留动态研究[D]. 济南: 山东大学, 2012.
DING R Y. Study on dynamics of tebuconazole residues in apple, rice and soil[D]. Ji’nan: Shandong University, 2012. (in Chinese)
[32] Fungicide Resistance Action Committee. FRAC code list: Fungicides sorted by mode of action (including FRAC Code numbering). http://www.frac.info.
[33] 范子耀, 王文桥, 孟润杰, 韩秀英, 张小风, 马志强, 刘颖超. 吡唑醚菌酯与苯醚甲环唑混合物对茄链格孢的联合毒力及其对马铃薯产量的影响. 农药学学报, 2011, 13(6): 591-596.
FAN Z Y, WANG W Q, MENG R J, HAN X Y, ZHANG X F, MA Z Q, LIU Y C. Joint-toxicity of mixtures of pyraclostrobin with difenoconazole againstand effect of their synergistic mixture on potato yield., 2011, 13(6): 591-596. (in Chinese)
[34] 何献声. 吡唑醚菌酯与苯醚甲环唑混剂对花生褐斑病的防治. 农药, 2014, 53(9): 677-679.
HE X S. Mixture of pyraclostrobin and difenoconazole against peanut leaf spot disease., 2014, 53(9): 677-679. (in Chinese)
[35] Spolti P, Guerra D S, Badiale-Furlong E, Ponte E M D. Single and sequential applications of metconazole alone or in mixture with pyraclostrobin to improve Fusarium head blight control and wheat yield in Brazil., 2013, 38(2): 85-96.
Control Efficacy of Pyraclostrobin and Triazole Fungicides against Tomato Crown and Root Rot
Cao Haichao1, Li Xiuhuan1, Wang Xiaokun1, BAI Haixiu2, Mu Wei1,Liu Feng1
(1College of Plant Protection, Shandong Agricultural University/Shandong Provincial Key Laboratory for Biology of Vegetable Diseases and Insect Pests/Shandong Key Laboratory of Pesticide Toxicology & Application Technique, Taian 271018, Shandong;2Shandong Medical Technician College, Taian 271016, Shandong)
【Objective】The objective of this study is to evaluate the potential efficacy of pyraclostrobin as well as tebuconazole, propiconazole and flusilazole against tomato crown and root rot, which caused byf. sp.. 【Method】The laboratory toxicity of 4 fungicides to mycelial growth, conidial germination and germ tube elongation off. sp.were determined by mycelial growth rate and conidial germination methods. In greenhouse pot experiment, the root-irrigation method was used to treat tomato seedlings. At 7 d and 15 d after treatment, the increment of plant height and stem diameter was measured to evaluate the safety of fungicides on tomato seedlings. In the laboratory, the method of first inoculating and then applying fungicides was adopted. The control efficacy of fungicides on tomato crown and root rotat 7, 15 and 30 d after application was investigated, respectively. In field experiment, same root-irrigation method was used to investigate the incidence of tomato crown and root rot at 60, 90 and 150 d after treatment and the tomato yield statistic, and to evaluate the efficacy of fungicides against the disease in field and the effect on yield of tomato.【Result】Pyraclostrobin showed high toxicity to mycelial growth, conidial germination and germ tube elongation off. sp., with EC50of 0.055, 0.012 and 0.010 μg·mL-1, followed by propiconazole, EC50was 0.058, 0.060, 0.011 μg·mL-1, respectively. The inhibitory effect of tebuconazole on mycelial growth was strong, and the toxicity of tebuconazole to conidial germination and germ tube elongation was relatively low, with EC50of0.075, 0.255 and 0.455 μg·mL-1, respectively. The toxicity of flusilazole to conidial germ tube elongation was high, butthe toxicity of flusilazole to mycelial growth and conidial germination was low, with EC50of 0.013, 0.078 and 0.457 μg·mL-1, respectively. tebuconazole at 25, 50 mg a.i./plant, propiconazole at 5, 10 mg a.i./plant and flusilazole at 5, 10 mg a.i./plant significantly inhibited tomato seedling height and increased stem diameter, but pyraclostrobin at 30, 60 mg a.i./plant had no effect on tomato seedling. In greenhouse pot experiment, 30 days after treatment (DAT), pyraclostrobin had the highest control efficacy (87.12%) on this disease at 60 mg a.i./plant, followed by propiconazole 10 mg a.i./plant, the control efficacy was 82.17%, and the control efficacy of tebuconazole at 50 mg a.i./plant and flusilazole at 10 mg a.i./plant was 79.40% and 71.67%, respectively. At 90 DAT in field experiment, the best control efficacy on the disease was 90.36% by pyraclostrobin at 60 mg a.i./plant, followed by tebuconazole at 50 mg a.i./plant and propiconazole at 10 mg a.i./plant, which was 84.20% and 82.55%, respectively. The lowest one was flusilazole at 5 mg a.i./plant (65.06%). At 150 DAT, the control efficacy of each treatment on the disease significantly declined, just tebuconazole at 50 mg a.i./plant was 40.40%. According to field statistics, pyraclostrobin at 60 mg a.i./plant had the highest yield in field, the increased production rate was 50.63%, and propiconazole at 5 mg a.i./plant was the lowest, with the rate of -2.61%. 【Conclusion】pyraclostrobin, tebuconazole, propiconazole and flusilazole had similar toxicity onf. sp.mycelial growth, however, pyraclostrobin had higher toxicity on the conidial germination and germ tube elongation of the pathogen than the other three fungicides. Pyraclostrobin, propiconazole and tebuconazole could be used to control tomato crown and root rot in greenhouse.The control efficacy of pyraclostrobin at 60 mg a.i./plant was the highest, which was safe and increased production significantly.However, the dosages of propiconazole and tebuconazole should be concerned before application.
tomato crown and root rot; pyraclostrobin; triazole fungicide; toxicity; control efficacy
10.3864/j.issn.0578-1752.2018.21.006
2018-05-07;
2018-07-03
国家重点研发计划(2017YFD0200307)、山东省重大科技创新工程(2017CXGC0207)
曹海潮,E-mail:caohaichao666@outlook.com。通信作者刘峰,Tel/Fax:0538-8242611;E-mail:fliu@sdau.edu.cn
(责任编辑 岳梅)

