猪瘟病毒中等致病力毒株在体内的动态分布
孙骏翔,张乾义,徐和敏,王团结,徐璐,邹兴启,朱元源,李翠,夏应菊,徐嫄,陈锴,张玉杰,赵启祖,王琴
猪瘟病毒中等致病力毒株在体内的动态分布
孙骏翔1,张乾义1,徐和敏2,王团结1,徐璐1,邹兴启1,朱元源1,李翠1,夏应菊1,徐嫄1,陈锴1,张玉杰1,赵启祖1,王琴1
(1中国兽医药品监察所,国家/OIE猪瘟参考实验室,北京 100081;2中牧实业股份有限公司,北京 100070)
【目的】目前我国猪瘟的感染类型主要是亚急性感染及慢性感染,研究猪瘟亚急性感染后体内病毒RNA和蛋白的分布情况,有助于阐述亚急性病程猪瘟病毒的复制分布规律,为猪瘟的早期诊断和预防奠定重要基础。【方法】成功以中等致病力毒株(HeBHH1/95)构建了亚急性猪瘟感染动物模型,分别采集感染后第1、3、6、10、13、20、24、28 天感染猪的十二指肠、脾脏、肾脏、肺脏、胰、回盲瓣6种组织器官并进行连续切片。应用建立的猪瘟病毒可视化原位杂交技术(ViewRNA ISH )研究感染组织中病毒RNA动态分布,同时采用免疫组化(IHC)、H.E染色分别检测感染组织中蛋白的分布情况及其组织损伤位置,从而在病毒核酸和蛋白水平系统性的观察病毒的分布情况。【结果】采用Mittelholzer方法进行临床计分发现感染后6—10 d感染猪猪瘟临床症状记分迅速增加,11—26 d感染猪临床记分一直维持在15分左右,直到28 d临床记分达到最高值20分。感染后8—10 d感染猪体温呈上升趋势;13—24 d感染猪体温呈现稽留热,持续在40℃左右;此后体温开始回落,至濒死前体温回落至39.5℃左右。应用CSFV ViewRNA ISH感染后第1 天在十二指肠绒毛杯状细胞及胰腺的腺泡、回盲瓣的固有层、肾脏的肾小管等这些具有分泌功能的结构组织周围检测到病毒RNA阳性信号;感染后第3天在肺脏的细支气管和脾脏的椭圆体周围检测到病毒RNA阳性信号;第13天阳性信号富集显著,至第28天病毒RNA广泛分布在脾脏动脉周围淋巴鞘及胰腺腺泡和肾小管等组织周围。采用IHC和H.E染色法在连续切片的相似视野下验证ViewRNA ISH检测结果,发现感染后第1天十二指肠、胰腺、肾脏亦可检测到病毒蛋白阳性信号和相应组织的病理变化,但回盲瓣在第3天检测到病毒蛋白阳性信号和组织的病理变化,在之后的病程中各组织中病毒RNA、蛋白定位情况趋于一致,第28天病毒蛋白集中在脾脏动脉周围淋巴鞘及胰腺腺泡等周围。【结论】采用ViewRNA ISH方法在回盲瓣中可以早于IHC发现猪瘟病毒,各个组织中ViewRNA ISH检测到病毒部位与IHC检测到病毒部位及H.E检测到的组织损伤部位相似,表明ViewRNA ISH具有良好的灵敏性可以应用于检测感染早期病毒在组织中的分布。前期病毒RNA通常在胰腺腺泡、肾小管及脾脏的椭圆体周围复制,在感染中期病毒在各组织结构中大量增殖,感染后期病毒不仅在淋巴细胞周围富集,还易在具有分泌功能的部位复制增殖。
猪瘟病毒;中等致病力; RNA;可视化原位杂交;分布
0 引言
【研究意义】猪瘟(classical swine fever,CSF)是由猪瘟病毒(classical swine fever virus,CSFV)引起的猪的高度接触性、致死性传染病[1],对全球养猪业造成严重危害[2]。目前我国猪瘟的感染类型主要是亚急性感染及慢性感染,但因发病缓慢或不易察觉,给我国的养猪业带来极大损失[3],造成这种感染类型的主要病原是中等致病力猪瘟毒株[4]。研究亚急性猪瘟感染后病毒RNA在体内的动态分布有助于阐述亚急性病程中CSFV的复制分布规律,为当前CSF的早期诊断和预防提供技术保障。【前人研究进展】国内外研究多集中在动物体感染过程中病毒蛋白分布,且已经证实病毒蛋白载量与组织嗜性及病程密切相关[5]。猪瘟慢性感染病程中扁桃体、颌下淋巴结、肝脏、心肌等组织的病毒RNA动态载量研究已经证实了扁桃体等淋巴器官是CSFV侵入宿主的主要器官[6]。但是CSFV侵入宿主后对其他组织的嗜性及病毒核酸在组织中具体结构的定位依然不清楚,因此需要进行深入的研究。ViewRNA ISH是一种基于原位杂交发展起来的可以定位RNA的技术。目前,该技术已经在生物学方面有了广泛应用,在神经生物学方面,ViewRNA ISH与微流体芯片技术共同验证了Eef1a1、Ctnnb1、Nrxn3等转录本存在于轴索中[7],表明成熟的皮质轴突包含一些特殊的细胞骨架、蛋白运输及线粒体维护等转录本。在寻找肿瘤治疗靶点的研究中,应用此技术对外周血循环肿瘤细胞(circulatingtumor cells,CTCs)进行RNA的原位杂交,鉴定出Wnt 2在CTCs中高表达,可作为治疗靶点,抑制肿瘤的转移[8]。ZHANG等[9]应用ViewRNA ISH观察到CSFV感染PK15后,病毒RNA在体外吸附和进入靶细胞时间早于0.5 小时。这些研究说明了ViewRNA ISH对细胞中特定RNA进行定位和检测具有很好的可行性。【本研究切入点】但是,在猪瘟亚急性感染病程中,病毒RNA在感染猪组织器官中的分布研究还未见报道,本研究应用ViewRNA ISH在核酸水平观察CSFV在组织中的分布情况,同时应用IHC、H.E染色验证ISH的观测结果。【拟解决的关键问题】在构建病程持续28 d的亚急性猪瘟感染动物模型的基础上,采用ViewRNA ISH对中等致病力CSFV感染后免疫器官、消化系统、呼吸系统等各组织中病毒RNA的分布动态进行系统研究,对阐明中等致病力CSFV的致病机理具有重要的科学意义。
1 材料与方法
试验于2016年7月至2017年5月在中国兽医药品监察所,国家/OIE猪瘟参考实验室完成。
1.1 试验材料
试验用猪:购自河北保定某猪场,选取10 kg左右,30日龄,健康断奶大白仔猪。
抗体检测试剂盒:CSFV抗体检测试剂盒由中国兽医药品监察所国家/OIE猪瘟参考实验室提供;猪繁殖与呼吸综合征病毒(PRRSV)抗体检测试剂盒、猪伪狂犬病病毒(PRV)抗体检测试剂盒、牛病毒性腹泻病毒(BVDV)抗体检测试剂盒均购自IDEXX公司;猪细小病毒(PPV)抗体检测试剂盒购自PrioNics公司;猪圆环病毒(PCV)抗体检测试剂盒购自科前生物制品有限责任公司;口蹄疫病病毒(FMDV)抗体检测试剂盒深圳绿诗源生物技术有限公司。
病原检测试剂:CSFV、PRRSV、PRV、PPV、PCV(I型和II型)、BVDV、FMDV病原检测引物由Invitrogen公司合成;FQ-PCR主要试剂:SuperScriptTMIII 反转录酶购自Invitrogen公司;Taq HS DNA聚合酶,10×PCR Buffer等购自宝生物工程(大连)有限公司;核酸提取试剂盒购自宝生物工程(大连)有限公司。
CSFV ViewRNA ISH试剂:CSFV 特异性探针、ACTB探针的合成以及试剂盒的组装由美国Affymetrix公司完成。
IHC试剂:CSFV E2蛋白单克隆抗体WH303由英国APHA实验室赠送;羊抗鼠IgG购自康为世纪;显色液购自美国Vector Laboratories。
其他试剂:无水乙醇、二甲苯、甲醛、氨水、过氧化氢、柠檬酸钠等购自北京化学试剂有限公司。
Thermobrite ViewRNA ISH仪,美国雅培公司。
1.2 试验方法
1.2.1 探针的设计 根据GenBank公布的CSFV SM 株(AF333000)设计ISH探针序列,对猪看家基因β-actin(ACTB)(AK237086)的mRNA序列设计特异性探针作为内参。
CSFV探针序列:
P1:GGA CTA GCA AAC GGA GGG ACTA GCC GTA GTG GCG AGC TCC CTG GGT GGT CTA AGT CCT GAG TAC AGG ACA GTC GTC AAT AGT TCG ACG TGA GCA GGA GC;
P2:TAT GAT TTA TTG CAA GCC CAG AGGTAC GGT ATA G AA GAC GGG ATA AAT ATC ACC AAA TCC T;
P3:AGG TGG TCA GAC AAC ACT TCT AGT TAC ATG CCG GGG AGA AAT ACA ACC ACA ATCCTA GCT AAA ATG GCC ACA AGG TTA GAT TCC AGT GGT GAG AGG GGT ACC ATA GCA TAT GAG AAA GCA GTA GCA TTC AGC TTC CTG CTG ATG TAC T。
ACTB探针序列:
ACTB:TTC CTT CCT GGG TAT GGA ATC CTG TGG CAT CCA CGA AAC TAC CTT CAA CTC AAT CAT GAA。
1.2.2 试验用猪的筛选 试验前采集断奶仔猪的全血,对其进行CSFV、PRRSV、PRV、PPV、PCV(I型和II型)、BVDV、FMDV 8种重要猪病病原和抗体的筛查。选取病原、抗体全部阴性猪作为本次实验动物。
1.2.3 猪瘟亚急性感染模型的构建和样本采集 试验用猪共18头随机分成2组:试验组16头,每头猪颈部肌肉注射1.5×103.66TCID50的CSFV中等致病力毒株(HeBHH1/95);对照组2头,颈部肌肉注射等量无菌生理盐水,将两组实验动物隔离饲养。从感染前一天进行体温测定,参照文献[10]的方法进行临床打分。在感染后第1、3、6、10、13、20、24、28 天(day post infection, dpi)剖杀试验猪,采集十二指肠、胰腺、脾脏、回盲瓣、肾脏、肺脏等6种组织器官保存于多聚甲醛中,制成石蜡切片,备用。
1.2.4 感染组织中 CSFV ViewRNA ISH方法优化 切片经过脱蜡水化、1%蛋白酶K处理组织、预杂交液处理组织、探针杂交、细胞核蓝染后使用光学显微镜观察。根据Affymetrix ViewRNA ISH说明书提供的蛋白酶孵育时间范围(5—20 min)及组织预处理液煮沸时间范围(5—20 min),采用正交试验对1.2.3制备的切片优化反应条件、时间。采用优化后的条件对切片进行ViewRNA ISH方法检测。
1.2.5 猪瘟亚急性感染组织间接IHC检测法 参考朱长康[11]CSFV间接IHC检测法对1.2.3制备的切片进行病毒定位检测,采用Vector显色液显色观察。
1.2.6 猪瘟亚急性感染组织H.E染色 参考文献[12]的H.E染色法对1.2.3制备的切片进行H.E染色。
2 结果
2.1 猪瘟亚急性感染模型的构建
根据文献[10]的方法(0—30分),对CSFV中等致病力毒株(HeBHH1/95)感染猪体后进行临床记分:1—5 dpi感染猪临床症状得分较低,少于5分;6—10 dpi感染猪临床症状记分迅速增加;11—26 dpi感染猪临床得分一直维持在15分左右,直到28 dpi临床记分达到最高值20分,结果见图1。感染后每天两次对猪进行体温测定,取其算术平均值:潜伏期内感染猪体温正常;8—10 dpi感染猪体温呈上升趋势;13—24 dpi患畜体温总体呈现热稽留,持续在40℃左右;此后体温开始回落,至濒死前体温回落至39.5℃左右,对照组体温一直维持在(39±0.5)℃,结果见图2。根据感染猪临床记分、体温测定指标及病程,成功构建了CSFV亚急性感染动物模型。

图1 CSFV中等致病力毒株(HeBHH1/95)感染猪体临床打分图
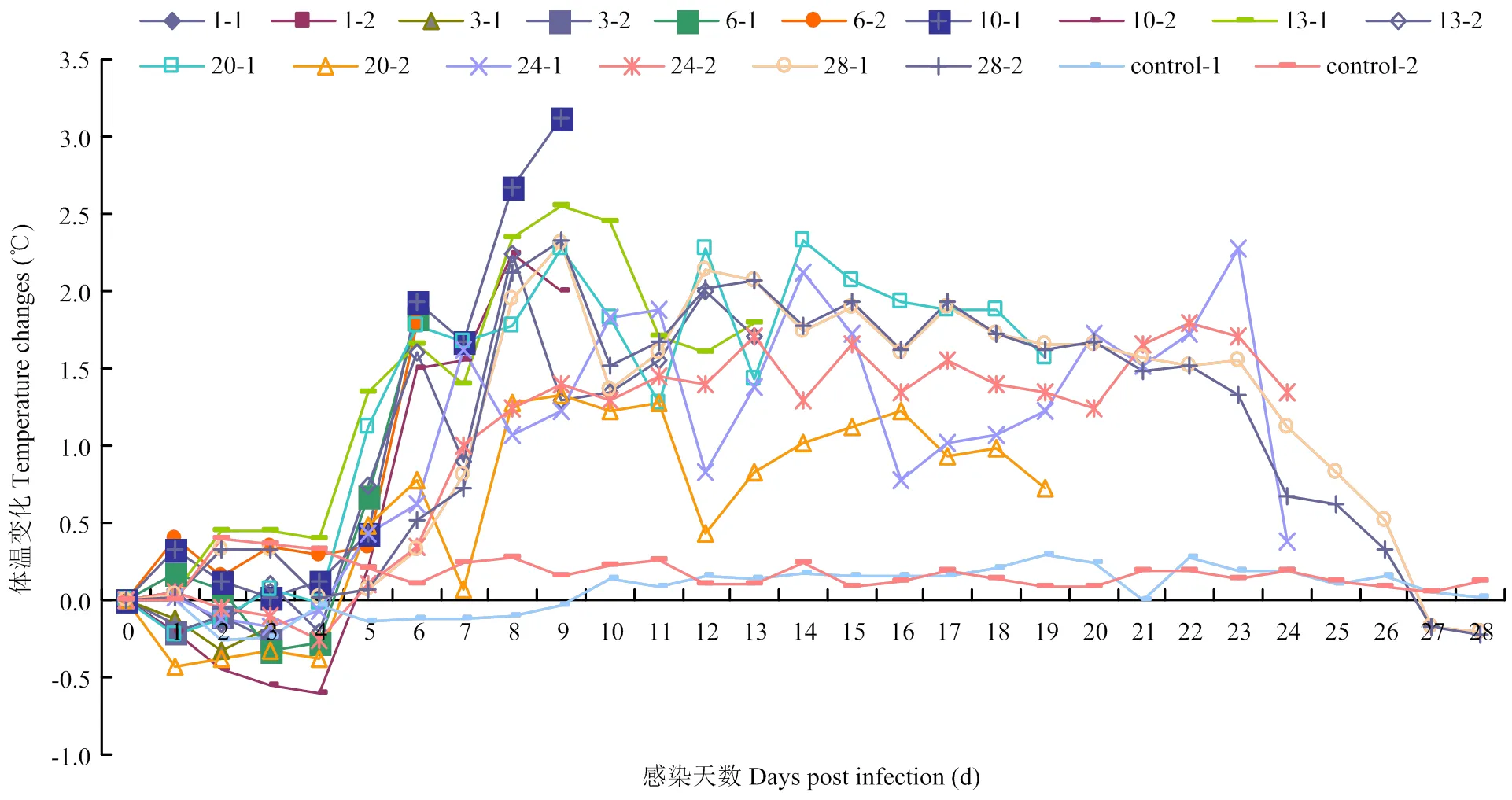
图2 CSFV中等致病力毒株(HeBHH1/95)感染猪体温变化情况
2.2 CSFV ViewRNA ISH方法优化
参考组织形态及CSFV RNA信号强度,各组织器官的预处理液的煮沸时间及蛋白酶的消化时间优化结果如表1
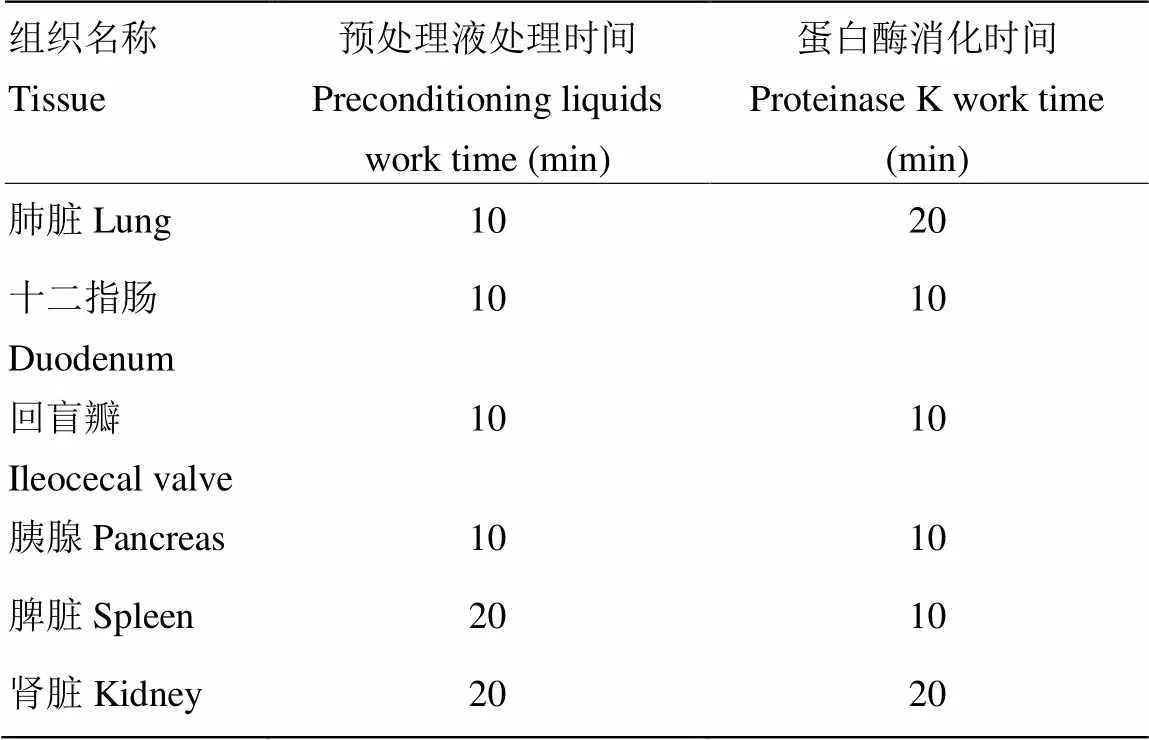
表1 各组织器官的预处理液煮沸时间及蛋白酶消化时间
2.3 猪瘟亚急性感染组织器官CSFV ViewRNA ISH、IHC与H.E染色的检测
ViewRNA ISH结果显示,1 dpi十二指肠的杯状细胞周围检测到病毒 RNA,整个病程中,肠绒毛病毒 RNA逐渐增多;IHC结果显示,1 dpi检出病毒蛋白,整个病程中,病毒蛋白含量及分布与CSFV ViewRNA ISH相似。10—13 dpi 病毒 RNA信号及蛋白信号强度显著增加;H.E结果显示,1 dpi肠绒毛出现出血和淋巴浸润,随着病程延长,肠绒毛柱状上皮细胞脱落(图3)。
ViewRNA ISH结果显示,1 dpi胰腺的腺泡出检测到RNA信号,随着病程延长,CSFV在腺泡及朗格罕岛的含量逐渐增加;IHC结果显示,1 dpi可以检测到病毒蛋白阳性信号存在于腺泡,在整个病程中病毒蛋白均集中于腺泡及朗格罕岛;H.E结果显示,3 dpi腺泡周围出血,10 dpi后腺泡结构不清(图4)。
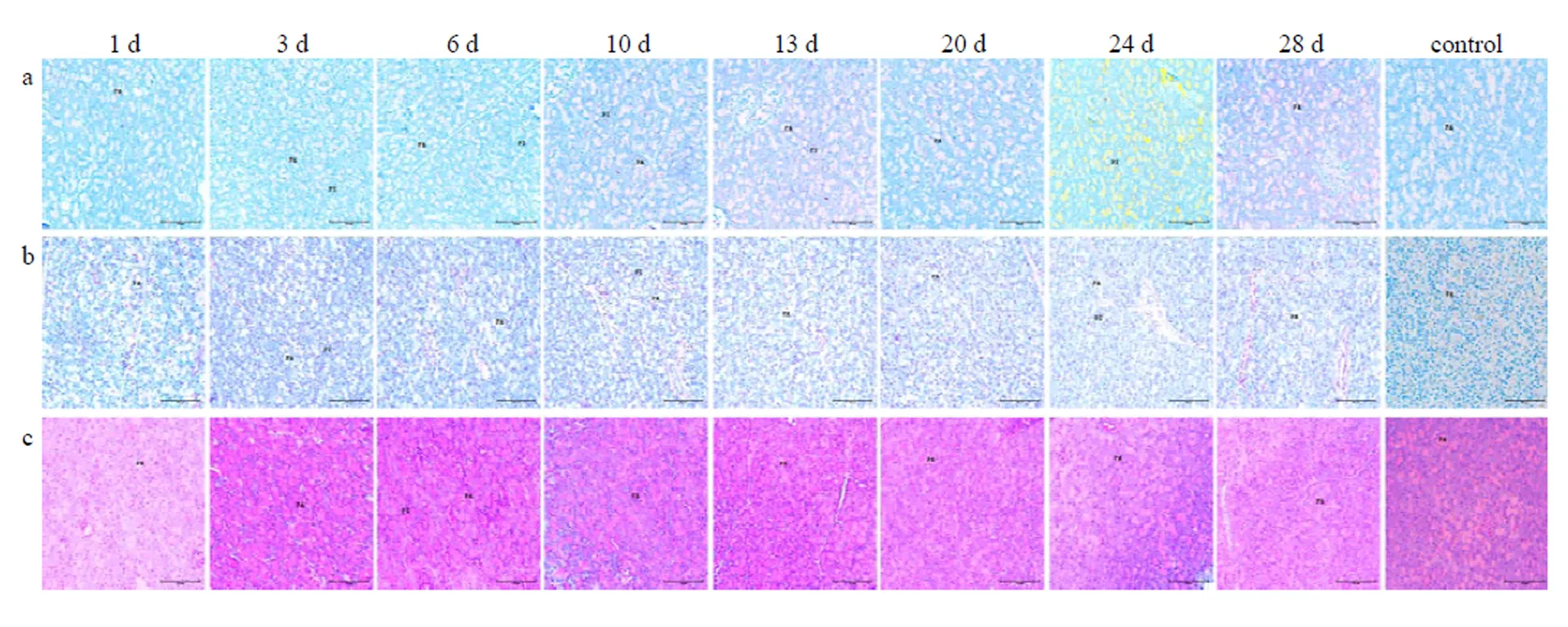
ViewRNA ISH结果显示,1 dpi回盲瓣的李氏隐窝及固有层检测到病毒RNA信号,随着病程延长,CSFV含量在该位置逐渐增加;IHC结果显示,1 dpi未见病毒蛋白阳性信号,3 dpi可以检测到病毒蛋白阳性信号存在于固有层和李氏隐窝,随着病程延长,病毒蛋白含量逐渐增加;H.E结果显示,3 dpi固有层有炎性细胞浸润同时伴随充血,10—28 dpi,杯状细胞萎缩凋亡(图5)。
ViewRNA ISH结果显示,3 dpi脾脏椭圆体周围有少量病毒RNA,6 dpi动脉周围淋巴鞘出现病毒RNA阳性信号,20—28 dpi边缘区的病毒RNA含量大量增加;IHC结果显示,3 dpi在椭圆体周围有病毒蛋白阳性信号,6 dpi动脉周围淋巴鞘及边缘区出现病毒蛋白信号;H.E结果显示,3 dpi脾脏动脉周围淋巴鞘边缘区域开始出现部分红细胞,并且有少量炎性细胞浸润,20 dpi后脾脏呈现弥漫性出血,并且脾脏组织结构难以辨认(图6)。
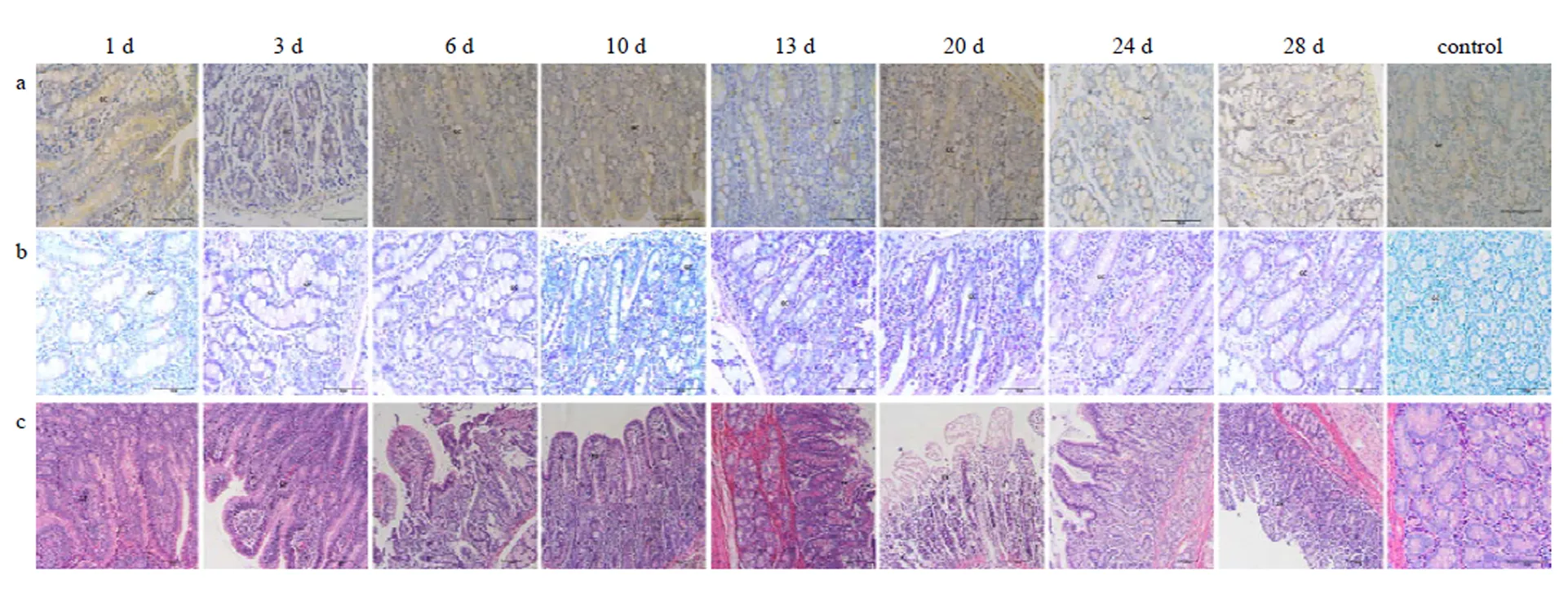
a表示ViewRNA ISH检测结果,其中CSFV的RNA靶序列被染成红色,细胞核被染成蓝色。b表示IHC检测结果,其中CSFV的靶蛋白被染成玫红色。c表示H.E染色结果.用注射生理盐水猪做阴性对照。IV:肠绒毛;GC:杯状细胞
a表示ViewRNA ISH检测结果,其中CSFV的RNA靶序列被染成红色,细胞核被染成蓝色。b表示IHC检测结果,其中CSFV的靶蛋白被染成玫红色。c表示H.E染色结果。用注射生理盐水猪做阴性对照。PA:腺泡;PI:朗格罕岛
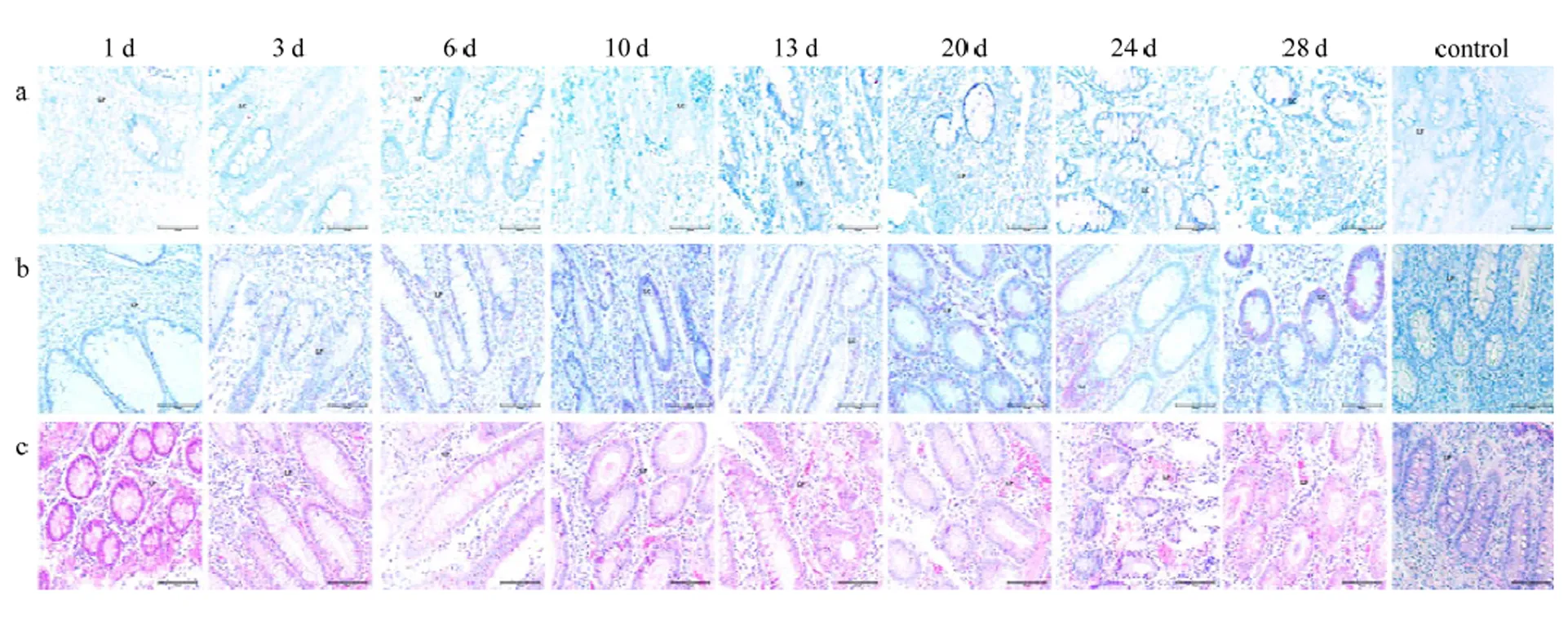
a表示ViewRNA ISH检测结果,其中CSFV的RNA靶序列被染成红色,细胞核被染成蓝色。b表示IHC检测结果,其中CSFV的靶蛋白被染成玫红色。c表示H.E染色结果.用注射生理盐水猪做阴性对照。LP:固有层;LC:李氏隐窝
ViewRNA ISH结果显示,1 dpi肾脏的肾小球、肾小管检测到病毒阳性信号,10 dpi 病毒信号主要集中在肾小管和肾小球;IHC结果显示,1 dpi在肾小管中检测到病毒蛋白阳性信号,3 dpi发现肾小球存在病毒蛋白,随着病程延长,病毒蛋白集中在肾小管;H.E结果显示,1—6 dpi肾小球毛细血管充血,肾小管间隙可见少量出血,在10—13 dpi出血更为严重,并出现少量炎性细胞,20—28 dpi肾小球囊腔缩小,部分几乎不可见,呈现纤维化(图7)。
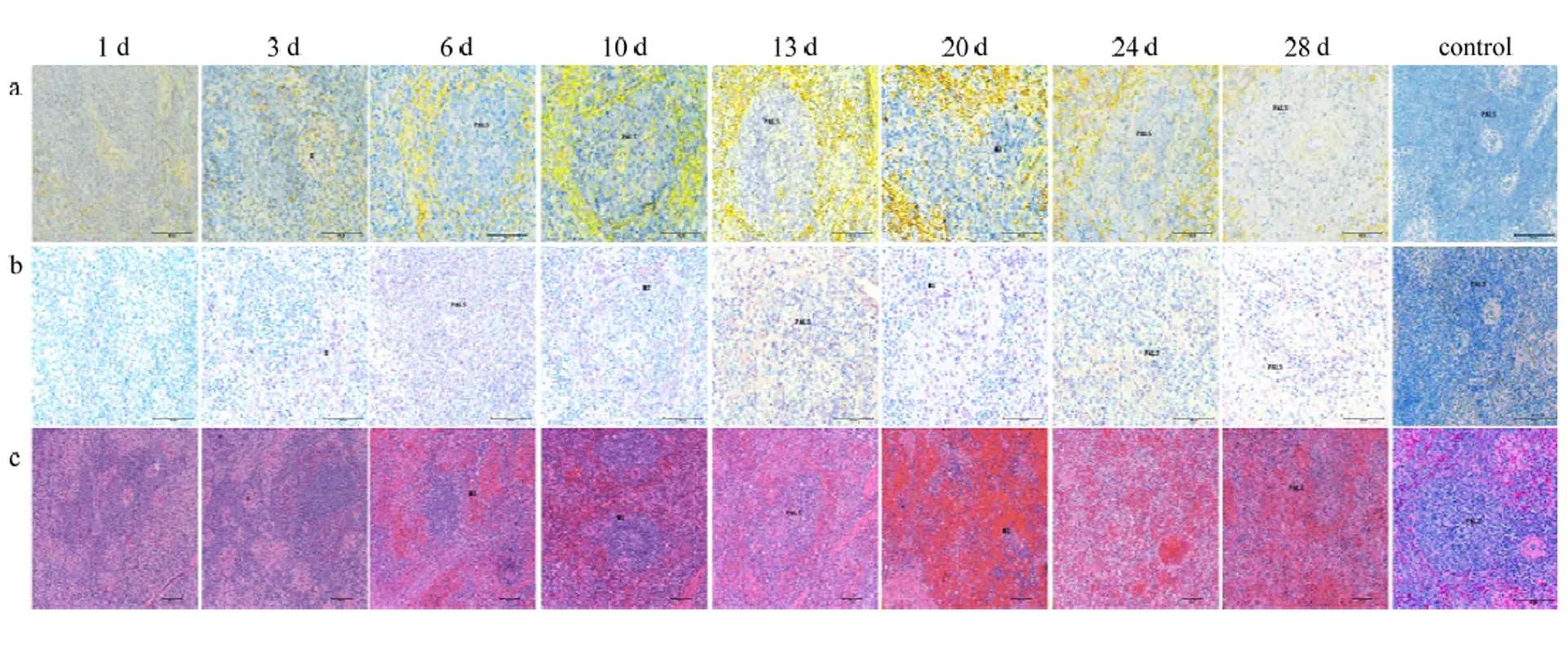
a表示ViewRNA ISH检测结果,其中CSFV的RNA靶序列被染成红色,细胞核被染成蓝色。b表示IHC检测结果,其中CSFV的靶蛋白被染成玫红色。c表示H.E染色结果.用注射生理盐水猪做阴性对照。E:椭圆体;PALS:动脉周围淋巴鞘;MZ:边缘区
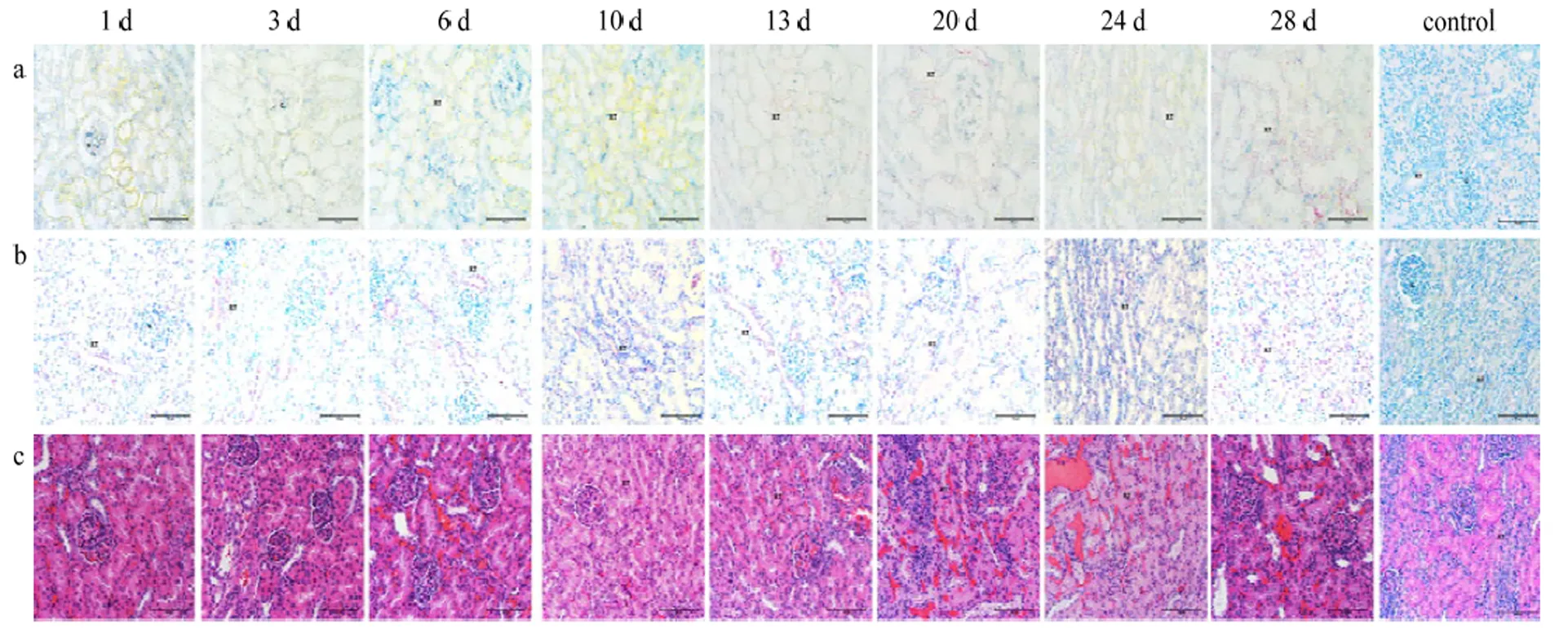
a表示ViewRNA ISH检测结果,其中CSFV的RNA靶序列被染成红色,细胞核被染成蓝色。b表示IHC检测结果,其中CSFV的靶蛋白被染成玫红色。c表示H.E染色结果.用注射生理盐水猪做阴性对照。G:肾小球;RT:肾小管
ViewRNA ISH结果显示,3 dpi肺脏的细支气管附近检测到病毒RNA,整个病程中,病毒 RNA含量略有增加;IHC结果显示,3 dpi检出病毒蛋白,整个病程中,病毒蛋白含量均较低;H.E结果显示,在3 dpi肺间质增厚充血并出现少量炎性细胞,支气管内可见出血,在6—13 dpi血管内可见大量血细胞、少量脱落的组织细胞和其他分泌物,并伴有炎性细胞浸润,20—28 dpi,肺间质充血明显缓解(图8)。

a表示ViewRNA ISH检测结果,其中CSFV的RNA靶序列被染成红色,细胞核被染成蓝色。b表示IHC检测结果,其中CSFV的靶蛋白被染成玫红色。c表示H.E染色结果.用注射生理盐水猪做阴性对照。B:细支气管;LI:肺间质
3 讨论
ViewRNA ISH是一种新型原位杂交技术,融合了传统原位杂交技术与荧光原位杂交(FISH)技术的优点[13]。通过设计目的基因的“Z”型结构特异探针,利用“Z”型探针底部与经蛋白酶消化后暴露的靶RNA杂交,之后加入标记引物与相应的“L”型标记探针,使得一个转录样本便可产生8 000倍的放大效应。ViewRNA ISH基于特殊的探针设计与专有的信号放大方法[14],在准确性、灵敏度、重复性等方面较常规原位杂交技术都有大幅提高[15],可以在单细胞中对多个目标基因的低拷贝乃至单拷贝RNA做出检测。ViewRNA ISH具有操作周期短,一天内可以完成的优点。相对于不易获取抗体的免疫组化和免疫荧光试验,ViewRNA ISH针对目标基因或序列,可以进行灵活的探针设计,新探针设计一周内可完成,实现了缩短试验周期的目标。因此,通过设计CSFV RNA与β-actin RNA探针并优化了CSFV ViewRNA ISH方法,为研究猪瘟亚急性感染后体内病毒RNA和蛋白的分布情况,有助于阐述亚急性病程病毒的复制分布规律,为猪瘟的早期诊断和预防奠定重要基础。
根据猪瘟病程长短、临床症状等可将猪瘟分为急性型、亚急性型、慢性型等不同类型。其中亚急性型猪瘟一般病程达21—30 d[2],患畜精神沉郁,食欲下降或停食,体温一般升高至40.5℃左右,便秘、腹泻交替出现。亚急性型猪瘟动物模型的构建主要与病毒致病力和接种剂量有关,本研究应用1.5×103.66TCID50的中等致病力毒株HeBHH1/95成功构建出与上述症状相似的亚急性动物模型。
本试验为保证检测结果的可靠性,对猪瘟亚急性感染猪的组织器官连续切片后在相似视野下进行CSFV ViewRNA ISH、IHC和H.E进行检测,发现CSFV ViewRNA ISH在1 dpi即可检测出回盲瓣的固有层存在病毒RNA,而IHC和H.E在3 dpi才可在回盲瓣中检测到病毒蛋白和组织的病变,这表明ViewRNA ISH有很好的灵敏性且试验周期要短于IHC和H.E,是一种快速、灵敏的原位检测病毒RNA的方法。应用CSFV ViewRNA ISH发现淋巴细胞核内同样存在病毒RNA,这与张玉杰等[16]CSFV在PK15细胞中定位结果一致,提示病毒在细胞中的增殖需要宿主细胞核的参与。
脾脏是机体最大的免疫器官[17],但对淋巴组织有嗜性的CSFV却没有在1 dpi脾脏中检测到病毒RNA。首先脾脏是产生IgM的主要场所,在感染初期IgM对及时清除病毒发挥着关键作用,且脾脏中存在大量的自然杀伤细胞[18]、单核巨噬细胞[19]、树突状细胞等免疫细胞[20],这些免疫细胞在先天性免疫阶段发挥着重要抗病毒作用;其次脾脏没有输入淋巴管,也没有淋巴窦,不利于病毒随淋巴循环进入脾脏;这可能是本研究构建的猪瘟亚急性感染早期脾脏中病毒RNA信号较弱不易检出的原因。肺脏是CSFV嗜性较弱的器官,20 dpi后肺间质充血明显缓解,且病毒阳性信号减弱。CSFV在宿主体内感染的靶细胞主要是骨髓源细胞[21],如巨噬细胞,肺泡巨噬细胞能够吸收大部分进入呼吸道的颗粒物质,但是它既不能够迁移到相关的淋巴结[22],也没有抗原递呈功能[23],所以CSFV不易在肺脏中复制传播。CSFV在体内的靶细胞不仅有巨噬细胞,同时还有血管内皮细胞[24],CSFV侵入血管内皮细胞后导致血管通透性增加,因此在H.E染色中各组织出现以充血、出血、淤血为主的病理变化。CSFV对中胚层组织尤其是造血器官及血管有着特殊的亲和力[25],肾脏不是免疫器官,却在1 dpi检测到病毒RNA及蛋白,这可能与肾脏是中胚层分化而来的器官有关系[26],病毒主要位于肾小管上皮及肾小球等具有分泌功能的部位。消化管与外界直接相连,病毒等病原微生物易随着食物进入消化系统,且胃肠黏膜组织中25%是淋巴组织,这有利于嗜免疫细胞的CSFV在消化系统中传播复制。在胰腺的腺泡、十二指肠的肠绒毛及黏膜下层、回盲瓣的黏膜下层等具有分泌功能的部位同样有大量病毒聚集。
结合以上分析发现,CSFV虽然是一种亲免疫细胞的病毒,但是由于先天性免疫等因素,在亚急性感染早期,CSFV没有在脾脏大量复制。同时这几种组织在13 dpi时出现了病毒RNA及蛋白均明显增多的现象,在猪瘟慢性感染病程中,病毒在前期同样增长缓慢[27],这是由于机体先天性免疫系统发挥了重要作用。例如,CSFV感染能够诱导IL-1β的释放[28],而IL-1可以引起机体发热[29],这或许也是感染早期体温迅速升高的原因,而到了感染中期,宿主的白细胞数量明显减少,造成对病毒的抑制作用减弱[30],导致在13 dpi CSFV含量迅速增加。这进一步说明在感染早期由于先天性免疫的作用,CSFV在脾脏的增殖复制存在一定阻力。从13 dpi后的病程中CSFV在各组织内开始大量繁殖,并广泛分布在组织内的各个部位,CSFV不仅在像脾脏动脉周围淋巴鞘等免疫细胞聚集区大量复制增殖,还会在胰腺的腺泡、肾脏的肾小管等具有分泌功能的结构处增殖复制。
4 结论
采用优化的CSFV ViewRNA ISH能在1 dpi检测到猪瘟亚急性感染猪回盲瓣组织中的病毒RNA,较IHC能更早检出病毒的存在;采用CSFV ViewRNA ISH、ICH方法对各个组织中病毒RNA进行定位,结果与H.E染色检测到的组织损伤部位一致,表明ViewRNA ISH具有较高的灵敏度,适用于感染早期CSFV在嗜性组织中RNA动态分布研究;研究还表明猪瘟亚急性感染早期病毒RNA通常在腺泡、肾小管等结构及脾脏的椭圆体周围复制,感染中期在各组织中广泛分布且大量增殖,感染后期病毒主要富集在淋巴结和有分泌功能的部位,表明病毒对分泌结构如腺泡也存在明显嗜性。
[1] SAMBANDAM R, ANGAMUTHU R, KANAGARAJ V, KATHAPERUMAL K, SHUBHADA K C, RUTH H N, RHIANNON M B, BHUSHAN M J, SURESH V K. An immuno-chromatographic lateral flow assay (LFA) for rapid on-the-farm detection of classical swine fever virus (CSFV)., 2017, 162(3/4): 1-6.
[2] 王琴, 涂长春. 猪瘟. 北京: 中国农业出版社, 2015: 15.
WANG Q, TU C C.Beijing: China Agriculture Press, 2015: 15. (in Chinese)
[3] EDWARDS S, FUKUSHO A, LEFEVRE P C, LIPOWSKI A, PEJSAK Z, ROEHE P. Classical swine fever: the global situation., 2000, 73(2): 103-119.
[4] CHEVILLE N F, MENGELING W L. The pathogenesis of chronic hog cholera (swine fever). Histologic, immunofluorescent, and electron microscopic studies. Laboratory investigation., 1969, 20: 261-274.
[5] LIU J, FAN X Z, WANG Q, XU L, ZHAO Q Z, HUANG W, ZHOU Y C, TANG B, CHEN L, ZOU X Q, SHA S, ZHU Y Y. Dynamic distribution and tissue tropism of classical swine fever virus in experimentally infected pigs., 2011, 8(1): 201-211.
[6] 陈锴. 猪瘟慢性感染对猪免疫功能影响的细胞与分子机制研究[D]. 雅安:四川农业大学, 2012.
CHEN K. Research on the immune and cellular mechanism after classical swine fever virus chronic infection [D]. Yaan: Sichuan Agricultural University, 2012. (in Chinese)
[7] TAYLOR A M, BERCHTOLD N C, PERREAU V M, TU C H, LI J N, COTMAN C W. Axonal mRNA in uninjured and regenerating cortical mammalian axons., 2009, 29(15): 4697-4707.
[8] YU M, DAVID T T, STOTT S L, WINTER B S, OZSOK L F, PAUL S, CICILIANO J C, SMAS M E, WINOKUR D, GILMAN A J, ULMAN M J, XEGA K, CONTIO G, ALAGESN B, BRANNGIN B W, MILOS P M, RYAN D P, SEQUIST L V, BARDEESY N, RAMASWAMY S, TONER M, MAHESWARAN S, HABER D A. . RNA sequencing of pancreatic circulating tumour cells implicates WNT signaling in metastasis., 2012, 487 (7408) : 510-513.
[9] ZHANG Q Y, XU L, ZHANG Y J, WANG T J, ZOU X Q, ZHU Y Y, ZHAO Y, LI C, CHEN K, SUN Y F, SUN J X, ZHAO Q Z, WANG Q. A novel View RNA in situ hybridization method for the detection of the dynamic distribution of Classical Swine Fever Virus RNA in PK15 cells., 2017, 14(1): 81-89.
[10] MITTELHOLZER C, MOSER C, TRATHSIN J D, HOFMANN M A. Porcine cells persistently infected with classical swine fever virus protected from pestivirus-induced cytopathic effect., 1998, 79: 2981-2987.
[11] 朱长康. 猪瘟病毒人工慢性感染的组织病理学和病毒核酸载量动态分布研究[D]. 雅安: 四川农业大学, 2012.
ZHU C K. Histopathology and dynamic distribution of classical swine fever virus in chronically infected pigs [D]. Yaan: Sichuan Agricultural University, 2012. (in Chinese)
[12] 刘同慎, 李冰. HE染色程序的使用和维护. 生物学通报, 2013 , 48 (4) : 55-57.
LIU T S, LI B. Use and maintenance of HE staining program., 2013 , 48(4): 55-57. (in Chinese)
[13] 赵燕. 猪瘟病毒QuantiGene ViewRNA原位杂交方法的建立及初步应用[D]. 北京:中国兽医药品监察所, 2014.
ZHAO Y. Establishment and rreliminary application of CSFV QuantiGene ViewRNA in situ hybridization technique[D]. Beijing:China Institute of Veterinary Drugs Control, 2014. (in Chinese)
[14] LAIHO J E, OIKARINEN S, OIKARINEN M, LARSSON P G, STONE V M, HOBER D, OBSERTE S, FLODSTROM T M, ISOLA J, HYOTY H. Application of bioinformatics in probe design enables detection of enteroviruses on different taxonomic levels by advanced in situ hybridization technology., 2015, 69 : 165-171.
[15] 王珊珊, 马建, 史楠, 刘强韦, 华冕, 周建华. 应用ViewRNA技术特异性检测感染细胞中的不同马传染性贫血病毒株. 中国预防兽医学报, 2011, 33(10) : 800-803.
WANG S S , MA J, SHI N, LIU Q W, HUA M, ZHOU J H. In situ detection of co-infected equine infectious anemia virus heterologous strains in fetal donkey dermal cells using a View RNA assay.2011, 33(10): 800-803. (in Chinese)
[16] 张玉杰, 赵燕, 徐璐, 张乾义, 陈锴, 孙永芳, 邹兴启, 朱元源, 赵启祖, 宁宜宝, 王琴. RNA可视化原位杂交技术对感染细胞中猪瘟病毒RNA定位与分布. 中国农业科学,2016 , 49(12): 2397-2407.
ZHANG Y J, ZHAO Y, XU L, ZHANG Q Y, CHEN K, SUN Y F, ZOU X Q, ZHU Y Y, ZHAO Q Z, NING Y B, WANG Q. Study of location and distribution of classical swine fever virus RNA in PK15 cells by visualization in situ hybridization technology., 2016, 49(12) : 2397-2407. (in Chinese)
[17] 孙佳鑫, 侯明星. 促吞噬肽免疫学机制的研究进展. 世界最新医学信息文摘, 2018, 18(16): 53-54.
SUN J X, HOU M X. The advances of Tuftsin on immunological mechanisms.2018, 18(16): 53-54. (in Chinese)
[18] SONG H, CHEN L, SUN F. Expansion of spleen myeloid suppressor cells represses NK cell cytotoxicity in tumor-bearing host.2007, 109(10): 4336-4342.
[19] BUCKLEY P J, SMITH M R, BRAVERMAN M F, DICKSON S A. Human spleen contains phenotypic subsets of macrophages and dendritic cells that occupy discrete microanatomic locations., 1987, 128(3): 505-520.
[20] MARVEL D M, FINN O J. global inhibition of DC priming capacity in the spleen of self-antigen vaccinated mice requires IL-10., 2014, 5: 59-83.
[21] SUMMERFIELD A, KNOETIG S M, TSCHUDIN R, MCULLOUGH K C. Pathogenesis of granulocytopenia and bone marrow atrophy during classical swine fever involves apoptosis and necrosis of uninfected cells., 2000, 272 (1): 50-60.
[22] LAMBRECHT B N. Alveolar macrophage in the driver's seat., 2006, 24 (4): 366-368.
[23] JAKUBZICK C, TACKE F, LODRA J, VAN R N, RANODPH G J. Modulation of dendritic cell trafficking to and from the airways., 2006, 176(6): 3578-3584.
[24] NING P B, ZHANG Y M, GUO K K, CHEN R, LANG W L, LIN Z, LI H L. Discovering up-regulated VEGF–C expression in swine umbilical vein endothelial cells by classical swine fever virus Shimen., 2014, 45(1): 48-53.
[25] GOMEZ-VILLAMANDOS J C, SALGUERO F J, RUIZ- VILLAMOR E, SANCHEZ P J, BAUTISTA M J, SIERRA M A. Classical swine fever: pathology of bone marrow., 2003, 40(2): 157-163.
[26] ALBERT Q L, BENJAMIN S F, RYUJI M, PAUL H L, VALERIUS M T, BONVENTRE J V. Rapid and efficient differentiation of human pluripotent stem cells into intermediate mesoderm that forms tubules expressing kidney proximal tubular markers., 2014, 25(6): 1211-1225.
[27] XU L, FAN X Z, ZHAO Q Z, ZHANG Z X, CHEN K, NING Y B, ZHANG Q Y, ZOU X Q, ZHU Y Y, LI C, ZHANG Y J, WANG Q. Effects of vaccination with the C-Strain vaccine on immune cells and cytokines of pigs against classical swine fever virus., 2017, 31(1): 34-39.
[28] 林鸷. 白介素-1β和胆固醇在猪瘟病毒感染中的作用[D]. 杨凌: 西北农林科技大学, 2015.
LIN Z. The role of IL-1β and cholesterol in classical swine fever virus infection [D]. Yangling: North-west Agriculture and Forestry University, 2015. (in Chinese)
[29] SCHMITA J, OWYANG A, OLDHAM E, SONG Y, MURPHY E, MCCLANAHAN T K, ZURASWKI G, MOSHREFI M, QIN J, LI X, GORMAN D M, BAZAN J F, KASTELEIN R A. IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines., 2005s, 23(5): 479-490.
[30] 李素, 王惟, 张淑琴, 董鹏, 朱妍, 郭焕成, 涂长春. 猪瘟病毒感染猪细胞因子和趋化因子的动态变化. 中国生物制品学志, 2010, 23(10): 1038-1042.
LI S, WANG W, ZHANG S Q, DONG P, ZHU Y, GUO H C, TU C C. Kinetics of cytokines and chemokines of pigs infected with classical swine fever virus., 2010, 23(10): 1038-1042. (in Chinese)
Dynamic Distribution of Classical Swine Fever Virusafter Infection by Intermediate Virulent Strains
SUN JunXiang1, ZHANG QianYi1, XU HeMin2, WANG TuanJie1, XU Lu1, ZOU XingQi1, ZHU YuanYuan1, LI Cui1, XIA YingJu1, XU Yuan1, CHEN Kai1, ZHANG YuJie1, ZHAO QiZu1, WANG Qin1
(1National/OIE Reference Laboratory for Classical Swine Fever, China Institute of Veterinary Drug Control, Beijing 100081;2China Animal Husbandry Industry Co., LTD, Beijing 100070)
【Objective】At present, the infection type of classical swine fever in China is mainly subacute or chronic infection. The aim of this study was to investigate the differences and distribution of RNA and protein expressions in pigs infected with the intermediate virulent strain of classical swine fever virus.The results couldhelp to elucidate the replication and distribution of the subacute disease virus and to provide technical support for the early diagnosis and prevention of classical swine fever.【Method】Using the medium virulence strain (HEBHH1/95), we successfully established a subacute CSF infection animal model. Duodenum, spleen, kidney, lung, pancreas and ileocecal samples were collected from pigs for viewing in situ hybridization (ISH), immunohistochemistry (IHC) and hematoxylin-eosin staining (HE) at 1 day post infection (dpi), 3 dpi, 6 dpi, 10 dpi, 13 dpi, 20 dpi, 24 dpi and 28 dpi. The ViewRNA ISH was used to study the dynamic distribution of viral RNA in infected tissues. Immunohistochemistry (IHC) and HE staining were used to detect the distribution of viral proteins in infected tissues and their contribution to tissue damage.【Result】The clinical score increased rapidly from 6 dpi to 10 dpi, then from 11 dpi to 26 dpi the score remained at approximately 15,until at 28 dpi clinical score peaked at 20 points. The body temperature showed an upward trend from 8 dpi to 10 dpi, and then livestock suffered from continuous fever which persisted at about 40℃from 13 dpi to 24 dpi, thereafter, the body temperature began to fall back to about 39.5℃before the animal died. Viral RNA were detected in duodenum, pancreas, ileocecal valve and kidney at 1 dpi and in the lungs of the bronchioles, spleen oval body at 3 dpi; Viral RNAs widely distributed in each tissue at 28 dpi, and were mainly observed in the spleen artery around the lymphatic sheath, pancreatic acinar, renal tubular with secretion function. The IHC and HE staining were used to verify the results of ViewRNA ISH in similar fields of vision. The positive signals of viral proteins and the corresponding histopathological changes of duodenum, pancreas and kidney were also detected at 1 dpi, but the viral protein and tissue pathological changes were detected in the ileocecal valve, spleen and lung at 3 dpi. Viral RNA and protein localization tended to be the same in each tissue after 3 dpi.【Conclusion】All the results showed that CSFV had an increasing virus load from 1 dpi to 28 dpi detected by ViewRNA ISH,which was in consistent with the result of IHC. Moreover, CSFV was firstly tropism to secretory cells such as pancreatic acinar, renal tubular and spleen artery at the beginning of infection (1 dpi-3 dpi), and then showed pantropically infectious to all the tissues during the infection period (6 dpi-13 dpi), and during the final stage CSFV was accumulated both around lymphocytes and secretory cells (20 dpi-28 dpi).
CSFV; medium virulent; RNA; ViewRNA ISH; distribution
10.3864/j.issn.0578-1752.2018.21.013
2018-04-18;
2018-05-28
“十二五”农村领域国家科技计划课题(2015BAD12B04)、“十三五”猪重要疫病抗体快速检测技术研究(2016YFD0500702-4)
孙骏翔,E-mail:yixiao_xi@163.com;张乾义,E-mail:zhangqy114@126.com。孙骏翔和张乾义为同等贡献作者。通信作者王琴,E-mail:wq551@vip.sina.com。通信作者赵启祖,E-mail:zhaoqizu@163.com
(责任编辑 林鉴非)

