小鼠原代胰腺腺泡细胞分离提纯的简化方法
庄璐 万剑华 黄浩杰 李兆申 纪保安
胰腺腺泡细胞的离体制备可从人、猪、禽类的胰腺中获取,但既往的研究主要在于鼠类(包括大鼠、小鼠和荷兰猪)。1972年Amsterdam和Jamieson[1]首次报道动物体内胰腺腺泡的分离方法,目前所采用的标准方法是基于1978年报道的提取方法的改进[2-3],但这些分离方法均耗时较长。本研究对小鼠胰腺腺泡细胞的提取和纯化进行了简化,现报道如下。
材料与方法
一、实验材料
8~12周健康成年野生型C57BL/6(Black 6)小黑鼠,雌雄不限,体重23~28 g,由第二军医大学实验动物中心提供,在第二军医大学长海医院消化科实验室的清洁级环境下由专人饲养,标准型进食和饮水。
胶原酶溶液用含1%双抗生素及0.1 mg/ml胰蛋白酶抑制剂(soybean trypsin inhibitor, SBTI, Sigma #T9003)的DMEM细胞培养液(Gibco #12273)配制,终浓度为100 U/ml。4%小牛血清白蛋白(bovine serum albumin, BSA)溶液用上述同样的DMEM细胞培养液配制。
淀粉酶溶液用含0.05 mol/L NaCl、0.02 mol/L NaH2PO4、终浓度为0.02% NaN3的溶液(pH 7.4)配制,置4℃保存。Phadebas溶液用1粒phadebas amylase substrate药片溶于14 ml淀粉酶溶液配制,在加入样本之前需不停漩涡搅拌。
二、实验方法
以断颈法或二氧化碳麻醉法处死小鼠,固定于超净工作台上,皮肤消毒后,在小鼠腹部生殖区至隔膜区间剪开一个V字型切口,于肝脏下缘找到脾脏和胰腺,快速切除完整胰腺,置PBS溶液,去除多余脂肪及淋巴组织后将完整胰腺移入盛有5~7 ml胶原酶溶液的细胞培养皿中。用5 ml注射器吸取培养皿中的胶原酶溶液,以27 G小针头多次往胰腺内注射,直到胰腺变大,组织间质变透明,类似水肿状态(图1)。将胰腺剪成5 mm~1 cm大小的组织块,连同培养皿中的胶原酶溶液一起移入50 ml塑料烧瓶中,充入95%氧气,迅速盖紧瓶盖,置37℃旋转水浴槽内,以120~150 r/min震荡10~15 min。取出烧瓶,倒掉瓶内的胶原酶溶液,加入5 ml新鲜配制的胶原酶溶液,充入95%氧气后继续在37℃水浴槽内以同样转速继续震荡40~60 min。取出烧瓶,用10 ml移液器上下吹打成细胞悬液,经150 μm孔径的无菌尼龙筛网过滤,待其自然沉淀,弃上清,将底部沉淀的细胞移入4% BSA溶液中自然沉淀以纯化细胞。若移液器吹打后仍有较多较大胰腺组织块未被消化,可重复上述操作。以50×g离心2 min后弃上清,此时沉淀细胞为纯化后的胰腺腺泡细胞,为防止细胞贴壁可将细胞移至含有0.5%~1% BSA的DMEM细胞培养液中,以移液器吹打混悬,置入细胞培养皿,常规培养30 min。

图1 被胶原酶溶液完全充盈的新鲜小鼠全胰腺组织
将腺泡细胞培养液转入50 ml离心管,静置沉淀后弃上清,加入30 mlDMEM培养液洗涤,吹打混匀,取2 ml细胞(约1×105个)分装于血液稀释管内,分别加入1、50、100、1 000 mol/L CCK-8,每组设3管,以不加CCK-8的细胞作为对照,置37℃旋转水浴槽内以100 r/min震荡培养30 min。冰上放置5 min后取100 μl细胞培养上清移至新的DEPC管,放置冰上保存。每管细胞沉淀同剩余上清液一起混均,取1 ml置冰上超声破碎后再以DMEM稀释10倍。取10 μl培养上清液或超声破碎后稀释10倍的细胞混悬液,分别与20 μl淀粉酶溶液置冰上混合,总体积为30 μl。以单加30 μl淀粉酶溶液作为对照。所有各样本内加入1 ml Phadebas溶液,迅速转入37℃水浴锅水浴10~15 min,期间不断上下震荡混匀,当不同组间样本颜色变化差异明显时(淀粉酶水平高变蓝)再次同时移入冰盒内,加4 ml 0.05 mol/L NaOH终止反应,轻柔上下颠倒混匀,4℃ 4 000 r/m低温离心5 min。上分光光度仪,以空白孔调0,测各管在620 nm波长处的吸光值(A620值)。根据标准曲线换算成相应淀粉酶水平,总淀粉酶水平是测定值的10倍,以不同上清液淀粉酶水平与总淀粉酶水平的百分比绘制不同CCK-8浓度刺激后腺泡细胞分泌的淀粉酶水平的曲线。
结 果
一、细胞培养及CCK-8刺激后的细胞形态变化
光镜下可见腺泡细胞在培养液中散在悬浮分布,状态较好的腺泡细胞多呈团状,其基底外侧区域表面呈光滑圆形且没有泡状物,胞质清晰,顶端区域被数百个酶原颗粒包围,颜色较暗,细胞核位于囊泡状区域的基底部,培养液中未见明显细胞碎片(图2A)。新鲜提取的腺泡细胞可置于37℃、5% CO2细胞培养箱内悬浮培养24~48 h,但培养数小时后就逐渐失去细胞极性和细胞分泌功能。培养后期,腺泡细胞转为单层细胞,且酶活性消失。加入CCK-8刺激后30 min,光镜下见腺泡细胞基底部外侧产生不规则泡状物,这是腺泡细胞经CCK-8刺激后受损伤的标志(图2B)。
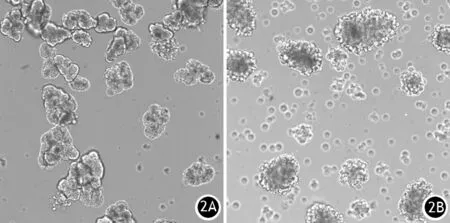
图2 新鲜提取的小鼠胰腺腺泡细胞(2A)及100 pmol/L CCK-8刺激30 min后的腺泡细胞(2B)
二、CCK-8刺激后腺泡细胞淀粉酶的释放水平
未加CCK-8刺激组腺泡细胞的淀粉酶基础分泌水平约占总淀粉酶分泌水平的2.5%;CCK-8刺激后腺泡细胞分泌的淀粉酶水平升高,CCK-8浓度为50 pmol/L时淀粉酶分泌水平达到峰值,该比例上升为(12.83±1.04)%,接近基础分泌水平的5倍。随后高于此浓度CCK-8刺激时细胞分泌的淀粉酶水平/总淀粉酶水平百分比下降(图3)。
讨论
胰腺腺泡细胞占据胰腺实质的90%,其主要作用是合成和分泌消化酶[4]。有研究者认为腺泡细胞的损伤参与了胰腺炎的初始阶段[1,5],急性胰腺炎的胰腺形态学改变已被证实是由于胰腺腺泡细胞合成和分泌的酶导致腺体自身消化所引起[6],因此获得稳定可靠的胰腺腺泡细胞可为胰腺疾病的基础研究提供重要工具和平台。然而,长期以来胰腺腺泡细胞的分离和提纯均较为棘手。
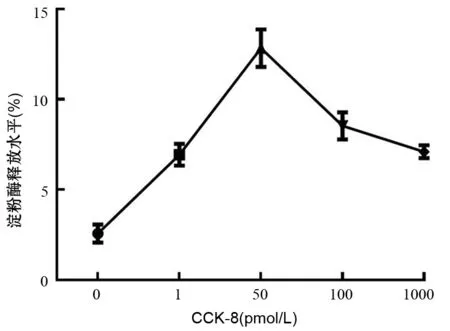
图3 不同浓度CCK-8离体刺激胰腺腺泡细胞30 min后的淀粉酶分泌曲线
Dorrell等[7]使用荧光激活细胞分选法(fluoresc-ence-activated cell sorting, FACS)有效分离了小鼠胰腺腺泡、导管及内分泌细胞,但该方法较为复杂,需要以荧光标记特定抗体进行细胞分选,对其技术水平有较高要求,且分选出来的胰腺腺泡细胞缺失部分初始结构。 此外由于正常胰腺腺泡细胞可被蛋白水解酶分解或被Ca2+等螯合剂损伤,腺泡细胞的体外培养更为困难。Gout等[8]使用含有HEPES、胶原酶和胰蛋白酶抑制剂的Hank′s消化液分离胰腺腺泡细胞,并在培养液中加入表皮生长因子体外培养腺泡细胞可达1周以上,但该法提取的腺泡细胞会在培养过程中加速腺泡细胞向导管样细胞的转变。张桦等[9]用Hank′s消化液内灌注法机械提取腺泡细胞,何忠野和郭仁宣[10]向大鼠胰胆管内逆行注射胶原酶溶液提取腺泡细胞,王连才等[11]用Hank′s消化液改进法提取大鼠胰腺腺泡细胞,以上研究虽然都对经典提取方法有不同程度改进,也获得了符合要求的腺泡细胞,但在一定时间范围内胰腺组织的消化并不充分,同时也对胰腺细胞的功能产生了不同程度的损伤。以往文献中所提到的胰腺腺泡分离方法耗时均较长,通常需要在实验当天新鲜配置或购置Hank′s液、调节溶液pH值等。此外,目前最为常用的胰腺腺泡细胞系是从移植性大鼠胰腺癌组织中分离提取的AR42J细胞[12]以及从弹性蛋白酶I/SV-40 T抗原融合基因诱导的成年小鼠胰腺癌组织中分离提取的266-6细胞[13]。本研究采用的改进方法能快速从小鼠胰腺成功分离提纯质量较好的腺泡细胞,过程较其他研究更为简便且经济,所用到的胶原酶和胰蛋白酶抑制剂、BSA试剂、DMEM细胞培养液均为常规试剂,无需额外调节溶液的pH值,提取过程中细胞离心次数较少,降低了细胞污染和损伤概率。
分泌淀粉酶能力是胰腺腺泡细胞的重要功能之一。CCK在食物消化的刺激后调控胰腺外分泌的功能中起主要作用,胰腺炎动物实验模型常使用CCK或CCK类似物(雨蛙素等)刺激胰腺细胞及胰腺分泌大量消化酶,CCK对胰腺急性损伤的刺激程度具有明显的时间和剂量依赖性[14-15]。本法提取的胰腺腺泡细胞在CCK-8刺激后的淀粉酶分泌水平曲线结果与文献报道的[16]使用配制过程繁琐的Krebs-Ringer bicarbonate HEPES (KRBH)溶液提取腺泡细胞的曲线较为一致,说明本法提取的腺泡细胞功能活性保持较好,非常适合用于与体内实验对应的胰腺炎体外造模的腺泡细胞病理生理变化相关的研究。
[1] Amsterdam A, Jamieson JD. Structural and functional characterization of isolated pancreatic exocrine cells[J]. Proc Natl Acad Sci U S A, 1972, 69(10): 3028-3032. DOI: 10.1073/pnas.69.10.3028.
[2] Peikin SR, Rottman AJ, Batzri S, et al. Kinetics of amylase release by dispersed acini prepared from guinea pig pancreas[J]. Am J Physiol, 1978, 235(6): E743-E749. DOI: 10.1152/ajpendo.1978.235.6.E743.
[3] Williams JA, Korc M, Dormer RL. Action of secretagogues on a new preparation of functionally intact, isolated pancreatic acini[J]. Am J Physiol, 1978, 235(5): 517-524. DOI: 10.1152/ajpendo.1978.235.5.E517.
[4] Grossman A. An overview of pancreatic exocrine secretion[J]. Comp Biochem Physiol B, 1984, 78(1): 1-13. DOI: 10.1016/0305-0491(84)90136-6.
[5] Jamieson JD, Palade GE. Intracellular transport of secretory proteins in the pancreatic exocrine cell. II. Transport to condensing vacuoles and zymogen granules[J]. J Cell Biol, 1967, 34(2): 597-615. DOI: 10.1083/jcb.34.2.597.
[6] Lerch MM, Saluja AK, Dawra R, et al. Acute necrotizing pancreatitis in the opossum: earliest morphological changes involve acinar cells[J]. Gastroenterology, 1992, 103(1): 205-213. DOI: 10.1016/0016-5085(92)91114-J.
[7] Dorrell C, Grompe MT, Pan FC, et al. Isolation of mouse pancreatic alpha, beta, duct and acinar populations with cell surface markers[J]. Mol Cell Endocrinol, 2011, 339(1-2): 144-150. DOI: 10.1016/j.mce.2011.04.008.
[8] Gout J, Pommier RM, Vincent DF, et al. Isolation and culture of mouse primary pancreatic acinar cells[J]. J Vis Exp, 2013, (78). DOI: 10.3791/50514.
[9] 张桦, 蔡德鸿, 徐春生, 等. 一种简易高效的大鼠胰岛分离纯化方法[J]. 第一军医大学学报, 2001, 21(2): 129-131. DOI: 10.3321/j.issn:1673-4254.2001.02.024.
[10] 何忠野, 郭仁宣. 一种简易经济的大鼠胰腺腺泡细胞分离提纯方法[J]. 中国普通外科杂志, 2006,15(11): 866-868. DOI: 10.3969/j.issn.1005-6947.2006.11.018.
[11] 王连才, 马清涌, 陈香丽. 一种改进的简便经济的大鼠胰腺腺泡细胞分离提纯方法[J]. 第四军医大学学报, 2008, 29(3): 220-222. DOI: 10.3321/j.issn:1000-2790.2008.03.009.
[12] Barnhart DC, Sarosi GA Jr, Romanchuk G, et al. Calcium signaling induced by angiotensin II in the pancreatic acinar cell line AR42J[J]. Pancreas, 1999, 18(2): 189-196. DOI: 10.1097/00006676-199903000-00011.
[13] Ornitz DM, Palmiter RD, Hammer RE, et al. Specific expression of an elastase-human growth hormone fusion gene in pancreatic acinar cells of transgenic mice[J]. Nature, 1985, 313(6003): 600-602. DOI: 10.1038/313600a0.
[14] Watanabe O, Baccino FM, Steer ML, et al. Supramaximal caerulein stimulation and ultrastructure of rat pancreatic acinar cell: early morphological changes during development of experimental pancreatitis[J]. Am J Physiol, 1984, 246(4 Pt 1): G457-G467. DOI: 10.1152/ajpgi.1984.246.4.G457.
[15] Saluja A, Saito I, Saluja M, et al. In vivo rat pancreatic acinar cell function during supramaximal stimulation with caerulein[J]. Am J Physiol, 1985, 249(6 Pt 1): G702-G710. DOI: 10.1152/ajpgi.1985.249.6.G702.
[16] Geron E, Schejter ED, Shilo BZ. Assessing the secretory capacity of pancreatic acinar cells[J]. J Vis Exp, 2014, (90). DOI: 10.3791/51799.

