动态增强多层螺旋CT对胰腺导管内乳头状黏液瘤良恶性鉴别诊断的价值
陈雀芦 陈宇 胡文超 蒋义 都继成 马小龙 严志汉
胰腺导管内乳头状黏液性瘤(intraductal papillary mucinous neoplasm,IPMN)是起源于主胰管或分支胰管导管上皮并分泌黏蛋白的一种胰腺肿瘤。随着影像技术特别是多层螺旋CT(MSCT)和MR技术的发展,IPMN的检出率逐年升高。WHO根据组织学上肿瘤细胞的异型性将其分为导管内乳头状黏液腺瘤、交界性肿瘤或原位癌和侵袭性胰腺导管内乳头状黏液癌[1]。MRCP是目前公认的诊断IPMN的最佳影像学方法,主要优势是可确定病灶是否与主胰管相通,并可评估胰管受累的范围[2]。本研究对50例IPMN患者的MSCT图像与MRCP图像进行回顾性分析,比较两种检查方法对IPMN良恶性的鉴别价值。
材料和方法
一、一般资料
回顾性分析2007年7月至2013年7月间温州市中心医院和上海长海医院50例经手术病理证实的IPMN患者影像学资料,其中男性29例,女性21例,年龄41~82岁,平均65岁。所有患者均行平扫、动态增强MSCT及MRCP检查,并行外科切除手术。
二、MSCT和MRCT
CT扫描设备为美国GE公司Light speed pro 16层和西门子Sensation Cardiac 64层螺旋CT机。扫描范围从剑突至脐水平。扫描条件:120 kV,180 mA。扫描参数:准直0.5 mm,层厚0.5 mm,重建层厚1.25 mm,重建间隔1.25 mm,螺距1.0,矩阵512×512,视野(field of view,FOV)348 mm×348 mm。增强扫描使用高压注射器经肘前正中静脉注射非离子型对比剂碘比乐(300 mg/ml)80~90 ml,注射速率3.0~4.0 ml/s,分别于注射对比剂后20~25、60~70、110~130 s扫描得到动脉期、胰腺期、平衡期图像。在GE公司的ADW4.2工作站对图像进行计算机重建,包括(1)2D曲面重建,即利用三维空间交互参考,沿主胰管走向手工绘制曲线获得2D曲面重建图像;(2)最大密度投影,即根据胰腺周围血管走向和投影需要获得血管重建图像。
MR扫描设备为飞利浦Achieva 1.5T双梯度磁共振扫描仪和美国GE Signa HD 1.5T及3.0T磁共振扫描仪。扫描序列:(1)横断面T1WI,采用基于肝脏容积加速采集(liver acquisition with volume acceleration,LAVA)序列,重复时间(repetition time,TR)4.25 ms,回波时间(echo time,TE)1.94 ms,层厚5 mm,无层间距,FOV 320 mm×320 mm~440 mm×440 mm,矩阵240×320。(2)横断面抑脂呼吸触发T2WI序列,TR 2 833 ms,TE 86.74 ms,层厚6 mm,层间距6 mm,FOV 440 mm×440 mm,矩阵224×288。(3)厚层块二维MRCP序列,TR 7 000 ms,TE 1271.81 ms,层厚64 mm,层间距6 mm, FOV 300 mm×300 mm,矩阵288×288。
三、图像分析与评价
两名副主任医师通过图片存档及通信系统(picture archiving and communication systems,PACS)独立阅读MSCT和MRCP图像,根据影像图像出现壁结节、主胰管直径≥10 mm、分隔厚度≥2 mm、病灶内钙化、周围血管侵犯、胰周淋巴结肿大、远处转移灶以及分支胰管型IPMN病灶最大径≥30 mm征象鉴别IPMN的良恶性。
四、统计学处理
应用SPSS 21.0统计软件进行数据分析和处理。绘制影像学检查征象的受试者工作特征(ROC)曲线,测量其曲线下面积(AUC),确定临界诊断值,以病理结果为金标准分别计算MSCT和MRCP鉴别诊断IPMN良恶性的敏感性、特异性、准确性。采用χ2检验比较两种影像学检查方法鉴别诊断IPMN良恶性的差异。P<0.05为差异有统计学意义。
结 果
一、临床症状
50例IPMN患者主要临床症状为中上腹部不适、腹痛35例,体重减轻13例,急性胰腺炎或急性复发性胰腺炎26例,黄疸8例,体检偶尔发现、无明显临床症状的10例。18例患者出现不同程度CA19-9、CEA升高。
二、病理学检查
50例IPMN患者中15例为良性导管内乳头状腺瘤,23例为交界性肿瘤或原位癌,12例为侵袭性导管内乳头状癌。本研究将交界性肿瘤或原位癌和侵袭性导管内乳头状癌统一归为恶性IPMN。主胰管型和混合胰管型IPMN共38例,分支胰管型IPMN 12例。
三、IPMN患者MSCT与MRCP影像学征象
50例IPMN中MSCT图像发现壁结节30例(图1),无壁结节20例,壁结节诊断恶性IPMN的敏感性、特异性、准确性分别为77.1%(27/35)、80.0%(12/15)、78.0%(39/50);MRCP图像发现壁结节29例,无壁结节21例,其敏感性、特异性、准确性分别为77.1%(27/35)、86.7%(13/15)、80.0%(40/50)。
主胰管型和混合胰管型的38例IPMN中,MSCT图像发现28例主胰管≥10 mm(图1),10例主胰管<10 mm,主胰管≥10 mm诊断恶性IPMN的敏感性、特异性、准确性分别为96.3%(26/27)、81.8%(9/11)、92.1%(35/38);MRCP图像发现27例主胰管扩张≥10 mm,11例主胰管<10 mm,其敏感性、特异性、准确性分别为96.3%(26/27)、90.9%(10/11)、94.7%(36/38)。12例分支胰管型IPMN中,MSCT及MRCP图像均显示7例病灶长径≥30 mm,其中5例病理诊断为恶性。
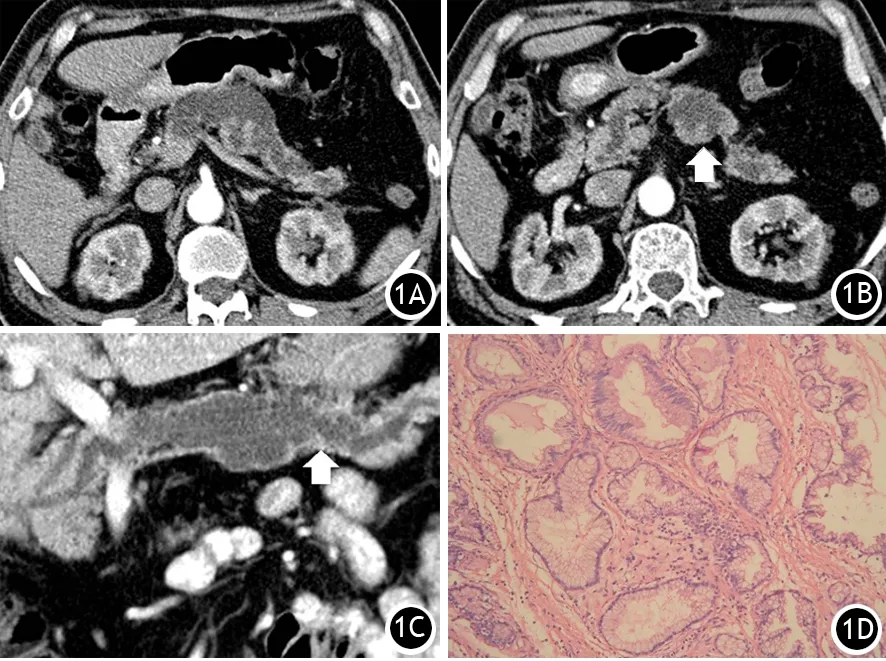
图1 主胰管型IPMN。CT横断位增强显示主胰管局限性扩张,直径>10 mm(1A),主胰管壁结节及乳头状突起(箭头,1B);MSCT曲面重建图像显示胰腺局限性扩张,伴壁结节(箭头,1C);病理显示肿瘤性腺管浸润胰腺间质(HE ×50,1D)
50例IPMN中MSCT图像发现18例分隔厚度≥2 mm,32例无分隔或分隔厚度<2 mm,分隔厚度≥2 mm诊断恶性IPMN的敏感性、特异性、准确性分别为48.6%(17/35)、93.3%(14/15)、62.0%(31/50);MRCP图像发现19例分隔厚度≥2 mm,31例无分隔或分隔厚度<2 mm,其敏感性、特异性、准确性分别为51.4%(18/35)、93.3%(14/15)、64.0%(32/50)。
50例IPMN中MSCT和MRCP图像均发现8例有周围血管侵犯,7例有周围淋巴结肿大,2例出现肝脏转移灶,病理均证实为恶性。MSCT图像显示6例IPMN内有钙化,其中5例病理证实为恶性。MRCP图像均未发现钙化灶。
MSCT联合2D曲面重建图像和MRCP图像上的主胰管扩张≥10 mm、壁结节、分隔厚度≥2 mm、钙化、血管侵犯、胰周淋巴结肿大和转移灶等征象鉴别诊断恶性IPMN的ROC曲线见图2。MSCT联合2D曲面重建图像中主胰管直径≥10 mm、壁结节、分隔厚度≥10 mm的AUC分别为0.973(P=0.000)、0.825(P=0.002)、0.704(P=0.051),其中主胰管直径≥10 mm、壁结节具有统计学意义;MRCP图像上主胰管直径≥10 mm、壁结节、分隔厚度≥2 mm的AUC分别为0.976(P=0.000)、0.825(P=0.002)、0.722(P=0.034),均有统计学意义。
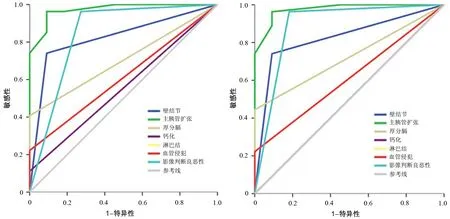
图2 MSCT联合2D曲面重建图像(2A)、MRCP图像(2B)上影像征象的ROC曲线
四、MSCT与MRCP鉴别诊断IPMN良恶性的价值
50例IPMN中病理诊断15例为良性,35例为恶性。MSCT诊断37例为恶性,其中4例病理诊断为良性;13例为良性,其中2例误诊为恶性;总敏感性、特异性和准确性分别为94.3%(33/35)、73.3%(11/15)和88.0%(44/50)。MRCP诊断36例为恶性,其中3例病理诊断为良性;14例为良性,其中2例误诊为恶性;总敏感性、特异性和准确性分别为94.3%(33/35)、80.0%(12/15)和90.0%(45/50)。
讨 论
IPMN主要发生于50岁以上的老年人,多数患者起病隐匿,可无明显的临床症状,主要表现为反复发作的上腹部疼痛,其他临床表现包括血糖升高、脂肪泻、消瘦、黄疸等[3]。本研究50例IPMN患者临床症状相对较明显,其中26例因急性胰腺炎或急性复发性胰腺炎而发现,与Jang等[4]报道相符。主胰管型和混合胰管型IPMN较分支胰管型IPMN更容易发生急性胰腺炎或急性复发性胰腺炎,大多数为轻症,病理学上一般为良性[4]。部分患者临床表现类似于胰腺导管腺癌,如出现顽固性腹痛、体重减轻、进行性黄疸、尿黄等症状,则提示恶性可能[3]。
本组主胰管型及混合胰管型IPMN的影像学表现为主胰管局限性或弥漫性扩张,病灶内可出现结节状、乳头状突起,可出现病灶内分隔,增强扫描可见到结节或乳头状突起及分隔强化等,与Correa-Gallego等[5]总结的影像学特点相似。Tanaka等[6]报道的2012年指南指出,当分支胰管型IPMN囊性病灶≥30 mm时为“令人担忧的特征”,表明其存在恶性潜能,需要密切随访。本组分支胰管型IPMN囊性病灶≥30 mm与病灶恶变虽无显著的相关性,但也存在恶性病变,需要引起重视。当然,良恶性的鉴别需要与病灶大小、导管扩张程度及是否出现胰腺炎、壁结节等多因素综合考虑决定。
本研究主要对主胰管扩张直径≥10 mm、壁结节、分隔厚度≥2 mm、钙化、周围血管侵犯、胰周淋巴结肿大和转移灶等恶性征象进行分析,结果显示,MSCT及MRCP以主胰管直径≥10 mm为标准鉴别IPMN良恶性的敏感性、特异性、准确性均较高,基本在90% 以上;以壁结节鉴别诊断的敏感性、特异性、准确性也较高,均在75%以上;以分隔厚度≥2 mm鉴别良恶性的敏感性较低,但特异性达到93.3%,与Roch等[7]、边云等[ 8]的研究结果类似。
本组MSCT检查发现6例(12%)病灶内有钙化灶,其中5例病理证实为恶性。钙化可能是由于钙盐沉积于黏蛋白中,往往提示病灶的时间较长,虽然不能证实钙化一定与恶变有关,但粗钙化伴有一定的形态学特征时可能是一个提示性的恶性征象[9]。另外,当患者出现周围血管侵犯、周围淋巴结肿大及肝脏转移时往往提示恶性。本组8例有周围血管侵犯,7例有周围淋巴结肿大(长径>10 mm),2例出现肝脏转移灶,均能在MSCT和MRCP图像上发现,病理证实均为恶性,与边云等[9]报道一致。
通过ROC曲线分析,MSCT和MRCP显示主胰管扩张≥10 mm、壁结节征象均有鉴别诊断意义,而分隔厚度≥2 mm仅在MRCP有鉴别诊断意义,这可能和MRCP对分隔厚度更敏感有关,与Shin等[10]的研究结果一致。
虽然MRCP是目前公认的IPMN最佳检查方法[2,10]。但它也有一定的局限性。MRCP的空间分辨率不如MSCT。大多数IPMN患者是老年人,MRCP检查配合较差。MSCT扫描通过简单的屏气便可以满足胰腺图像的要求,且较MRCP图像层厚更薄、更少的部分容积效应和更少的呼吸运动伪影,通过2D曲面重建图像和血管重建图像能较好地显示病灶本身、周围组织、周围血管和胆管情况。基于上述特点,笔者认为尽管MSCT并非IPMN的最佳检查方法,且有一定的射线伤害,但其可以作为缺乏磁共振设备的基层医院诊断IPMN的首选检查方法。
[1] Pomianowska E, Gladhaug IP, Grzyb K, et al. Survival following resection of pancreatic endocrine tumors: importance of R-status and the WHO and TNM classification systems[J]. Scand J Gastroenterol, 2010, 45(7-8): 971-979. DOI: 10.3109/00365521003782363.
[2] 《中华胰腺病杂志》编辑委员会. 我国胰腺囊性肿瘤共识意见(草案2013,上海)[J]. 中华胰腺病杂志, 2013, 2(13):79-90. DOI: 10.3760/cma.j.issn.1674-1935.2013.02.002.
[3] Moriya T, Hashimoto Y, Traverso LW. The duration of symptoms predicts the presence of malignancy in 210 resected cases of pancreatic intraductal papillary mucinous neoplasms[J]. J Gastrointest Surg, 2011, 15(5): 762-770. DOI: 10.1007/s11605-011-1437-6.
[4] Jang JW, Kim MH, Jeong SU, et al. Clinical characteristics of intraductal papillary mucinous neoplasm manifesting as acute pancreatitis or acute recurrent pancreatitis[J]. J Gastroenterol Hepatol, 2013, 28(4): 731-738. DOI: 10.1111/jgh.12121.
[5] Correa-Gallego C, Do R, Lafemina J, et al. Predicting dysplasia and invasive carcinoma in intraductal papillary mucinous neoplasms of the pancreas: development of a preoperative nomogram[J]. Ann Surg Oncol, 2013, 20(13): 4348-4355. DOI: 10.1245/s10434-013-3207-z.
[6] Tanaka M, Fernandez-Del Castillo C, Adsay V, et al. International consensus guidelines 2012 for the management of IPMN and MCN of the pancreas[J]. Pancreatology, 2012, 12(3): 183-197. DOI: 10.1016/j.pan.2012.04.004.
[7] Roch AM, Dewitt JM, Al-Haddad MA, et al. Nonoperative management of main pancreatic duct-involved intraductal papillary mucinous neoplasm might be indicated in select patients[J]. J Am Coll Surg, 2014, 219(1): 122-129. DOI: 10.1016/j.jamcollsurg.2014.03.021.
[8] 边云,李骁,陈炜,等. CT和MRI对主胰管型胰腺导管内乳头状黏液瘤良恶性鉴别的价值[J]. 中华胰腺病杂志, 2015, 15(3):182-186. DOI: 10.3760/cma.j.issn.1674-1935.2015.03.010.
[9] Perez-Johnston R, Narin O, Mino-Kenudson M, et al. Frequency and significance of calcification in IPMN[J]. Pancreatology, 2013, 13(1): 43-47. DOI: 10.1016/j.pan.2012.11.306.
[10] Shin SS, Armao DM, Shah M, et al. Management of branch-duct intraductal papillary mucinous neoplasms of the pancreas: observation with MR imaging[J]. Magn Reson Imaging, 2010, 28(10): 1440-1446. DOI: 10.1016/j.mri.2010.06.026.

