长链非编码 RNA UCA1对微卫星不稳定的人类结肠癌细胞侵袭和迁移能力的影响
徐晋珩 刘丽云 鄢丽敏 张志勇 夏庆安 王正晖
(唐山市工人医院病理科,河北 唐山 063000)
目前人类结肠癌的患病率日益增长的趋势已得到广泛共识,并且研究表明它在肿瘤世界范围内的排行为第三位〔1〕,据我国学者统计,在国内发病率较高的前五类肿瘤,其中就有结直肠癌〔2〕。随着人类对自身机体是否处于良好状态的要求有所提高,因此对于肿瘤的剖析也需要提高到一定层次。长链非编码RNA(lncRNA)的特点是:长度由200个以上的核苷酸组成〔3〕,并且它的开放式阅读框是不完整且没有特异性的,是一种极少有蛋白编码功能的非编码RNA〔4〕。有学者提出〔5〕,lncRNA的异常表达在肿瘤发生及癌症相关性方面能够诱导或加速其病理改变病情进展。近年更有研究表明lncRNA在基因表达过程中是关键调控分子,相关靶基因的表达调控在表观遗传、转录及转录后等多种水平有重要体现。结肠癌的研究进展中,一些文献报道了有关不同类型的lncRNA表达异常时发挥的作用,如促进癌细胞的增殖〔6~8〕、迁移〔9,10〕和侵袭能力〔11,12〕,抑制癌细胞凋亡及在细胞周期方面的影响力〔13〕。随着人类对肿瘤学的认知不断深入,lncRNA的种类被更多的发现,有学者得出在一些肿瘤类型中,差异性表达存在于肿瘤组织与其相邻的正常组织间的结论〔14〕。lncRNA尿路上皮癌胚抗原(UCA)1在多种肿瘤的发生发展过程中有一定的作用,表明它有一定的致癌作用,对结直肠癌而言说明了UCA1对其细胞周期的作用为负调节,与细胞凋亡呈负相关〔15,16〕。基于近几年的研究,有报道称发现了与结肠癌发病有密切关联的因素,这个重要角色的扮演者就是微卫星不稳定性,研究还表明结肠癌患者发病起到关键作用的正是微卫星不稳定的癌细胞〔17~19〕。本研究旨在检测lncRNA UCA1在微卫星不稳定的结肠癌细胞中的水平,进而分析其对结肠癌细胞迁移和侵袭能力的影响。
1 材料与方法
1.1时间及地点 实验于2015年12月至2016年5月在河北医科大学实验室完成。
1.2主要材料及来源 人结肠癌细胞LoVo系、正常结肠细胞HUM-CELL-0033(均由河北医科大学细胞研究中心提供)10%胎牛血清(上海卡奴生物科技有限公司)、磷酸盐缓冲液(PBS)、RT-PCR 试剂盒(TaKaRa公司);LipofectamineTM 2000(Invitrogen公司)、siRNA(上海吉玛制药技术有限公司);无血清RPMI1640培养液、Transwell(武汉博士德生物有限公司);兔抗人MSH2与MSH6单克隆抗体(Cell Signaling Technology公司),RIPA裂解液、5×十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)蛋白上样缓冲液及聚氰基丙烯酸正丁酯(BCA)蛋白检测试剂盒(均购自碧云天生物技术公司)、尼龙膜(美国Pall公司)。
1.3方法
1.3.1检测人正常结肠细胞HUM-CELL-0033及微卫星不稳定的人类结肠癌细胞LoVo细胞系中UCA1的水平 细胞的复苏培养:从冰箱中取出储存在冻存管中冻存的HUM-CELL-0033及LoVo细胞,将冻存管放置在37 ℃的水箱中进行水浴,使两种细胞进行快速融化复苏,经过1 min HUM-CELL-0033及LoVo细胞已完全融化,1 min后取出冻存管,向其中加入α-MEM培养基,将其放置在特定条件的培养箱中进行培养,培养条件为37 ℃含有5%CO2,边培养边观察细胞生长情况。PCR检测:细胞经Trizol法获得总RNA,然后经逆转录合成cDNA,应用引物(UCA1的上游引物为5′-GGAGCTGTTGAGCCTTCAGT-3′,下游引物为5′-ATTGAGAGCACAGTGGGGTG-3′)进行PCR扩增,ABI7300检测同时分析各组细胞的UCA1水平。 PCR反应条件:95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。
1.3.2基因转染 转染开始的前1 d,把LoVo接种于6孔板上,这样就会保证待转染细胞在1 d之内混浊度变为30%~50%,然后依据LipofectamineTM 2000的说明书上的步骤开始实验操作,在250 μl的Opti-MEN低血清培养基(无血清)中稀释siRNA,慢慢摇晃至均匀,然后同样将LipofectamineTM 2000在另外的250 μl Opti-MEN培养基中轻摇至匀,待双方都静置(室温)5 min后混合在一起(注意:要在30 min内混合LipofectamineTM 2000和siRNA的稀释液),摇匀,再次静置20 min,接着下一步将混合物滴入到6孔板内,轻摇,使混合物与孔内的液体尽可能混匀。然后将其放入培养箱内,室温,5%CO2,待培养2~3 d后,接着进行转染之后的实验。siRNA的序列为:UCA1-siRNA正义链5′-GAGCCGAUCAGACAAACAATT-3′,反义链5′-UUGUUUGUCUGAUCGGCUCTT-3′;UCA1-siRNA2;阴性对照正义链5′-UUCUCCGAACGUGUCACGUTT3′,反义链5′-ACGUGACACGUUCGGAGAATT-3′。参照物GAPDH引物序列上游:5′-TCCTCTGACTTCAACAGCGACAC-3′;下游5′-TCTCTCTTCCTCTTGTGCTCTTGC-3′。实验分组:对照组、空载质粒组、转染UCA1 siRNA组
1.3.3Transwell小室检测下调表达UCA1对细胞侵袭能力的影响 将以上转染完成2 d之后的每个小组,应用Transwell侵袭实验试剂盒分析UCA1对细胞侵袭力的变更,每个组分别设立3个复孔。采用胰酶分别消化每个组,然后PBS洗涤1~2次,接着调整细胞的密度(重悬),在6孔板中按照每孔以1×105个把各组细胞置于Transwell上层的小室中,将无血清RPMI1640培养液(其内含基质凝胶)滴入小室内,然后再将适量培养基(含10%胎牛血清)滴入到底层小室其内。培养箱的温度为37℃,CO2浓度为5%,培育1 d。待培育结束时,弃掉孔内的液体,同时PBS冲洗拿出来的小室,用棉棒小心的拂拭没有迁移的细胞,然后以多聚甲醛固定0.5 h,并用0.04%结晶紫与之染色,倒置显微镜下记录穿膜细胞的数目,每个实验组任意抓拍8个视野,记录其平均数值。此实验重复3次。
1.3.4划痕实验观察下调表达UCA1对细胞迁移能力的影响 将所用器械进行灭菌。先选取Marker笔在6孔板后标注平行线(间距约1 cm),横孔穿过且每孔至少穿过5条平行线。将Lovo细胞置于孔中,每孔约5×105个,过夜。等到细胞密度约为50%时,依据上面的分组进行转染,转染到4~5 h时,换液,然后继续进行,直到2 d后细胞基本布满时,将移液枪头依着直尺,做到枪头尽可能与6孔板反面的横线垂直划痕,千万不可以划歪。然后将细胞用PBS洗涤3次,弃除划掉的细胞,更换培养基(不含有血清)。然后将其放进孵育箱(37℃,5%CO2),培养。将划痕处起始点标为时间0点,依照每6 h取样,光学显微镜下拍照,然后测定划痕距离。
1.3.5Western印迹检测DNA错配修复蛋白MSH2与MSH6的变化 将各组细胞待其被胰酶消化后收集放置,然后将RIPA试剂(含有蛋白酶抑制剂)用于裂解收集好的细胞,并将其搁置在冰块上裂解0.5 h,同时每隔10 min震荡摇晃细胞1次。然后放进离心机上,离心15 min(14 000 r/min,4℃)。用吸管将上清液吸出,通过使用BCA检测法检测此蛋白的浓度,使其水浴变性之后,将5倍SDS-PAGE蛋白上样缓冲液滴入其中,然后把蛋白裂解液(即含有相同量的蛋白)通过用PAGE分离,电改变至聚偏二氟乙烯(PVDF)膜上,下一步使用PBS缓冲液(内含5%脱脂牛乳)摇床密封60 min(37℃),实验所使用的一抗:MSH2抗体,MSH6抗体(都为稀释的1∶1 000的抗人抗体,且都是单克隆抗体),过夜培育(4℃),完毕后用PBS-Tween洗膜15 min(37℃),洗3次;而二抗使用抗兔〔辣根过氧化物酶(HRP)标记,1∶5 000)〕,同样的培育(60 min,37℃)洗膜(3次,15 min)。最后用加强型化学发光液辨析其显影。
1.4统计学方法 采用SPSS17.0 软件进行t检验。
2 结 果
2.1LoVo细胞系中UCA1的水平 在微卫星不稳定的结肠癌细胞LoVo系中UCA1的表达量(1.29±0.11),相比较正常结肠细胞HUM-CELL-0033明显为高水平(0.84±0.10,P<0.05),表明UCA1在结肠癌细胞呈现异常表达,即微卫星不稳定的人类结肠癌细胞LoVo中UCA1的程度显著大于人普通结肠细胞HUM-CELL-0033中的相对表达的量。
2.2下调表达UCA1后细胞的侵袭能力 转染UCA1siRNA组〔(20.63±2.79)个/高倍镜视野〕比对照组细胞的穿膜数明显减少〔(43.23±4.76)个/高倍镜视野,P<0.05〕,空载质粒组穿膜细胞数〔(41.98±4.43)个/高倍镜视野〕与对照组无差异(P>0.05)。见图1。

图1 下调表达UCA1后细胞侵袭能力的比较(×200)
2.3下调表达UCA1后细胞的迁移能力 划痕愈合百分比:对照组为(73.68±7.32)%、空载质粒组为(74.54±6.34)%、转染UCA1siRNA组为(24.78±3.56)%。转染UCA1siRNA后细胞划痕两侧的间距较对照组明显增大,划痕的愈合速度有所减慢,表示细胞的迁移能力减弱,见图2。
2.4MSH2与MSH6蛋白表达 转染UCA1siRNA组中MSH2与MSH6的蛋白所显现出的表达量明显少于对照组,说明下调表达UCA1可明显降低细胞中MSH2与MSH6的表达,见表1、图3。

图2 下调表达UCA1后细胞的迁移能力(×200)
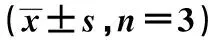
表1 MSH2与MSH6蛋白表达
与对照组比较:1)P<0.05

图3 MSH2与MSH6蛋白电泳表达
3 讨 论
lncRNA是被定义为在真核基因转录后〔20~22〕,能够产生多种缺少蛋白编码能力的RNA,近年来lncRNA在多个系统的肿瘤都发现有异常表达〔23〕。虽然近些年来人们对lncRNA越来越关注,尤其是在肿瘤领域〔24〕的研究进展也有不少突破,但是具体的作用机制仍然需要深层剖析〔25〕。人们通过实验及生物信息学分析证实UCA1属于lncRNA,且发现并不在人正常组织中进行表达〔26〕。关于UCA1的表达也已经被证实异常存在于肾癌、黑色素瘤〔27〕及口腔癌〔28〕和膀胱癌〔29〕等多种肿瘤组织中。lncRNA UCA1与一些消化系统肿瘤间的相关性经过不断的实验研究,有关报道接踵而出。如于食管鳞状细胞癌〔30〕而言,过表达的UCA1被证实能造成其预后不良。在胰腺癌的研究中也有学者〔31〕指出,若调高UCA1可使胰腺癌细胞系的PANC-1细胞的迁移和侵袭能力增强。还有肝癌〔32〕和胃癌〔33〕UCA1的作用机制正在逐步被人们钻研。
当今社会人们生活条件日益变好,而因对饮食结构的不重视造成因结肠癌死亡人数的逐年增多〔34~36〕,对于结肠癌的治疗也比较局限,随着基因研究的不断强大,探讨基因与癌症之间的关联也是现代学者的重任。本研究显示在结肠癌细胞中UCA1水平确实存在异常,且出现水平较高状态,结肠癌细胞侵袭、迁移能力在下调UCA1后有所减弱。文献〔37〕中提到,这两种能力对于患者而言,在造成死亡人数数量巨大化方面,其影响程度毋庸置疑。由于有研究证实结肠癌的预后和临床病理与DNA错配修复相关联〔38,39〕,即为当DNA在复制时出现了基因的配对错误,然后通过一些蛋白进行修复〔40〕。本文提示UCA1下调后,DNA错配修复蛋白MSH2与MSH6数量也明显减少。
本文通过实验检测到在微卫星不稳定的结肠癌细胞中lncRNA UCA1出现高水平状态,验证了其对癌细胞侵袭和迁移能力的影响,这种影响还可能与DNA错配修复蛋白MSH2、MSH6有关。

