MI-219和阿霉素联合处理对卵巢癌耐药细胞A2780/ADM增殖的抑制作用
汪 静 黄利红
(华中科技大学同济医学院附属普爱医院妇产科,湖北 武汉 430014)
p53是哺乳动物细胞内重要的转录调控因子,同时也是研究最广泛的抑癌基因,p53在致DNA损伤因子、氧化应激、热休克、紫外照射等压力刺激下被激活,进而启动细胞DNA损伤修复、诱导细胞周期阻滞和细胞凋亡以维持胞内遗传信息的稳定性〔1〕。研究发现,在约50%的人类癌症细胞中,p53基因发生变异,造成p53失活〔2〕。在另外近50%的癌症细胞中,p53基因并没有发生变异,但活性则被其下游靶基因MDM2的负反馈作用而被抑制,使细胞因无法修复受损基因而进入恶性分裂、诱变癌症〔3〕。研究证实,MDM2基因的过表达与肺癌、卵巢癌、膀胱癌及肝癌等恶性肿瘤的发生与发展密切相关〔4〕。针对MDM2在N端的p53结合域的分子抑制剂的研发是近年来肿瘤药物开发的热门〔5〕。MI-219是一种高效MDM2抑制剂,可以有效阻断MDM2对p53的降解作用,激活细胞内野生型p53的活性,诱导细胞周期阻滞和细胞凋亡,临床前研究表明其在动物体内可以作为癌症治疗的候选药物〔6〕。因此,研究MI-219发挥作用的详细分子机制有利于对其进一步开发和利用。卵巢癌是女性最常见的恶性肿瘤之一,在女性患者中,其发病率仅次于子宫内膜癌,在全球范围内每年以2%的速度递增。现阶段卵巢癌的治疗仍以手术为主,配合化疗,但是化疗疗效则一直受制于耐药和化疗药物副作用。因此,探索新的治疗靶点并开发高效、靶向、低毒的优化方案是现阶段卵巢癌治疗的首选举措。本研究拟探讨MI-219与常用化疗药物阿霉素(ADM)联用对人卵巢癌耐阿霉素细胞株A2780/ADM增殖及凋亡的影响。
1 材料与方法
1.1主要试剂 胎牛血清、DMEM培养基均为Hyclone公司产品。ADM(注射用盐酸多柔比星)为山西普德药业股份有限公司产品(国药准字:H14023143)。MI-219为美国Selleck公司产品(目录号:S8059)。四甲基氮唑盐(MTT)购自美国Sigma-Aldrich公司。二喹啉甲酸(BCA)蛋白定量试剂盒、RIPA裂解液和酶联免疫吸附试验(ELISA)试剂盒由武汉博士德生物工程有限公司提供,凋亡检测试剂盒为杭州联科生物技术有限公司产品。胞质蛋白分离试剂盒碧云天生物技术研究所提供。兔抗人MDM2、phospho-p53、XIAP、Caspase3、Caspase9及鼠抗人β-actin一抗,羊抗兔、羊抗鼠二抗均购自南京巴傲德生物科技有限公司。其他常用化学试剂均为国产分析纯。
1.2方法
1.2.1细胞培养 人卵巢癌耐ADM细胞株A2780/ADM购自美国ATCC细胞库,常规培养于含10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的RPMI1640培养液中,在37℃,体积分数为5%的CO2饱和湿度培养箱中。
1.2.2MTT试验 取对数生长期的耐药细胞A2780/ADM,以0.25%胰蛋白酶消化制备成单细胞悬液(2×105),接种于96孔细胞培养板中。首先筛选MI-219无毒/低毒浓度范围,以倍比稀释的方法由高到低分别加入5.000 μmol/L、2.500 μmol/L、1.250 μmol/L和0.625 μmol/L浓度的MI-219,对照组不加药物只加培养基,每组设6个复孔,药物作用24 h后,弃上清,每孔加入100 μl MTT 溶液(终浓度为0.05 mg/ml),继续培养4 h,小心吸去各孔内液体,每孔加入150 μl 二甲基亚砜(DMSO),于Synergy 2 型多功能酶标仪读取吸光度值(A570)。细胞活性(%)=〔处理组OD值/空白组OD值〕×100。计算出无毒、低毒浓度MI-219后,再次制备成A2780/ADM细胞悬液,接种于96孔细胞培养板,细胞随机分为4组:①对照组(不加任何处理);②ADM组(0.625 mg/L ADM);③ADM+0.625 μmol/L MI-219组;④ADM+1.250 μmol/L MI-219组。处理步骤同上。
1.2.3流式细胞术分析细胞凋亡 选处于对数生长期的A2780/ADM细胞制备单细胞悬液,并计数,在加药前1 d,以每孔2.0×106个细胞接种于6孔培养板中。按细胞1.2.2方法经ADM或ADM+MI-219处理24 h后,PBS洗涤2次,0.25%胰蛋白酶消化,3 000 r/min离心5 min收集细胞,用PBS轻轻重悬细胞并计数,取5.0×105个重悬的细胞,3 000 r/min离心5 min,弃上清,按说明书要求加入500 μl 上样缓冲液轻轻混匀;后加入5 μl Annexin V-FITC和10 μl PI溶液混匀,室温避光作用15~20 min,于流式细胞仪上检测细胞凋亡率。Cellquest软件分析检测结果。
1.2.4Western印迹检测 加药前1 d选对数生长期的A2780/ADM细胞制备单细胞悬液,以每瓶5.0×106个细胞接种于25 cm2细胞培养瓶中。按1.2.2方法分组及处理24 h后,预冷PBS洗涤2次,胰酶消化,离心收集细胞。RIPA裂解液处理细胞,提取上清液,BCA蛋白定量试剂盒测量蛋白浓度。取等量蛋白样品(每孔30 μg)与蛋白上样缓冲液按4∶1比例混匀,95℃水浴变性10 min。经12% SDS-聚丙烯酰胺凝胶中电泳2.5 h,半干转膜仪转移至0.45 μmol/L PVDF膜,后经5%脱脂奶粉封闭1 h。经一抗、二抗孵育后,加入电化学发光(ECL)超敏发光液显色,采用多功能凝胶成像分析仪检测蛋白表达水平,以β-actin作为等量蛋白上样对照,通过Genetool凝胶图像分析软件对各组蛋白条带的密度值进行比较分析。
1.2.5ELISA试验分析胞质Cytochrome C水平 加药前1 d选对数生长期的A2780/ADM细胞制备单细胞悬液,以每瓶5.0×106个细胞接种于25 cm2细胞培养瓶中。经1.2.2方法分组及处理24 h后,参照胞质蛋白分离试剂盒说明书分离各组胞质蛋白,BCA蛋白定量试剂盒测量蛋白浓度。取10 μg胞质蛋白稀释至100 μl加入进ELISA试剂盒的样本孔中,按说明书要求,经洗板、加抗体、洗板、加酶、洗板、显色、终止,最后于Synergy 2 型多功能酶标仪读取吸光度值(A450)。
1.3统计学处理 采用SPSS19.0软件进行方差齐性检验和t检验。
2 结 果
2.1细胞活力检测结果 A2780/ADM细胞经0.625、1.250、2.500及5.000 μmol/L MI-219处理24 h后,各处理组A2780/ADM细胞增殖率呈剂量依赖性降低,分别为:97%、86%、72%和61%,其中5.000 μmol/L、2.500 μmol/L、1.250 μmol/L处理组与对照组(100%)相比有统计学差异(P<0.05)。确定0.625 μmol/L MI-219为非细胞毒性剂量(生存率>95%)、1.250 μmol/L MI-219为低细胞毒性剂量(生存率>85%)。MI-219和ADM联合处理对A2780/ADM细胞增殖率影响结果显示:无论ADM单独处理或与MI-219联合处理均可显著降低A2780/ADM细胞增殖率(P<0.05);ADM组细胞增殖率为87%;0.625 mg/L ADM+0.625 μmol/L MI-219组,A2780/ADM细胞增殖率为76%;ADM+1.250 μmol/L MI-219组细胞增殖率为61%;联合处理组细胞增殖率均显著低于ADM组(P<0.05)。
2.2细胞凋亡检测结果 ADM组细胞凋亡率为14%;ADM+0.625 μmol/L MI-219组细胞凋亡率为26%;当0.625 mg/L ADM与1.250 μmol/L MI-219共同处理时,A2780/ADM细胞凋亡率为41%;联合处理组细胞凋亡率均显著高于ADM组(P<0.01)。
2.3Western印迹结果 在ADM组、ADM+0.625 μmol/L MI-219组、ADM+1.250 μmol/L MI-219组中,MDM2和XIAP蛋白表达逐渐减少,在ADM+1.250 μmol/L MI-219组中表达最低,且以上蛋白在联合处理组中的表达也明显低于ADM组;而活化型p53、Caspase3、Caspase9表达在ADM组、ADM+0.625 μmol/L MI-219组、ADM+1.250 μmol/L MI-219组中则明显增加,在ADM+1.250 μmol/L MI-219组中表达量最高,且以上蛋白在联合处理组中的表达也明显高于ADM组。见图1,表1。所有组中β-actin表达水平无变化,说明实验结果可信。
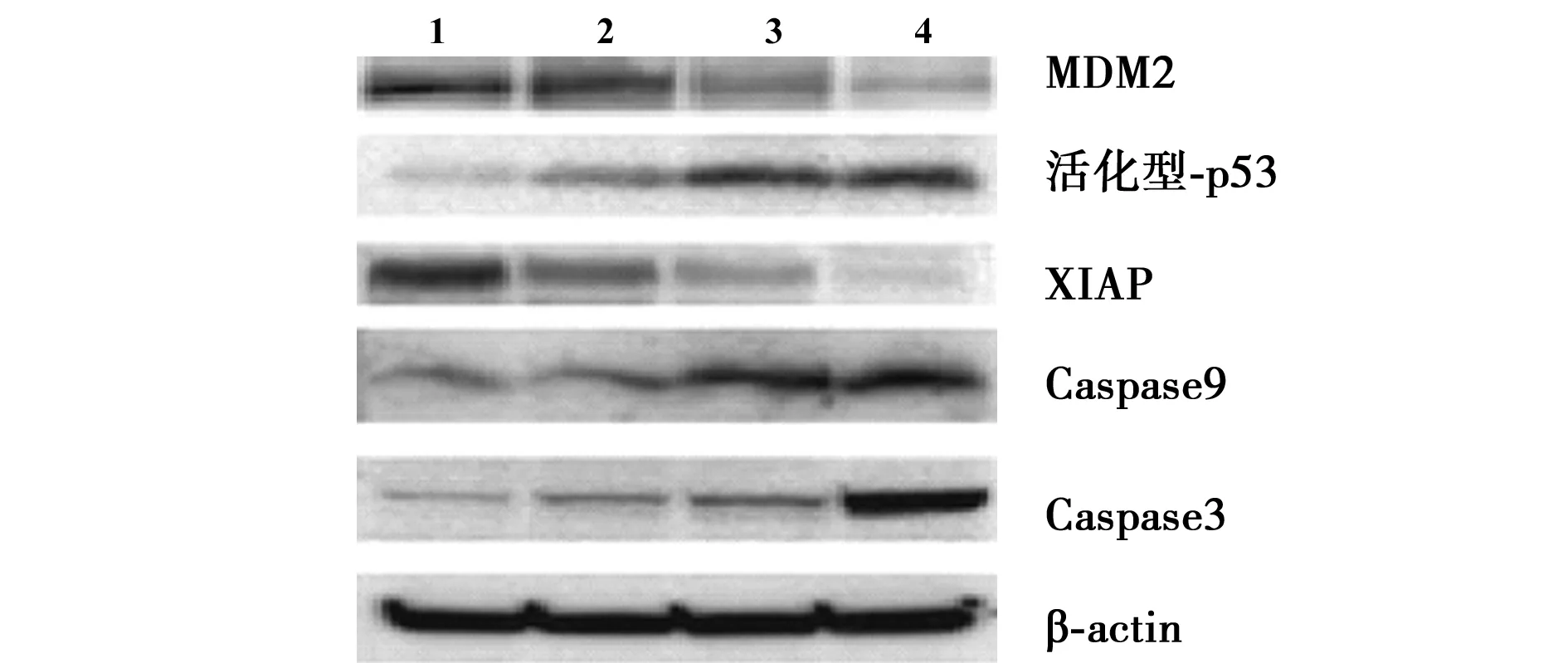
1~4:空白组、ADM组、ADM+0.625 μmol/L MI-219组及ADM+1.250 μmol/L MI-219组图1 Western 印迹检测各组细胞MDM2、XIAP、活化型p53、Caspase3和Caspase9表达
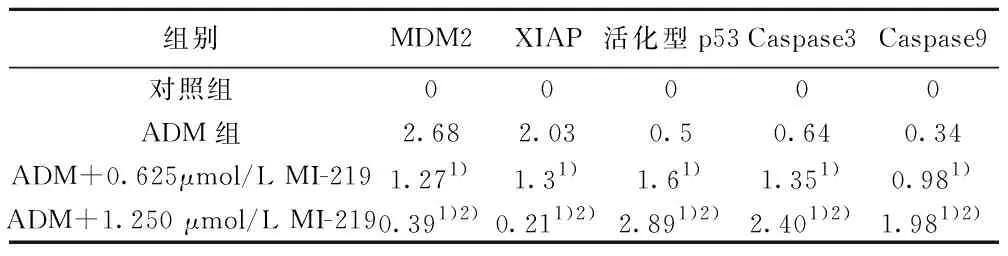
表1 各组Western印迹检测各蛋白表达水平均数比较(n=3)
与ADM组比较:1)P<0.05;与其他组比较:2)P<0.05
2.4ELISA分析胞质Cytochrome C水平 ADM单独处理或与MI-219联合处理均可显著增加胞质Cytochrome C水平,ADM组吸光值约为1.29;ADM+0.625 μmol/L MI-219组吸光值约为1.90;当ADM+1.25 μmol/L MI-219组吸光值约为2.80;联合处理组吸光值均显著高于ADM,与空白组(吸光值约为0.47)(均P<0.01)。
3 讨 论
MDM2作为p53的靶基因可以通过两种机制调节p53,首先,通过其N端p53 结合域与p53 转录激活结构域结合阻碍后者发挥转录激活作用,其次,MDM2作为E3泛素化酶,可以介导p53的泛素化降解及其核移位过程〔7~9〕。同时,MDM2还可以在蛋白质翻译水平上调XIAP,而后者则通过下调Caspase3和Caspase9的活性来抑制细胞凋亡〔10,11〕。无论是p53活性被抑制还是XIAP过表达均可导致细胞进入恶性分裂而诱变癌症。因此,MDM2小分子抑制剂的研发是抗癌药物设计的热门靶点之一。本研究提示MI-219是有效的抗肿瘤化合物。当非细胞毒性剂量的MI-219与ADM联合作用时可显著增加后者的增殖抑制作用,低细胞毒性剂量的MI-219与ADM联合作用时对细胞增殖的抑制作用更为明显。两种剂量的MI-219与ADM联用时可明显抑制MDM2和XIAP蛋白表达,而活化型p53、Caspase3和Caspase9表达量及Cytochrome C水平则明显升高。因为Cytochrome C的释放是线粒体依赖性细胞凋亡的关键事件,因此,提示MI-219通过抑制MDM2的活性进而促进野生型p53的活化及凋亡抑制因子XIAP的下调,增强了卵巢癌耐药细胞株A2780/ADM对ADM的敏感性。

