重度宫腔粘连电切术后羊膜移植羊膜放置方式临床研究*
吴本媛,王 佳(重庆医科大学附属大学城医院妇产科,重庆401331)
宫腔粘连又称为Asherman综合征,是指因子宫内膜基底层损伤、宫腔内壁粘连、纤维瘢痕形成导致的一系列以经量减少、闭经、不孕为主要表现的临床综合征[1],严重影响女性生殖健康。针对轻度宫腔粘连患者,因其粘连部位局限,可采取期待治疗、超声引导扩宫、人工周期等保守治疗方式[2],而针对中、重度宫腔粘连患者,其内膜严重损伤甚至完全缺失,宫腔内大量纤维粘连形成[3⁃4],单纯保守治疗无法恢复正常宫腔形态从而未达到促进子宫内膜修复、恢复生殖功能的目的。宫腔镜凭借其直视性、微创性已成为诊断宫腔病变的“金标准”[5],同时可于直视下尽量保护正常子宫内膜、分离粘连、切断纤维瘢痕,恢复正常宫腔形态。宫内节育器(IUD)、宫腔球囊(Foley′s catheter)、医用粘连冲洗液、防粘连膜等均被应用于术后再粘连预防中[6⁃7],术后因创面渗出、内膜新生、局部感染等因素常导致术后再粘连形成,且术后再粘连率高达62.5%[2]。因此,如何预防宫腔粘连电切术后再粘连形成成为目前治疗宫腔粘连主要研究内容之一。
自DAVIS 1910年首次将羊膜移植应用于眼科中以来,其作为一种生物膜羊膜逐渐在皮肤科、消化外科、神经外科等领域广为应用[8]。这一方法也逐渐应用于宫腔粘连术后预防再粘连治疗中,王欣等[9]、何全中[10]、张玲等[11]证实,较其他方法羊膜移植对预防中重度宫腔粘连电切术后再粘连具有显著优势。电镜下羊膜可分为5层,由内到外依次分为上皮层、基底层、致密层、成纤维细胞层和海绵层,后三者在组织切片上统称为基质层[12]。因其组织形态学差异,作者推测,在羊膜移植中,将羊膜不同层面贴向宫腔其作用效果也将有所差异。本研究以接受宫腔镜下宫腔粘连电切术的重度宫腔粘连患者作为研究对象,采取随机对照研究,对比分析术后行羊膜移植时将羊膜不同层面贴向宫腔对于预防再粘连形成的影响。
1 资料与方法
1.1 资料
1.1.1 一般资料 选取2015年6月至2017年1月就诊于本院并于宫腔镜下诊断为重度宫腔粘连[美国生育协会(AFS)评分大于或等于9分]患者共76例。
1.1.2诊断标准 采用AFS评分,包括粘连累及范围(<1∕3 为 1 分,1∕3~2∕3 为 2 分,>2∕3 为 4 分)、粘连程度(菲薄为1分,菲薄和致密粘连均存在为2分,致密为4分)、月经模式改变(正常为0分,月经量减少为2分,闭经为4分)。计算各项总分诊断:1~4分为轻度粘连,5~8分为中度粘连,9~12分为重度粘连。
1.1.3 纳入及排除标准 (1)纳入标准:①年龄20~≤40岁;②有经量减少、闭经等临床表现;③有生育要求。(2)排除标准:①年龄大于40岁或小于20岁;②合并其他内生殖器疾病,如子宫腺肌症、多囊卵巢综合征,生殖器畸形等;③合并严重内外科疾病,如血栓性疾病、自身免疫性疾病等;④有激素使用禁忌;⑤结核、射线化学药剂所致宫腔粘连;⑥无生育计划。
本研究经过重庆医科大学伦理学会伦理审查同意,同时于 Clinical Trials.gov(NCT02496052)完成伦理注册;所有患者及至少1名直系亲属术前均详细知晓手术内容及风险,同时签署知情同意书。
1.2 方法
1.2.1 实验设计 术前详细记录所有符合标准的46例患者年龄、月经史、婚育史、术前子宫内膜厚度、女性激素水平、宫腔粘连程度,AFS评分等。将46例患者随机分为上皮层组(接受宫腔粘连电切术后将羊膜上皮面贴向宫腔)25例和基质层组(术后将羊膜基底层贴向宫腔)21例。2组患者术后均于宫内同时放置Foley球囊使羊膜充分贴附于子宫腔内。所有患者术后均卧床休息,同时予以静脉预防抗感染治疗3 d,术后第5天拔出宫内球囊。所有患者术后第2天均予以戊酸雌二醇9 mg口服,共计28 d。术后1、3个月,2组患者分别至本院门诊复查妇科超声、宫腔镜检查,同时记录患者月经情况、子宫内膜厚度、宫腔粘连程度、AFS评分、妊娠情况等。
1.2.2 手术设备与手术操作
1.2.2.1 手术器械 奥利巴斯公司a4674a被动式连续灌流宫腔镜,a22001a生理盐水电切镜电切镜,ues⁃40高频电刀,wa22302d电极,膨宫液:生理盐水;超声:西门子公司X300超声仪;Foley球囊:选用16Fr双腔气囊导尿管。
1.2.2.2 术前处理 术前12 h宫颈内放置一次性宫颈扩张棒[鲁食药监械(准)字2014第2660587号(更)],济南晨生医用硅橡胶制品有限公司生产]以软化宫颈。
1.2.2.3 羊膜的制备 羊膜母体选择术前乙型肝炎、丙型肝炎、艾滋病、梅毒均阴性的择期剖宫产孕妇,且孕妇无高血压疾病、妊娠合并肝内胆汁淤积症等产科并发症及合并症,术中羊水清亮。胎盘一经娩出即置于无菌条件下制备新鲜羊膜(fresh amniotic membrane)。将洗净羊膜剪成约25 mm×30 mm大小,7号丝线于羊膜边缘打结区分上皮层与基底层,打结面为上皮面。将羊膜置于含有抗生素(150 mg∕L头孢呋辛酯)的无菌生理盐水中,24 h内使用。
1.2.2.4 手术操作 由同一宫腔镜医生于超声引导下行宫腔粘连电切术,术中记录患者宫腔形态、粘连部位及程度。2组患者术后宫腔内行羊膜移植:上皮层组将上皮层贴附向术后宫腔,基底层组将基底层贴附向术后宫腔;术后宫腔内均放置Foley球囊使羊膜充分贴附于宫腔。
1.2.2.5 术后治疗 所有患者术后第2天均开始给予雌激素治疗,口服戊酸雌二醇3 mg每8小时1次,共28 d,术后静脉抗生素预防抗感染治疗3 d。球囊于术后第5天取出。
1.3 统计学处理 采用SPSS22.0统计软件进行数据分析,计量资料以表示,2组比较用独立样本t检验;计数资料以率表示,2组采用χ2检验,检验水准α=0.05。P<0.05为差异有统计学意义。
2 结 果
2015年6月至2017年1月本院共收治宫腔粘连患者76例,其中符合试验纳入标准患者共60例,28例纳入上皮层组,32例纳入基质层组。随访过程中,共14例退出试验,其中上皮层组3例,基质层组11例。
2.1 2组患者术前一般资料比较 2组患者术前年龄、经期、周期、孕次、产次、人工流产次数、术前子宫内膜厚度比较,差异均无统计学意义(P>0.05),见表1。
表1 2组患者术前一般资料比较(±s)
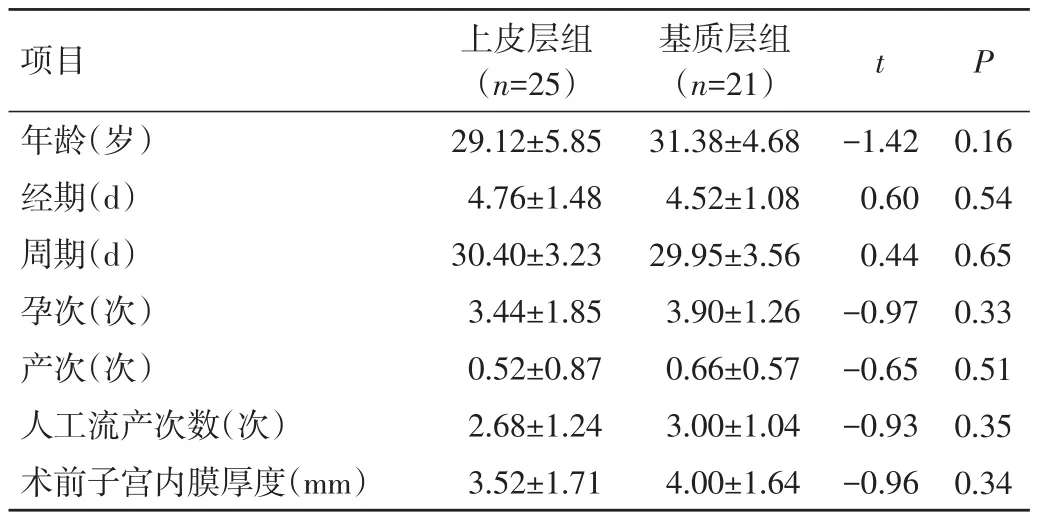
表1 2组患者术前一般资料比较(±s)
项目年龄(岁)经期(d)周期(d)孕次(次)产次(次)人工流产次数(次)术前子宫内膜厚度(mm)上皮层组(n=25)29.12±5.85 4.76±1.48 30.40±3.23 3.44±1.85 0.52±0.87 2.68±1.24 3.52±1.71基质层组(n=21)31.38±4.68 4.52±1.08 29.95±3.56 3.90±1.26 0.66±0.57 3.00±1.04 4.00±1.64 t P-1.42 0.60 0.44-0.97-0.65-0.93-0.96 0.16 0.54 0.65 0.33 0.51 0.35 0.34
2.2 2组患者手术前后宫颈粘连程度比较 2组患者术后月经均得到改善,宫腔粘连程度较术前减轻,术后1、3个月AFS评分均较术前降低,且上皮层组AFS评分低于基质层组,差异均有统计学意义(P<0.05),见表2。
表2 2组患者手术前后AFS评分比较(±s,分)

表2 2组患者手术前后AFS评分比较(±s,分)
注:与同组术前比较,aP<0.05
时间术前术后1个月术后3个月t P 0.39 0.01 0.01上皮层组(n=25)9.90±0.68 2.00±1.47a 0.48±1.12a基质层组(n=21)9.68±0.48 3.62±1.74a 1.85±1.50a 0.85-3.41-3.58
2.3 2组患者手术前后子宫内膜厚度比较 2组患者术后1、3个月子宫内膜厚度均较术前增加,差异均有统计学意义(P<0.05),但组间术后比较,差异无统计学意义(P>0.05),见表 3。
表3 2组患者手术前后子宫内膜厚度比较(±s,mm)

表3 2组患者手术前后子宫内膜厚度比较(±s,mm)
注:与同组术前比较,aP<0.05
时间术前术后1个月术后3个月上皮层组(n=25)3.52±1.71 5.40±1.50a 6.56±1.38a基质层组(n=21)4.00±1.64 5.90±1.40a 6.38±1.24a t P-0.97-1.14 0.46 0.34 0.26 0.65
2.4 随访 随访期间,上皮层组25例患者中共4例成功妊娠,其中1例于孕24周不明原因胎死宫内,2例足月产活产,足月产中1例因胎盘植入发生产后出血,1例尚妊娠中,妊娠率为16.0%;基质层组21例患者中共3例成果妊娠,1例于停经56 d发生稽留流产,2例足月活产,妊娠率为14.2%,2组妊娠率比较,差异无统计学意义(P>0.05)。
3 讨 论
子宫内膜由内到外分为功能层和基底层,在性激素作用下发生周期性增殖、剥脱[13];同时,在雌激素作用下,基底层腺体断端处上皮细胞增生形成新的功能层,覆盖子宫体腔达到修复创面的作用[14]。因此,即使每个月经周期都有子宫内膜的坏死剥脱,子宫前后壁互相紧贴也不会形成粘连[15]。而在重度宫腔粘连患者中,基底层损伤、腺体消失,导致上皮细胞、新生血管形成受阻;同时,在创面修复过程中,成纤维细胞生成增加,细胞外基质(ECM)堆积,导致局部纤维结缔组织增殖,子宫前后壁相互贴附,导致粘连形成[16⁃17]。因此,抑制创面渗出,避免创面互相接触、促进子宫内膜生长修复成为术后预防宫腔再粘连形成的主要手段。
临床上宫内节育器、子宫球囊、医用几丁糖(chito⁃san)等均被用于预防再次粘连的发生。宫腔作为一潜在体腔,宫内节育器因其特殊的环状结构并不能将其完全分隔;同时,其局部压迫可能导致宫腔局部缺血、诱发炎性反应,加重粘连形成[2]。在前期研究中,作者发现,术后予以放置宫内节育器患者随访时行宫腔镜检查可见纤维包绕宫内节育器,甚至导致宫内节育器局部嵌顿[18]。而针对宫内球囊,特别是心型球囊的出现,能够充分分隔子宫内壁,但宫腔粘连电切术后,创面炎性反应,局部纤维蛋白原释放,由于球囊自身不具有抗炎作用,纤维蛋白原在球囊表面沉积,促进阴道上行细菌及其生物膜的增长,有潜在导致宫腔粘连形成危险[19]。
羊膜是到目前为止已知的最厚的生物膜,作为一种生物屏障广泛应用于烧伤、外周神经修复等外科领域。特别是在眼科领域,羊膜移植已成为一种较为成熟的治疗眼表损伤、预防术后粘连形成的常见术式。在一项纳入120例的随机对照研究中,较单独使用宫内球囊,羊膜能够改善月经情况、降低宫腔粘连患者再粘连发生率[20]。本项目前期对照宫腔粘连患者予以羊膜移植及放置医用粘连冲洗液对比,发现羊膜移植对于改善宫腔粘连患者术后月经情况,降低术后粘连再发生率有较好效果。
临床制备羊膜时,其中的成纤维细胞层和海绵层常常被剥离,因此,制备羊膜只含有上皮层、基底层、致密层,后2层统称为基质层,2层具有不同组织结构及生物学功能。在急性眼表损伤中,术者通常将羊膜作为起到支架作用的生物基底膜而将其基质层贴附于创面,从而使临近有功能的角膜或结膜能够迅速上皮化,达到重建眼表结构、预防眼表粘连形成的目的[21]。与眼表角膜、结膜生成修复不同,子宫内膜自身具有周期生长、坏死、剥脱的过程,子宫内膜剥脱后,其底部基底层增生分化,形成新的子宫内膜层,一旦基底层广泛损伤,在基底层可以进一步分化为功能层前,创面细胞外基质渗出堆积,转化生长因子⁃β1(TGF⁃β1)、结缔组织生长因子(CTGF),ECM降解相关的基质金属蛋白酶9(MMP⁃9)和金属蛋白酶组织抑制物⁃1(TIMP⁃1)[7,22]等细胞因子合成与降解失衡导致,从而导致子宫内膜纤维化形成。因此,从宫腔粘连形成及子宫内膜生长修复角度看,羊膜在宫腔粘连中发挥的作用并非完全如同在眼表损伤中一样作为基底层,通过促进上皮细胞爬行生长以达到修复创面的作用。
如前所述,制备羊膜通常分为上皮层和基质层,在眼科应用中,针对病变类型,羊膜有不同放置方式[23],而羊膜移植在宫腔粘连临床应用中,将哪一面贴附向术后宫腔创面目前尚缺乏相关研究。本研究中,较之基底层面,将羊膜上皮面贴附向术后宫腔能够更好地改善术后月经情况,降低宫腔再粘连发生率。根据羊膜不同层面结构特点及宫腔粘连发生机制,作者推测产生差异的原因可能如下。
羊膜上皮层由来源于外胚层的单层柱状上皮组成,具有活跃的分泌功能,同时具有重塑基底膜及细胞外基质的能力[24]。羊膜上皮细胞能够产生MMP,促进细胞外基质降解、抑制纤维化形成[25],其上皮细胞分泌的表皮生长因子(EGF)有促进细胞分裂、增生的作用,作者推测其可能对子宫内膜基底层生长分化为功能层起到一定作用;同时,羊膜上皮细胞还可以表达α1⁃抗胰蛋白酶、α2⁃巨球蛋白酶[12]等,这些生物活性酶可以促进多核白细胞凋亡,有抑制炎性反应的作用。与此相对,羊膜基质层主要由胶原层、网状纤维和基质组成,是维持羊膜形态与强度的重要组成部分,缺乏分泌功能,主要起到的是屏障支持作用。
本研究中,宫腔粘连电切术后行羊膜移植时,将羊膜上皮面贴附于宫腔较将羊膜基质层贴附于宫腔能够更好地降低术后宫腔再粘连发生率,改善术后月经情况。但需要指出的是,本研究所纳入研究对象均为重度宫腔粘连患者,其内膜严重损害,几乎已无正常子宫内膜残存,但对于轻、中度患者,仍有子宫内膜残留,羊膜放置方式是否会产生同样的差异,尚缺乏相关研究。同时,结核、辐射、化学损伤等也会导致宫腔粘连的发生,但因其相对少见,本研究中并未纳入相关病例。本试验初步发现在重度宫腔粘连患者中,将羊膜上皮面贴附于宫腔有利于术后月经情况改善,可减少宫腔再粘连发生,但上述问题的存在仍提示着更深入研究的必要性。

