灯盏乙素对糖尿病肾病大鼠的保护作用*
王 玲,吴秋枫
武汉科技大学附属天佑医院中医科,湖北 武汉 430064
目前,糖尿病发病率居高不下,已经成为继心脑血管疾病和癌症之后的世界第三大疾病[1-2],美国肾脏病基金会发布的数据显示,2007年全世界范围内糖尿病患者约为1.71亿,专家预计未来10年的时间里糖尿病的发病率将由6%激增到10%,严重危害人类健康[3]。糖尿病肾病(diabetic nephropathy,DN)是糖尿病最主要的微血管并发症之一,以胰岛素抵抗(insulin resistance,IR)、微量白蛋白尿、脂代谢紊乱和进行性肾功能丧失为特征,是导致终末期肾病(ESRD)的重要原因[4-6]。氧化应激是引起DN发生及发展的重要因素,其可能单独或作为上述机制的下游环节在糖尿病肾脏损害的发病机制中起关键作用。灯盏乙素(scutellarin,SC)又名黄芩素苷,是从菊科植物灯盏花提取的黄酮类物质,临床常用于治疗高血压、脑血栓、冠状动脉粥样硬化性心脏病等[7-9]。前期研究发现,SC对ROS诱导的非酒精性脂肪肝大鼠过氧化损伤有保护作用,SC能改善肝脏细胞氧化还原能力。本研究探讨SC对DN大鼠的肾功能保护作用,并从核转录因子E2相关因子2(nuclear factor 2 related factor 2,Nrf2)/ 血红素加氧酶 1(heme oxygenase,HO-1)途径探讨 SC 通过减轻机体氧化应激反应从而缓解DN的作用机制。
1 材料与方法
1.1 动物 SPF级SD雄性大鼠50只,体质量180~200 g,由昆明医科大学动物实验动物学部提供,实验动物合格证号:SYXK(滇)2011-0004,饲养环境通风、安静,血糖正常,大鼠自由饮水、进食,温度(23±2)℃,相对湿度(55±2)%。
1.2 药物与试剂 灯盏乙素,纯度98%(HPLC),购自云南植物药业有限公司;高脂饲料配方:基础饲料78.8%、蛋黄粉10%、猪油 10%、胆固醇 1%、胆酸钠0.2%;链尿佐菌素(STZ,美国Sigma公司);葡萄糖、甘油三酯(TG)、总胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C)测定试剂盒均购自南京建成生物工程研究所;胰岛素、丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽(GSH)测定试剂盒(武汉欣博盛生物科技公司);总RNA提取试剂盒(北京天根公司);反转录试剂盒(美国赛默飞公司);引物基因合成(美国上海生工生物公司);荧光PCRmix(瑞士罗氏公司);Nrf2和HO-1抗体(美国Cell Signaling Technology公司);HRP标记的二抗(北京中杉金桥公司);ECL发光试剂盒(美国Millipore公司)。
1.3 方法
1.3.1 D N大鼠模型制备及给药 将SD大鼠50只随机分为正常对照组、模型组,正常对照组给予普通饲料喂养,模型组大鼠给予高脂饲料喂养,4周后对模型组大鼠以STZ溶液(60 mg/kg)腹腔注射造模,72小时后大鼠尾部取血测血糖,血糖大于16.7 mmol/L者为造模成功,未成功者予以剔除。40只造模成功大鼠再随机分为DN模型组及SC低、中、高剂量组各10只,SC低、中、高剂量组大鼠分别予[25 mg/(kg·d)]、[50 mg/(kg·d)]和[100 mg/(kg·d)]SC 灌胃,DN 模型组大鼠予相同体积生理盐水灌胃,连续给药4周。
1.3.2 标本采集 腹腔注射3.6%水合氯醛麻醉大鼠,无菌操作暴露腹腔,使用5 mL注射器心脏迅速取血,静置约1小时后5 000 r/min离心15分钟,获得血清,同时收集肾脏组织-80℃保存备用。
1.3.3 血清各项指标测定 采用全自动生化分析仪检测血清肌酐(Scr)和尿素氮(BUN)含量;采用光谱测定法测定葡萄糖、TG、TC和LDL-C含量;采用ELISA法测定SOD、MDA和GSH含量。
1.3.4 RN A提取及RT-qPCR检测 取约18mg肾脏组织,用总RNA提取试剂盒提取总RNA,定量后每组各取2 μg用于逆转录cDNA,然后以2 μL的cDNA为模板,加入荧光Mix染料进行目的片段扩增。PCR扩增反应条件为:95℃预变性2分钟;95℃变性 10秒、退火:60℃30秒、72℃延伸 35秒,循环40次,72℃延伸5分钟。分别记录每个标本和内参的Ct值(Cycle threshold,即每个反应管内荧光信号到达设定阈值时所经历的循环数)。采用荧光定量PCR相对定量分析2-△△CT法进行统计分析。每组实验至少重复3次。

1.3.5 蛋白提取及蛋白免疫印迹(W est ern Bl ot)检测 取肾脏组织约100 mg剪碎加入RIPA组织裂解液匀浆,BCA法测定总蛋白含量,取各样本50 μg 进行 SDS-PAGE 电泳,110 V 电压,电泳90~120分钟,半干转膜法转移至PVDF膜,5%的脱脂牛奶封闭2小时后一抗,4℃过夜,洗膜后加入相应辣根酶标记的二抗孵育,洗涤后与ECL发光试剂反应,曝光洗片,扫描图像后用Image J软件计算各条带的吸光度值,以GAPDH作为内参进行标准对照。每组实验重复3次。
1.4 统计学方法 采用SPSS 15.0统计软件分析数据,计量资料以(±s)表示,采用单因素方差分析,检验水准为α=0.05。
2 结果
2.1 BU N及Scr变化情况 与正常对照组比较,DN模型组大鼠血清BUN和Scr含量升高(P<0.05);与DN模型组比较,治疗4周后SC各剂量组BUN和Scr含量均下降(P<0.05),且具有剂量依赖性,见表1。
表1 各组大鼠BU N及Scr变化情况(±s)
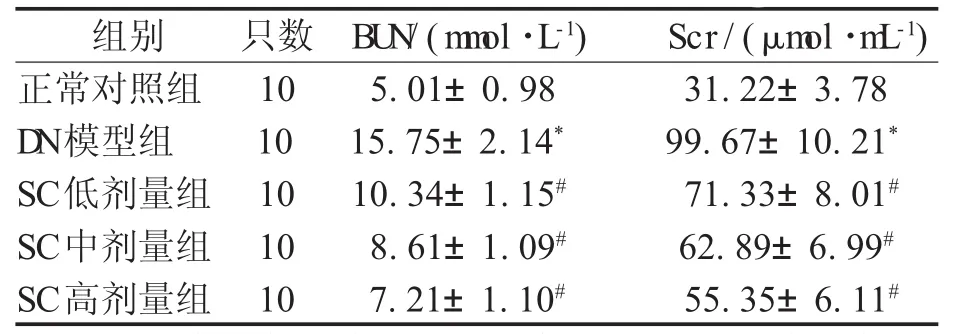
表1 各组大鼠BU N及Scr变化情况(±s)
注:*表示与正常对照组比较,P<0.05;#表示与D N模型组比较,P<0.05
组别 只数 BU N/(m m ol·L-1) Scr/(μm ol·m L-1)正常对照组 10 5.01±0.98 31.22±3.78 D N模型组 10 15.75±2.14* 99.67±10.21*SC低剂量组 10 10.34±1.15# 71.33±8.01#SC中剂量组 10 8.61±1.09# 62.89±6.99#SC高剂量组 10 7.21±1.10# 55.35±6.11#
2.2 葡萄糖、胰岛素及H O M A-IR变化情况 与正常对照组比较,DN模型组大鼠血清中葡萄糖含量、胰岛素含量以及HOMA-IR均升高(P<0.05);与DN模型组比较,SC各剂量组各指标均下降(P<0.05),且SC低、中、高剂量组大鼠肾功能的改善效果依次递增,见表2。
表2 各组大鼠H O M A-IR变化情况(±s)
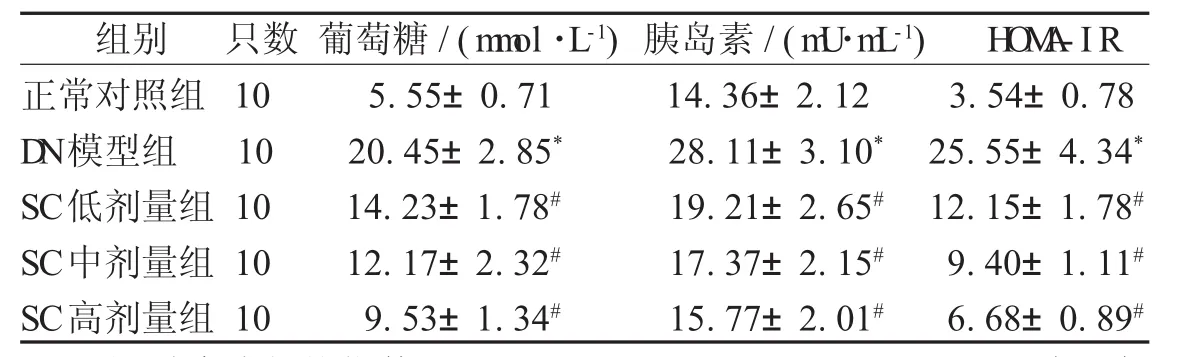
表2 各组大鼠H O M A-IR变化情况(±s)
注:胰岛素抵抗指数(H O M A-IR)=G l ucose×Insul i n/22.5;* 表示与正常对照组比较,P<0.05;#表示与D N模型组比较,P<0.05
组别 只数 葡萄糖/(m m ol·L-1)胰岛素/(m U·m L-1) H O M A-IR正常对照组 10 5.55±0.71 14.36±2.12 3.54±0.78 D N模型组 10 20.45±2.85* 28.11±3.10* 25.55±4.34*SC低剂量组 10 14.23±1.78# 19.21±2.65# 12.15±1.78#SC中剂量组 10 12.17±2.32# 17.37±2.15# 9.40±1.11#SC高剂量组 10 9.53±1.34# 15.77±2.01# 6.68±0.89#
2.3 TG、TC和LD L-C变化情况 与正常对照组相比,DN模型组大鼠血清TG、TC和LDL-C含量升高(P<0.05);与DN模型组比较,SC治疗4周后大鼠血清TG、TC和LDL-C含量降低(P<0.05),且具有剂量依赖性,见表 3。
表3 各组大鼠血清TG、TC和LD L-C变化情况(±s) m m ol/L
注:*表示与正常对照组比较,P<0.05;#表示与D N模型组比较,P<0.05
组别 只数 TG TC LD L-C正常对照组 10 0.53±0.06 1.12±0.23 0.16±0.02 D N模型组 10 1.51±0.20* 2.65±0.31* 0.49±0.06*SC低剂量组 10 1.03±0.12# 1.92±0.22# 0.32±0.03#SC中剂量组 10 0.81±0.09# 1.76±0.25# 0.24±0.05#SC高剂量组 10 0.62±0.07# 1.45±0.17# 0.18±0.02#
2.4 M D A、SO D及G SH变化情况 与正常对照组比较,DN模型组大鼠血清MDA含量升高(P<0.05),SOD和GSH含量下降(P<0.05);与DN模型组比较,SC治疗4周后MDA含量降低(P<0.05),SOD 和 GSH 含量升高(P<0.05),且 SC 低、中、高剂量组大鼠肾功能的改善效果依次递增,见表4。
表4 各组大鼠血清M D A、SO D及G SH变化情况(±s)
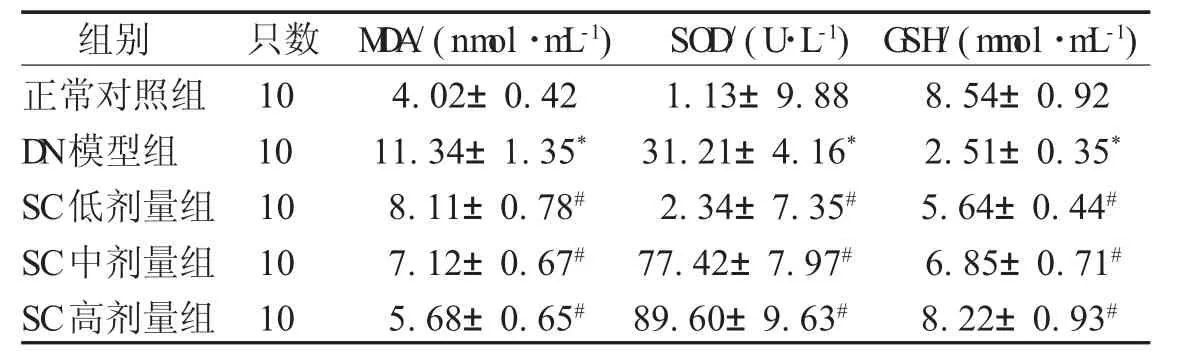
表4 各组大鼠血清M D A、SO D及G SH变化情况(±s)
注:*表示与正常对照组比较,P<0.05;#表示与D N模型组比较,P<0.05
组别 只数 M D A/(nm ol·m L-1) SO D/(U·L-1) G SH/(m m ol·m L-1)正常对照组 10 4.02±0.42 1.13±9.88 8.54±0.92 D N模型组 10 11.34±1.35* 31.21±4.16* 2.51±0.35*SC低剂量组 10 8.11±0.78# 2.34±7.35# 5.64±0.44#SC中剂量组 10 7.12±0.67# 77.42±7.97# 6.85±0.71#SC高剂量组 10 5.68±0.65# 89.60±9.63# 8.22±0.93#
2.5 N rf2和H O-1的m RNA表达情况 与正常对照组比较,DN模型组大鼠Nrf2和HO-1的mRNA表达下调(P<0.05);与DN模型组比较,SC治疗4周后Nrf2和HO-1的mRNA表达上调(P<0.05),且SC低、中、高剂量组的治疗效果依次递增,具有剂量依赖性,见图1。
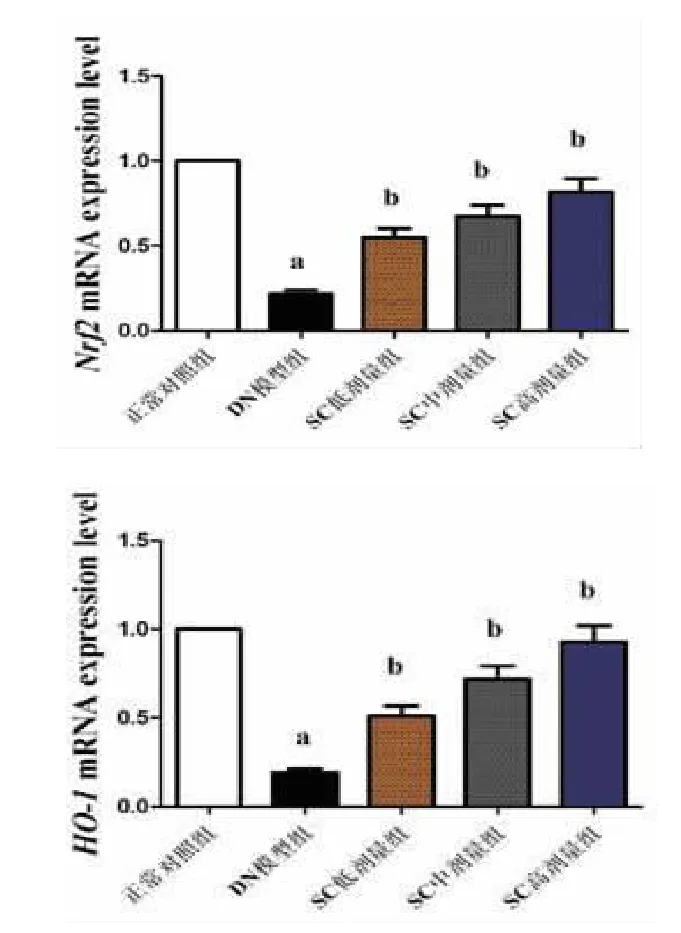
图1 N rf2和H O-1的m RN A表达情况
2.6 N rf2和H O-1蛋白表达情况 与正常对照组比较,DN模型组大鼠Nrf2和HO-1 蛋白表达下调(P<0.05),SC灌胃4周后Nrf2和HO-1的蛋白表达水平上调(P<0.05),且 SC 低、中、高剂量组的治疗效果依次递增,具有剂量依赖性,见图2。
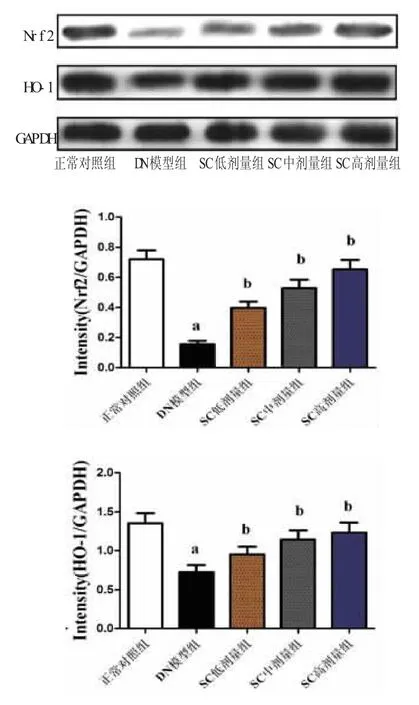
图2 N rf2和H O-1蛋白表达情况
3 讨论
SC作为一类常见的中药提取物,是灯盏花的主要活性成分,其降糖、降脂、增强胰岛素敏感性以及抗氧化等作用是其药理作用的重要方面,目前已成为肾脏病治疗的常用药物[10-12]。不少学者通过动物模型模拟DN的形态学、病理学及分子信号通路的改变来研究中药的作用机理并发掘DN治疗的新靶点。本研究采用高脂饮食喂养合并STZ腹腔注射的方法建立DN大鼠模型,可复制出接近DN多因素致病特点的动物模型。本研究结果表明SC能降低DN大鼠血液中的Scr及BUN含量,有降低DN大鼠体内IR,减少脂质沉积的作用。
氧化应激反应是诱导DN的重要方面。机体内促氧化物质和抗氧化物质相互作用来保持平衡状态。一旦出现各种病理因素,促氧化物质增多或抗氧化物质减少以及抗氧化反应不充分就会产生ROS从而导致氧化应激[13-14],本研究结果表明DN模型大鼠血清GSH、SOD含量降低,MDA升高。在生理状态下,适量的ROS能迅速被肾脏内抗氧化物质(如SOD、GSH等)清除,在糖尿病或高血糖环境中,来自机体的各种因素都有可能诱导ROS过多生成,超过了抗氧化物质的清除能力,便可诱导肾脏细胞发生氧化应激反应,并激活胞内多条相关信号通路。Nrf2是调节抗氧化应激反应的重要转录因子,在细胞存活中具有重要作用,Nrf2可激活一系列抗氧化酶(包括HO-1)的合成,以促进失衡的氧化还原反应恢复平衡,减轻自由基损伤。在氧化应激等情况下,Keap1会与Nrf2解离,导致Nrf2发生核转位进入细胞核,与抗氧化反应元件结合,以此来启动抗氧化酶基因表达,增强细胞对氧化应激和亲核化合物的抗性,其下游抗氧化基因包括HO-1、谷胱甘肽-S-转移酶(glutathione-Stransferase,GST)等,特别是 HO-1 表达增加可增强其抗氧化能力,能够保护机体免受活性氧的侵害[15-17]。本研究表明与正常对照组比较,DN模型组大鼠Nrf2和HO-1的mRNA和蛋白表达下调,SC治疗4周后肾脏中Nrf2和HO-1的mRNA和蛋白表达上调,且SC低、中、高剂量组的治疗效果依次递增,具有明显剂量依赖性。
综上所述,氧化应激反应在DN发生发展中起重要作用,SC可改善DN大鼠肾功能、降低体内IR与脂质沉积,并通过调节Nrf2/HO-1信号通路减轻氧化应激反应,从而缓解DN。

