2014-2016年我国江苏地区猪流行性腹泻病毒S基因的序列分析
焦 点,孙 杰,茅爱华,俞正玉,郭容利,朱 琳,范宝超,袁万哲,李 郁,何孔旺,李 彬
(1. 江苏省农业科学院兽医研究所,江苏南京210014 ; 2.安徽农业大学动物科技学院,安徽合肥230036 ;3.河北农业大学西校区动物医学院,河北保定071000)
猪流行性腹泻(Porcine epidemic diarrhea,PED) 是由猪流行性腹泻病毒(PEDV)引起的一种肠道传染病,发病猪主要表现为腹泻、呕吐、消瘦和死亡,主要发病于冬春季。各年龄段的猪都会感染,哺乳仔猪尤为严重。该病1978年首次报道于比利时和英国,之后在我国多以散发为主[2]。从2010 年末开始,我国暴发以新生仔猪严重腹泻、高发病率及高死亡率为主要特征的腹泻疫情,给养猪业造成了严重的经济损失。2013 年美国也开始暴发仔猪腹泻疫情,从遗传进化分析来看,美国的流行毒株与我国AH2012亲缘关系接近,并出现了S-Indel型的新型缺失毒株。日本、加拿大、韩国等国也相继暴发此病,尽管一些疫苗的应用对该病的控制发挥了重要作用,但直至目前该疫情在部分地区仍然有不同程度的流行和发生。
PEDV属于套式病毒目、冠状病毒科、冠状病毒属I群的成员,基因组为单股正链RNA[8]。根据其他冠状病毒的S蛋白可将其划分为S1(第1~789位氨基酸)和S2(第790~1383位氨基酸)。S蛋白在与受体细胞结合吸附、膜融合和诱导机体产生保护性中和抗体等方面发挥重要的作用[10-11],因此分析PEDV S蛋白对于当地流行毒株的流行情况和遗传变异有重要意义。目前,在S基因鉴定出4个表位,分别为499 aa~638 aa、748 aa~755 aa、764 aa~771 aa、1 368 aa~1 374 aa[12-13]。本研究对江苏部分猪场20份病料进行PEDV的检测,对S基因测序分析,为该病的防制提供了流行病学依据。
1 材料与方法
1.1 病料采集 共20份组织样品于2014-2016年采集于江苏地区腹泻发病猪场,病料样品为不同日龄发病猪的肠道及粪便,采集后于-20 ℃保存备用。
1.2 主要试剂和仪器 Promega公司Reverse Transcription System反转录试剂盒; Abm公司Safe-Green 2xPCRTaqMaster Mix PCR试剂盒; BIOWEST公司AGAROSE G-10琼脂糖凝胶;TaKaRa公司DS 2 000 DNA Marker;Omega公司Total RNA Kit II试剂盒; TaKaRa PCR Thermal Cycle Dice PCR仪;北京市六一仪器厂DYY-11型电泳仪;eppendorf (German)离心机;AXYGEN 胶回收试剂盒。
1.3 引物的设计与合成 参照GenBank已发表的PEDV的基因序列,设计如下4对引物,见表1,南京斯普金公司合成。

表1 设计的4对特异性引物
1.4 核酸模板的制备 取粪便或肠液,按1∶5用PBS稀释后研磨,反复冻融3次,8 000 r/min离心10 min取上清,按照OMEGA Total RNA Kit II说明书提取病毒RNA,置于-70 ℃保存备用。利用Reverse Transcription System反转录试剂盒将RNA反转录为cDNA。
1.5 PCR扩增 PCR反应总体积25 μL, 体系为:2×TaqPCR Master Mix 12.5 μL,上游引物0.5 μL,下游引物0.5 μL,DNA模板 2.0 μL,ddH2O 9.5 μL。
PCR扩增反应程序: 95 ℃预变性5 min后进入以下循环:95 ℃,30 s;57 ℃,30 s;72 ℃ 1.5 min;共进行30个循环,彻底延伸72 ℃ 10 min。取全部25 μL PCR产物用1%琼脂糖凝胶进行电泳,凝胶成像系统观察扩增情况,并对阳性条带切胶回收,连接pMD19-T克隆载体,转化至DH5α感受态细胞,挑取阳性菌送至南京思普金公司测序。
1.6 S基因序列分析 选取部分欧美、韩国、中国等地的参考毒株,毒株信息见表2,用DNA Star软件对所获得的20株PEDV S基因序列进行拼接,使用软件MegAlign进行同源性分析,MEGA 5.0作遗传进化分析,绘制其遗传进化关系树;用TMHMM Server,v.2在线软件(http://www.cbs.dtu. dk/ services /THMM/)对PEDV S基因进行跨膜区域预测。

表2 PEDV参考毒株信息
2 结果与分析
2.1 PCR扩增结果 分别用4对引物对PEDV 的S基因进行PCR分段扩增,经过琼脂糖凝胶电泳分析,可见到4条特异性扩增片段,与预期结果相符,图1。
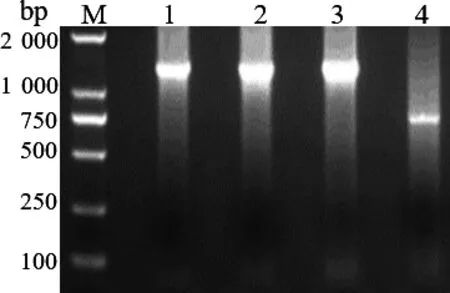
图1 PEDV S基因的4个片段分段扩增
2.2 PEDV S基因同源性及N端氨基酸分析 20株毒株的核苷酸(氨基酸)同源性为95.1%~99.8% (94.6%~99.9%), 与我国流行毒株AH2012、疫苗毒株Attenuated DR13、欧美毒株CV777的同源性为95.5%~99.3%(94.6%~99.0%)、93.5%~96.0%(92.5%~96.3%)、93.6%~95.8%(93.0%~96.5%)。
所测20株毒株的氨基酸差异性主要集中于S1端,毒株JSCZ1601出现了特异性的缺失,与CV777相比,在58~59位缺失了2个氨基酸(SS),见图2。

图2 毒株JSCZ1601 S基因编码的氨基酸序列特异性变异位点分析
-:与参考毒株CV777氨基酸相同 ; .:缺失
2.3 S基因遗传进化分析 由图3可知,PEDV毒株可分为2个大群(G1、G2)。12株流行野毒株位于G2b分支上,8株属于G1群S-Indel型。G2群的毒株属于流行毒株,和我国原先暴发的毒株(AH2012、AH2012/ 12、BJ-2011-1等)更为接近,其中韩国毒株独自分为一个亚枝;G1毒株属于经典毒株,8株位于G1的毒株全部位于S-Indel基因缺失株亚群,与位于G1b群的疫苗(CV777、Attenuated DR13、JS2008等)毒株群亲缘关系较远,同时我国的S-Indel群毒株与美国S-Indel群毒株不在一个亚枝内,说明我国的S-Indel基因缺失株与美国的S-Indel群毒株关系较远。
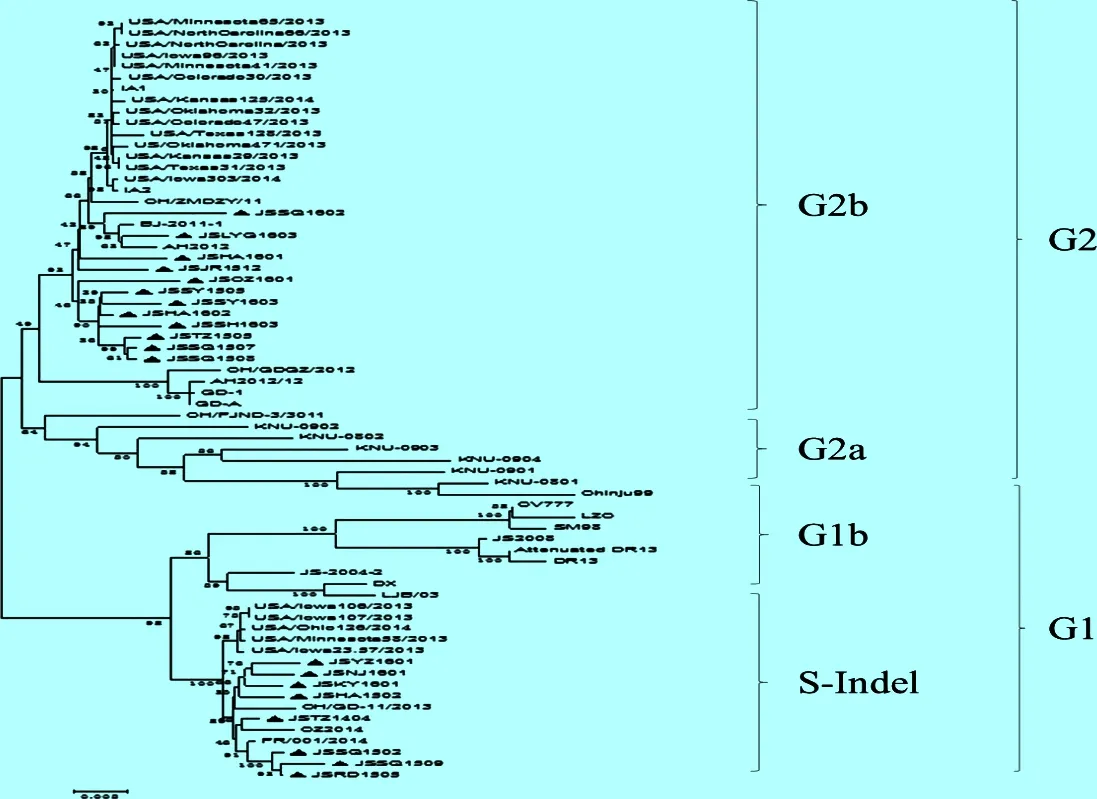
图3 基于S基因的遗传进化分析
▲:所测野毒株
2.4 抗原表位分析 对20株PEDV毒株S蛋白表位进行分析,SS2和2C10相对保守,主要的变异位于COE区域和SS6。在COE区域共有21个氨基酸的点突变,包括A522 S、G525 D、S527G、S528G、V532I、F541I、D547N、T554S、F556S、S588G、L596F、G599S、D604N、G614V、L617 F、T618 V、T626 E,其中有3个位点突变成2个不一样的氨基酸,包括K568R或N、A610E或者D、E638Q或者V,还有1个点突变位点变成3个不一样的氨基酸 L526 H或P或R。SS6的点突变包括L764S或者Y、D766 Y、F或者S,见图4。
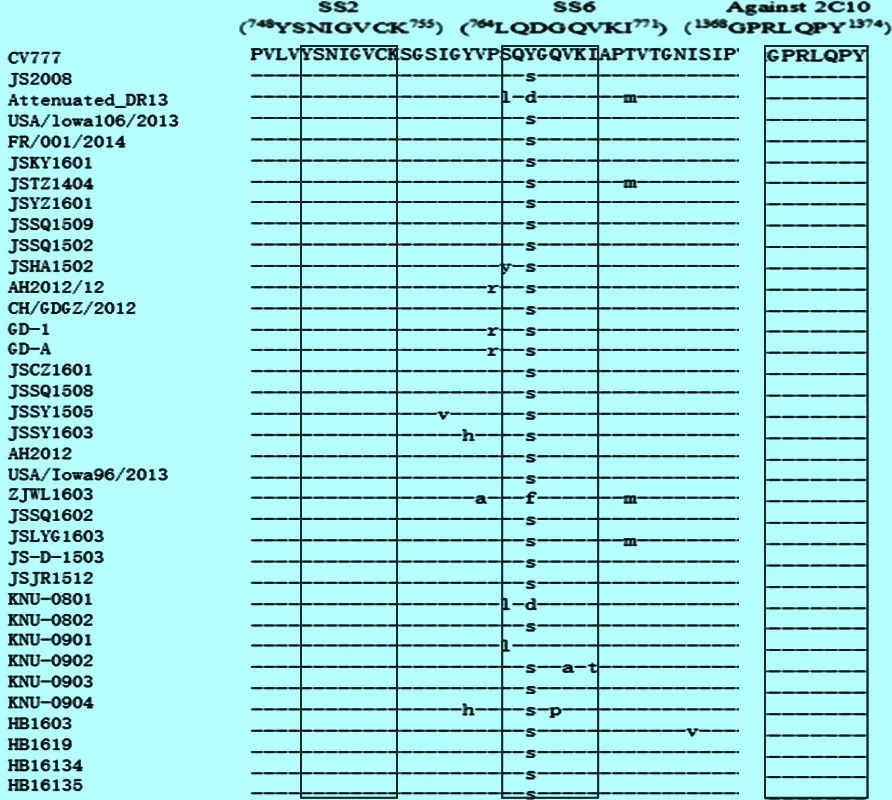
图4 野生株和参考株的S蛋白抗原表位的比较
-:与参考毒株CV777氨基酸相同
2.5 PEDV S基因跨膜区域变化 G2b流行株大部分在1 328~1 350位,而JSCZ1601在1 326~1 348位形成1个跨膜螺旋;S-Indel型毒株在1 325~1 347 位形成1个跨膜螺旋,主要是由于氨基酸的缺失或是插入使其跨膜螺旋区域发生了偏移,跨膜螺旋的偏移可能会造成病毒毒力的变化,影响机体对抗原位点的识别。
3 讨论
PEDV是危害养猪业的重要病原之一,其传染性强、危害大,哺乳仔猪和育肥猪均能感染。2010年10月,中国南方暴发PED,给养猪业造成巨大损失[14]。对S蛋白进行基因变异分析,可在一定程度上反映PEDV的变异情况,本试验对PEDV阳性样品S基因进行克隆测序,分析近年来PEDV的变异情况,为PED的防控提供一定的科学依据。
对S基因序列分析结果可知,毒株JSCZ1601存在特异性的缺失,与CV777相比,在58~59位缺失了2个氨基酸(SS),说明在PEDV的进化演变过程中,突变是一种手段;此外,美国在2014年报道了S-Indel 毒株的存在,研究发现美国的S-Indel毒株USA/Iowa107/ 2013的S1段与CH/S最为接近,而S2段与CH/ZMZDY/11最为接近,说明存在一定的重组现象并出现了新型毒株。这次研究中发现,我国S-Indel毒株与美国S-Indel毒株处在一个亚群,但是不在一个小的分支里,说明我国的毒株同样存在重组演变的过程,与美国的S-Indel型毒株亲缘关系较远。我国毒株多属于流行毒株G2群,美国的流行毒株单独处于一个大的亚群,中国流行毒株同样独自形成一个亚群,说明同属于G2群,但是亲缘关系并不是很近;位于G1群的毒株都属于S-Indel型,与疫苗毒株不在同一个分支,亲缘关系较远。
从抗原表位分析来看,突变位点主要集中于COE区域和SS6区域,同时跨膜螺旋区域的偏移,这些变异可能是导致病毒毒力增强的原因,而变异导致病毒的致病机理变化还有待研究。抗原表位的变化以及跨膜螺旋区域的偏移,可能引起PEDV的免疫逃避机制,影响机体对抗原位点的识别,推测这可能是近些年来商品化疫苗保护效力降低的原因,开发新型疫苗具有重要意义。
本研究通过对PEDV S 基因测序分析,了解了当前PEDV 变异毒株的流行情况,以及S基因的变异情况、突变位点、表位和膜螺旋区域的变化,为我国PEDV的防控提供基础。

