脂肪组织特异性Sirt6基因敲除小鼠发生非酒精性脂肪肝
韩在祺,崔佰吉,冯 波,姚 璐
(吉林医药学院,吉林吉林132013)
肝脏在调控糖脂代谢中发挥作用,通过合成和分解糖原以及糖异生途径维持血糖平衡[1]。同时,肝脏是人体内合成甘油三酯和胆固醇的主要器官,也是脂蛋白合成及组装的场所,肝脏将合成的甘油三酯以脂蛋白的形式进行转运,以此维持脂肪在机体内的均衡分布[2]。非酒精性脂肪肝(Non-Alcoholic Fatty Liver Disease,NAFLD)是一种典型的代谢性疾病,以肝脏脂肪代谢异常和脂肪堆积为特点[3]。目前,NAFLD已经成为最常见的慢性肝脏疾病[4]。
Sirt6是Sirtuins家族的成员之一,定位于染色体,具有多种催化活性,包括:去乙酰化、去酰化和核糖基化等[5-7]。因此,Sirt6具有广泛的底物基础,能够参与调控多种生理过程。虽然Sirt6基因敲除小鼠出生时表现正常,但是随着生长发育Sirt6基因敲除小鼠会出现致死性的低血糖、淋巴球细胞明显减少、皮下脂肪缺失和脊柱弯曲等缺陷,并在出生4周龄左右死亡,暗示Sirt6在调节机体糖脂代谢过程中具有不可忽视的作用[8]。基于此,我们构建了脂肪组织特异性Sirt6基因敲除小鼠模型,发现脂肪组织特异性Sirt6基因敲除小鼠发生渐进性肥胖[9]。考虑到肥胖是诱发非酒精性脂肪肝的重要危险因素,本试验通过探讨脂肪组织特异性Sirt6基因敲除对小鼠肝脏的影响,以期可以进一步明确脂肪组织Sirt6对肝脏糖脂代谢的调控作用。
1 材料与方法
1.1 实验动物及饲养 脂肪组织特异性表达Cre重组酶转基因小鼠(Fabp4-Cre)与Sirt6条件基因敲除小鼠(Sirt6-floxed)均由吉林医药学院保存和传代,动物统一编号,统一饲养。将Sirt6-floxed杂合小鼠与Fabp4-Cre小鼠交配的同时,将Sirt6-floxed杂合小鼠进行自交,如此,可以获得Sirt6floxed/floxed小鼠和Fabp4-Cre;Sirt6floxed/+小鼠。利用Sirt6floxed/floxed小鼠和Fabp4-Cre; Sirt6floxed/+小鼠交配,获得的Fabp4-Cre;Sirt6floxed/floxed小鼠,即为脂肪组织特异性Sirt6基因敲除小鼠(Sirt6ad-/-小鼠),获得的Sirt6floxed/floxed小鼠,即为野生型对照小鼠。小鼠断乳后,普通饲料饲养的小鼠即开始以正常饲料喂养。对于采用高脂饲料饲养的小鼠,从出生后的第五周龄开始采用高脂饲料喂养,高脂饲料购自Research Diets公司(D12492)。
1.2 Western Blotting检测 分别取两种基因型小鼠的肝脏、心脏、肾脏、棕色脂肪组织、肌肉、大脑、脾脏和白色脂肪组织。用加入蛋白酶抑制剂的RIPA裂解液裂解并使用匀浆器破碎组织后,低温360°旋转1h,4 ℃离心取上清,采用BCA法测定蛋白浓度,加入适量蛋白上样缓冲液,煮沸10 min,分装后-20 ℃保存。配置12% SDS-PAGE,对蛋白样品进行电泳,转膜,选择抗目标蛋白的一抗孵育,洗膜,再孵育二抗,再洗膜,最后进行显影和分析。Western Blotting方法检测Sirt6(1∶800)的表达,验证敲除效果,其中,Tubulin(1∶2 000)作为内参蛋白。
1.3 组织病理学检查 苏木素-伊红染色(H.E.染色):轻柔分离目的组织后,在4%多聚甲醛溶液中固定约48 h后,依次经脱水透明、浸蜡包埋、切片与贴片、脱蜡染色、脱水透明和封固等步骤后,使用光学显微镜观察。免疫组织化学染色:轻柔分离目的组织后,在4%多聚甲醛溶液中固定约48 h后,经石蜡切片脱蜡和水化、抗原修复、封闭内源性过氧化物酶、封闭、除去封闭液并加一抗(anti-CD68)孵育、PBS冲洗、DAB显色、苏木素复染和封固后,使用光学显微镜观察。
1.4 实时定量PCR检测 使用TRIZ试剂从两种基因型小鼠的肝脏组织中分离纯化总RNA。利用反转录酶和随机引物合成cDNA第一条链。利用基因特异性引物和SYBR Green实时定量PCR预混液,使用实时定量PCR仪对新合成的cDNA进行分析测定。利用ΔΔCt循环阈值方法分析数据。测定各目标基因转录水平是以Rps18(Ribosomal protein S18)作为内参基因,各组实验中目标基因的mRNA水平表示为对照组表达量的数倍。所用引物的序列见表1。

表1 Real-time PCR引物序列
1.5 数据处理 统计结果用SPSS 13.0软件分析,所有数据均以(平均数±标准差)表示,显著性水准为P<0.05。
2 结果
2.1 成功构建脂肪组织特异性Sirt6基因敲除小鼠 为验证Sirt6ad-/-小鼠脂肪组织特异性Sirt6基因敲除成功,分别分离Sirt6ad-/-小鼠(KO)和野生型小鼠(f)的肝脏(Liver)、心脏(Heart)、肾脏(Kid)、棕色脂肪组织(BAT)、肌肉(SKM)、大脑(Brain)、脾脏(Spl)和白色脂肪组织(WAT)进行Western Blotting检测,如图1所示,与野生型小鼠相比,Sirt6ad-/-小鼠只有棕色脂肪组织和白色脂肪组织不表达Sirt6,其余组织器官均表达Sirt6,说明实验中成功构建脂肪组织特异性Sirt6基因敲除小鼠模型-Sirt6ad-/-小鼠。
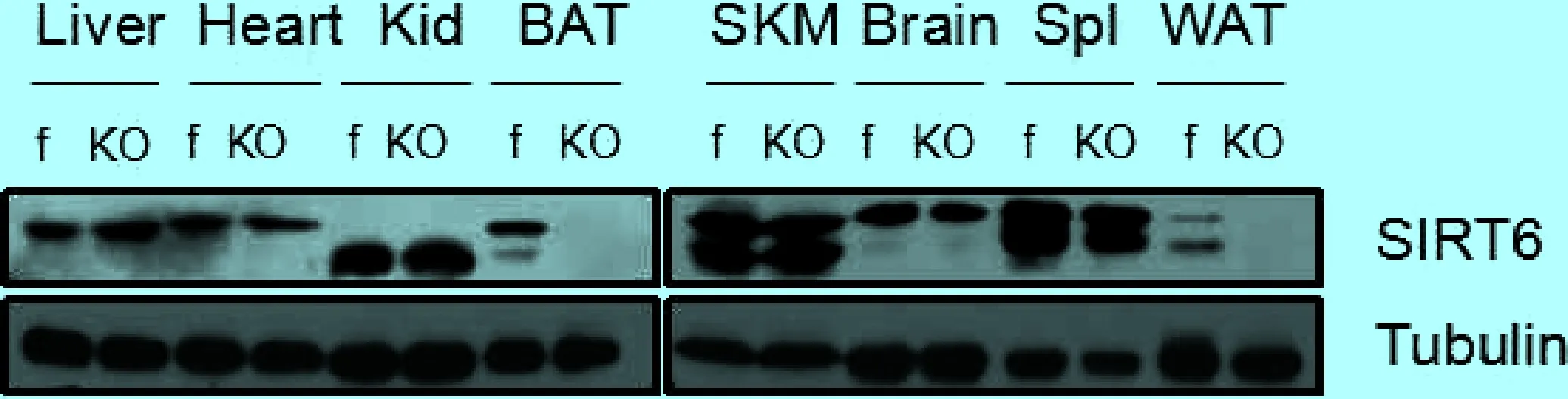
图1 Western Blotting检测Sirt6ad-/-小鼠和野生型小鼠不同组织中Sirt6蛋白的表达水平
2.2Sirt6ad-/-小鼠发生脂肪肝并伴有炎症反应 脂肪肝会使肝组织形态学发生显著变化,为此我们剖检正常饮食Sirt6ad-/-小鼠和野生型小鼠并分离出完整的肝脏组织进行观察(中插彩版图2a),发现与野生型小鼠结构致密、颜色鲜红的肝脏相比,Sirt6ad-/-小鼠的肝脏组织松散肿大、泛黄、表面可见散在颗粒状突起。原位解剖高脂饮食的两种基因型小鼠,同样发现,与野生型小鼠肝脏相比,Sirt6ad-/-小鼠的肝脏组织仍是松散肿大、表面可见散在颗粒状突起(中插彩版图2b)。取正常饮食两种基因型小鼠的肝脏组织制作组织切片,进行H·E·染色,我们在Sirt6ad-/-小鼠的肝脏组织切片中观察到肝细胞重度脂肪变性,脂肪空泡成片出现,细胞内的脂滴多为大泡型,有一些肝细胞的细胞核受脂肪空泡挤压移至肝细胞边缘,符合NAFLD表现(中插彩版图2c)。正常肝细胞储存脂肪的能力很小,超负荷的脂类沉积会影响代谢平衡,引起巨噬细胞浸润[10]。对正常饮食和高脂饮食的两种基因型小鼠肝脏进行免疫组化染色试验,发现两种饮食情况下Sirt6ad-/-小鼠的肝脏均对抗CD68的抗体产生明显阳性反应,表明Sirt6ad-/-小鼠的肝脏发生巨噬细胞浸润(中插彩版图2d)。
2.3 脂肪组织特异性Sirt6基因敲除使小鼠肝脏中参与脂肪生成关键基因的表达增多 脂肪生成主要是指非脂肪底物合成脂肪的过程,即从乙酰辅酶A转化成脂肪的过程,脂肪酸合成酶(Fas)和乙酰辅酶A羧化酶(Acc)是脂肪生成的关键酶,脂肪生成是造成肝脏脂肪沉积的重要原因[11]。此外,肝脏还可以通过Cd36摄入游离脂肪酸,增加肝脏中甘油三酯(TG)的含量[12]。利用实时定量PCR分析,我们发现,与野生型小鼠相比,两种饮食情况下Sirt6ad-/-小鼠肝脏中Cd36以及参与脂肪生成关键基因的表达均有不同程度的升高(图3a,b)。
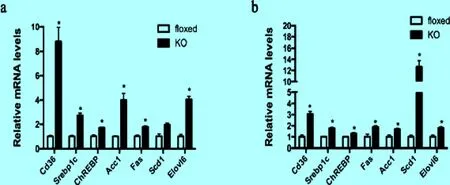
图3 脂肪组织特异性Sirt6基因敲除使小鼠肝脏中参与脂肪生成关键基因的表达升高
a:Real-time PCR分析正常饮食时Sirt6ad-/-小鼠(KO)和野生型小鼠(floxed)肝脏中Cd36和参与脂肪生成的关键基因的表达情况;b:Real-time PCR分析高脂饮食时两种基因型小鼠肝脏中Cd36和参与脂肪生成的关键基因的表达情况。*P<0.05
2.4Sirt6ad-/-小鼠肝脏中炎症因子的表达上调 过多的脂质沉积会造成肝细胞中线粒体、内质网和其他细胞器的功能异常,并引发炎症反应。利用实时定量PCR分析,我们发现与野生型小鼠相比,两种饮食情况下Sirt6ad-/-小鼠肝脏中炎症标记物的表达水平均有不同程度的上调(图4a,b)。
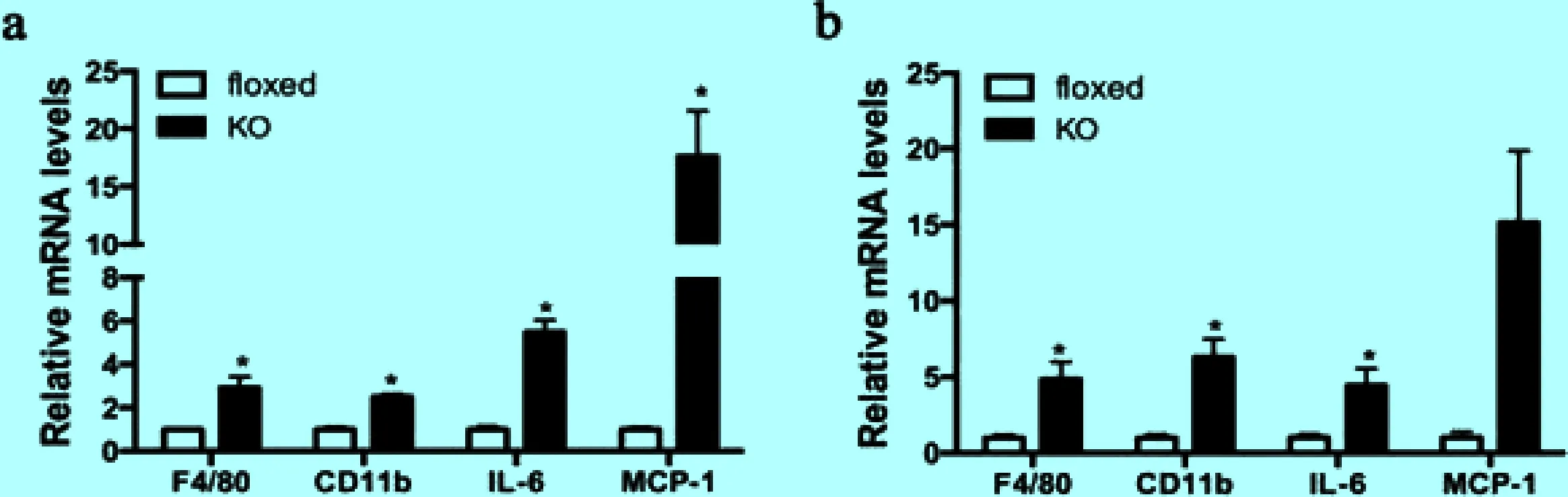
图4Sirt6ad-/-小鼠肝脏中炎症因子的表达上调
a:Real-time PCR分析正常饮食时Sirt6ad-/-小鼠(KO)和野生型小鼠(floxed)肝脏中炎症标记物的表达;b:Real-time PCR分析高脂饮食时两种基因型小鼠肝脏中炎症标记物的表达。*P<0.05
3 讨论
Sirt6ad-/-小鼠会发生渐进性肥胖,肥胖伴随有脂肪细胞体积的变大,当循环系统输送的养分不能够满足体积增大的脂肪细胞所需时,脂肪细胞会呈缺氧状态并使HIF-1α被激活,导致脂肪细胞死亡[13]。死亡的脂肪细胞会将原本储存于脂滴中的脂类释放到周围组织中,游离的脂类会促使巨噬细胞浸润到脂肪组织中将游离脂类消灭,当巨噬细胞缺乏将游离脂类全部吞噬的能力时,游离的脂类会随循环系统进入到肝脏等不宜储存脂类的组织器官中[14-15]。过多的脂肪沉积会对肝脏造成脂质毒性,使肝细胞中的细胞器功能异常,导致巨噬细胞浸润和炎症反应[16]。本试验中,脂肪组织特异性Sirt6基因敲除不仅使小鼠的肝脏发生脂肪沉积和炎症反应,还使小鼠肝脏中负责摄入游离脂肪酸和参与脂肪生成的关键基因表达上调。
虽然肥胖极有可能是导致Sirt6ad-/-小鼠发生非酒精性脂肪肝的重要原因。但不能忽略的是,脂肪组织具有内分泌功能,它能够分泌多种脂肪因子调节糖脂代谢,如:瘦素、脂联素、降脂素等[17-19]。已有研究发现,脂肪组织尤其是棕色脂肪组织可以通过分泌Nrg4抑制肝脏的脂肪生成,从而抑制脂肪肝的产生[20]。本试验还不能排除脂肪组织特异性Sirt6基因敲除影响脂肪因子分泌的可能性,因此,要明确脂肪组织特异性Sirt6基因敲除使小鼠发生脂肪肝的机制以及脂肪组织Sirt6对机体糖脂代谢的调控作用还需要后续试验进行深入研究。

