酸角壳提取物对脂肪负荷大鼠血脂的影响
李维熙 ,刘冬丽,苏薇薇,高永坚*
(1. 云南中医学院,云南 昆明 650500;2. 中山大学生命科学学院,广东 广州 510275;3. 国药集团广东环球制药有限公司,广东 佛山 528305)
酸角(Tamarindus indicaLinn.),又名酸豆、罗望子,为苏木科酸角属植物,原产于非洲热带, 现在全世界热带、南亚热带地区均有广泛引种和栽培[1]。我国云南、四川、海南、广东、广西、福建、台湾等省均有大范围种植。酸角在非洲、印度、孟加拉国、尼日利亚和巴基斯坦等国家作为传统常用药,使用历史悠久[2]。在我国,酸角也被历代医药典籍收载,据《本草纲目拾遗》记载“罗晃子味甘、性温、止渴退热,解利风邪”,《滇南本草》中也有“酸角味甘、性平。治酒化疾,隔于胃中”的说法。多项研究表明,酸角叶、果肉及种子提取物有较好的抗菌、抗真菌、退热、止痛等活性[3]。目前,我国与酸角有关产品主要为普通饮料、糖果与糕点,开发利用程度较低。酸角壳为酸角食用和加工中的废弃物,资源丰富,成本低廉,如能加以利用,将有巨大的开发潜质。
本文通过脂肪负荷模型探讨酸角壳提取物对脂肪吸收的影响,并评价酸角壳提取物对肠道脂肪酶活性的抑制作用,旨在为开发酸角壳提供有益的实验依据。
1 材料与方法
1.1 实验动物
雄性SD大鼠,体重200~240 g,SPF级,7周龄,购自广东省医学实验动物中心,动物许可证号SCXK(粤)2014-0002。实验动物按照美国NIH要求在清洁级层流架中饲养,环境温度22~24 ℃,照明时间12 h/d(6:00~18:00开灯)。适应性饲养1周后进行相关实验。
1.2 试剂与材料
橄榄油(美国Sigma公司);猪胰蛋白酶(美国Sigma公司);4-甲基伞形酮(4-MU,美国Sigma公司);考马斯亮蓝试剂盒,甘油三酯(triglyceride,TG)试剂盒、游离脂肪酸(free fatty acid, FFA)试剂盒、总胆固醇(total cholesterol,TC)试剂盒及游离胆固醇(free cholesterol, FC)试剂盒(南京建成生物工程研究所)。
1.3 仪器
MK3型酶标仪(芬兰Labsystem公司);Ultra-Turrax T8型组织匀浆机(德国IKA Labordchnik公司);3-18K型台式高速冷冻离心机(德国Sartorius公司);BS210S电子分析天平(德国Sartorius公司);WH-861型漩涡混合器(太仓科教器材厂);超纯水仪(德国Merck Millipore公司);pHS-25型酸度计(上海伟业仪器厂);ZF-Ⅱ型紫外分析仪(上海安亭电子仪器厂)。
1.4 酸角壳提取物的制备
酸角采自云南西双版纳。准确称取一定量,粉碎机粉碎后回收细粉化的酸角壳,加入10倍量50 %乙醇,加热回流提取2 h,过滤,滤渣再用相同条件提取1次,合并两次提取物滤液。滤液回收乙醇即得酸角壳提取物浸膏。
1.5 酸角壳提取物对脂肪负荷大鼠血脂的影响
实验动物随机分为模型组、酸角壳提取物100,200 mg/kg组,每组8只。于实验开始前禁食12 h,各给药组经灌胃给药,模型组灌胃给等体积蒸馏水。给药30 min后,分别灌胃给予5 ml/kg橄榄油,并分别于橄榄油负荷前、负荷后于2,4,6,8 h经尾静脉取血,按照试剂盒说明测定TG、FFA、TC和FC水平[4]。
1.6 酸角壳提取物对大鼠小肠内脂肪酶活性的影响
实验动物随机分为模型组、酸角壳提取物100和200 mg/kg组,每组8只。于实验开始前禁食12 h,各给药组经灌胃给药,模型组灌胃给等体积蒸馏水。给药30 min后,实验动物经戊巴比妥钠麻醉后开腹,基于组织部位分析和实验操作的需要,按小肠长度从上端起均分3等份剪开,即小肠上段、中段及下段3个部位,小肠上段为十二指肠及空肠上段,小肠中段为空肠中段和下段,小肠下段为回肠。分别将肠内容物取出,回收于特定容器中,取下小肠内黏膜并回收于特定容器。与预冷生理盐水按1:9 比例制成匀浆,分别测定不同部位的小肠内黏膜及肠内容物中的胰脂肪酶活性,同时测定其蛋白质含量,并计算和比较同等蛋白质量中的酶活性及抑制率。抑制率计算公式:抑制率(%)=[(U模型-U给药)/U模型]×100 %,其中U模型为模型组胰脂肪酶活性,U给药为给药组胰脂肪酶活性。
胰脂肪酶能以4-甲基伞形酮油酸酯(4-MU oleate)为底物,使其裂解并游离出油酸基团,其产物4-甲基伞形酮(4-MU)具有荧光性质,经355 nm波长激发,在 460 nm处产生发射光,测定4-MU含量可用于表示胰脂肪酶的活性。将小肠内容物及内黏膜制成的组织匀浆,4 ℃,10000 r/min离心10 min,取上清加入浓度为50 μmol/L 的4-MU oleate DMSO溶液,室温下反应30 min后,加入10.1 mol/L柠檬酸钠溶液终止反应。在激发波长355 nm、发射波长460 nm下检测4-MU的荧光强度。胰脂肪酶活性其中Finitial为反应起始时4-MU的荧光强度,Ffinal为反应终止时4-MU的荧光强度,D为溶液稀释倍数,T为反应持续时间,V为溶液体积[5]。
1.7 酸角壳提取物给药后不同时间点对小肠脂肪酶活性的影响
实验动物随机分为模型组、给药后0.5,1,2,3 h测定组,每组8只。于实验开始前禁食12 h,各给药组经灌胃给予酸角壳提取物100 mg/kg,模型组灌胃给等体积蒸馏水。不同测定组于规定时间点,照1.7项方法分别取组织,测定不同部位的小肠内黏膜及肠内容物中的脂肪酶活性,同时测定其蛋白质含量[5]。
1.8 统计分析
2 结果与分析
2.1 酸角壳提取物对脂肪负荷大鼠血脂的影响
结果见表1~4。给予大鼠5 ml/kg橄榄油后,各组实验动物TG水平明显升高,均在负荷后6 h达到峰值,随后逐渐下降,不同剂量的酸角壳提取物均能在一定程度上抑制TG值的上升,其中高剂量酸角壳提取物能显著抑制橄榄油负荷后4 h和6 h的TG水平,TG波动幅度较小,餐后反应曲线比较平稳。FFA是脂质代谢的中间体,在给予橄榄油之后,各组FFA水平均有所上升,与模型组相比,酸角壳提取物组并不能显著升高FFA水平。
橄榄油负荷后,TC和FC水平无明显变化,给予酸角壳提取物后对TC和FC水平也无显著影响。
表1 酸角壳提取物对大鼠橄榄油负荷后不同时间点血浆TG的影响/mmol·L-1(± s,n=8)
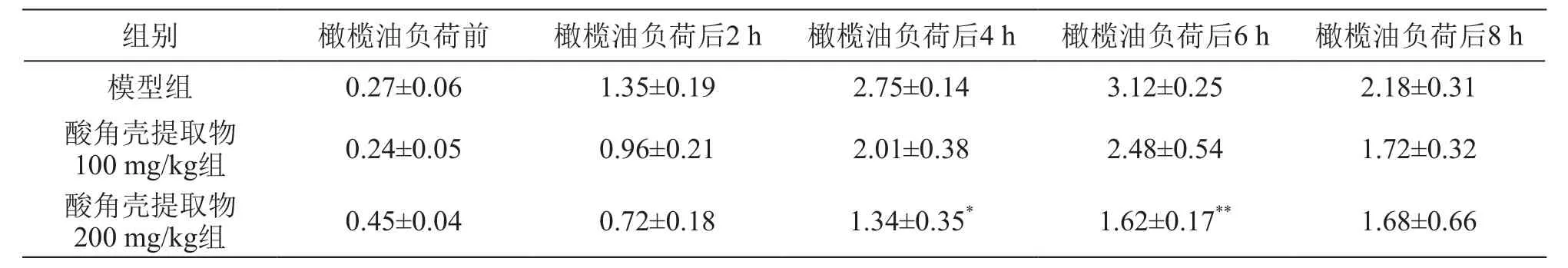
表1 酸角壳提取物对大鼠橄榄油负荷后不同时间点血浆TG的影响/mmol·L-1(± s,n=8)
注:*P<0.05,**P<0.01 vs 模型组
组别 橄榄油负荷前 橄榄油负荷后2 h 橄榄油负荷后4 h 橄榄油负荷后6 h 橄榄油负荷后8 h模型组 0.27±0.06 1.35±0.19 2.75±0.14 3.12±0.25 2.18±0.31酸角壳提取物100 mg/kg组 0.24±0.05 0.96±0.21 2.01±0.38 2.48±0.54 1.72±0.32酸角壳提取物200 mg/kg组 0.45±0.04 0.72±0.18 1.34±0.35* 1.62±0.17** 1.68±0.66
表2 酸角壳提取物对大鼠橄榄油负荷后不同时间点血浆FFA的影响/μEq·L-1(± s,n=8)
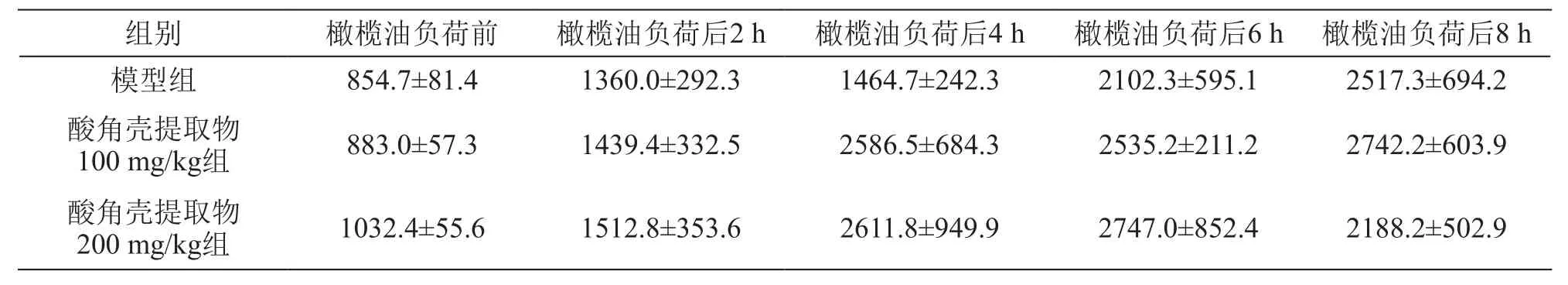
表2 酸角壳提取物对大鼠橄榄油负荷后不同时间点血浆FFA的影响/μEq·L-1(± s,n=8)
组别 橄榄油负荷前 橄榄油负荷后2 h 橄榄油负荷后4 h 橄榄油负荷后6 h 橄榄油负荷后8 h模型组 854.7±81.4 1360.0±292.3 1464.7±242.3 2102.3±595.1 2517.3±694.2酸角壳提取物100 mg/kg组 883.0±57.3 1439.4±332.5 2586.5±684.3 2535.2±211.2 2742.2±603.9酸角壳提取物200 mg/kg组 1032.4±55.6 1512.8±353.6 2611.8±949.9 2747.0±852.4 2188.2±502.9
表3 酸角壳提取物对大鼠橄榄油负荷后不同时间点血浆TC的影响/mmol·L-1(± s,n=8)
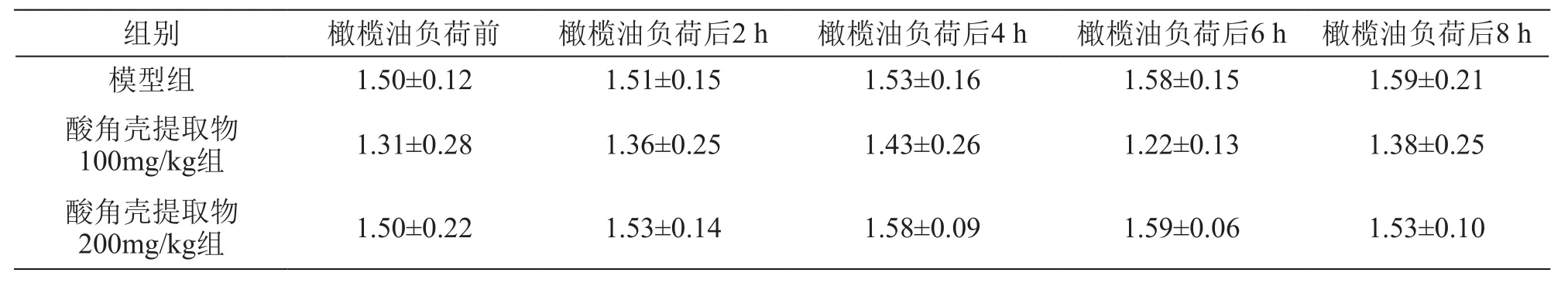
表3 酸角壳提取物对大鼠橄榄油负荷后不同时间点血浆TC的影响/mmol·L-1(± s,n=8)
组别 橄榄油负荷前 橄榄油负荷后2 h 橄榄油负荷后4 h 橄榄油负荷后6 h 橄榄油负荷后8 h模型组 1.50±0.12 1.51±0.15 1.53±0.16 1.58±0.15 1.59±0.21酸角壳提取物100mg/kg组 1.31±0.28 1.36±0.25 1.43±0.26 1.22±0.13 1.38±0.25酸角壳提取物200mg/kg组 1.50±0.22 1.53±0.14 1.58±0.09 1.59±0.06 1.53±0.10
表4 酸角壳提取物对大鼠橄榄油负荷后不同时间点血浆FC的影响/mmol·L-1(± s,n=8)
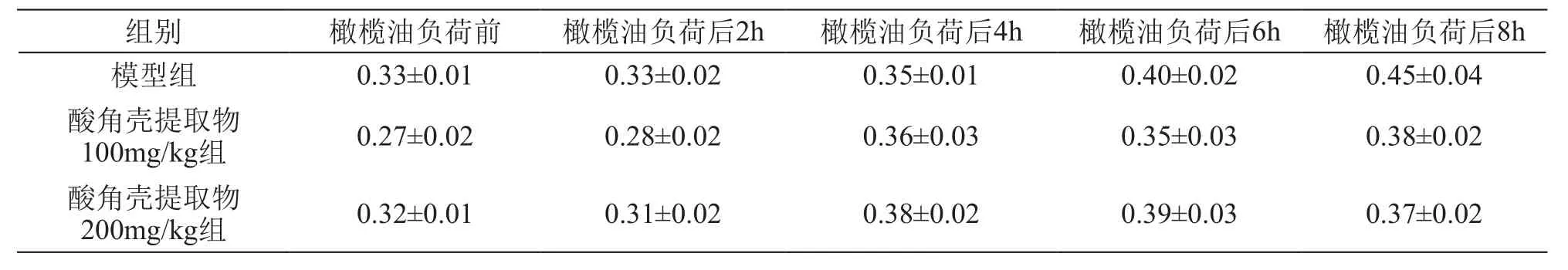
表4 酸角壳提取物对大鼠橄榄油负荷后不同时间点血浆FC的影响/mmol·L-1(± s,n=8)
组别 橄榄油负荷前 橄榄油负荷后2h 橄榄油负荷后4h 橄榄油负荷后6h 橄榄油负荷后8h模型组 0.33±0.01 0.33±0.02 0.35±0.01 0.40±0.02 0.45±0.04酸角壳提取物100mg/kg组 0.27±0.02 0.28±0.02 0.36±0.03 0.35±0.03 0.38±0.02酸角壳提取物200mg/kg组 0.32±0.01 0.31±0.02 0.38±0.02 0.39±0.03 0.37±0.02
2.2 酸角壳提取物对大鼠小肠内脂肪酶活性的影响
结果见表5~6。小肠内容物中的脂肪酶活性远高于小肠黏膜中的脂肪酶活性,而小肠上段内容物中脂肪酶活性最高,不同剂量的酸角壳提取物对小肠内容物内的脂肪酶活性均有较强的抑制作用,并显示明显的量效关系,其中,100 mg/kg酸角壳提取物的脂肪酶抑制率为48 %,200 mg/kg酸角壳提取物的脂肪酶抑制率为72 %。
表5 酸角壳提取物对大鼠小肠黏膜中胰脂肪酶活性的影响/U·g-1蛋白质(± s,n=8)

表5 酸角壳提取物对大鼠小肠黏膜中胰脂肪酶活性的影响/U·g-1蛋白质(± s,n=8)
组别 小肠上段 小肠中段 小肠下段模型组 3222.1±465.3 2211.2±433.1 1045.0±239.4酸角壳提取物100mg/kg组 2694.7±369.2 1325.2±262.7 852.9±202.4酸角壳提取物200mg/kg组 2757.5±334.1 1984.2±177.3 959.9±124.7
表6 酸角壳提取物对大鼠小肠内容物中胰脂肪酶活性的影响/U·g-1蛋白质(± s,n=8)
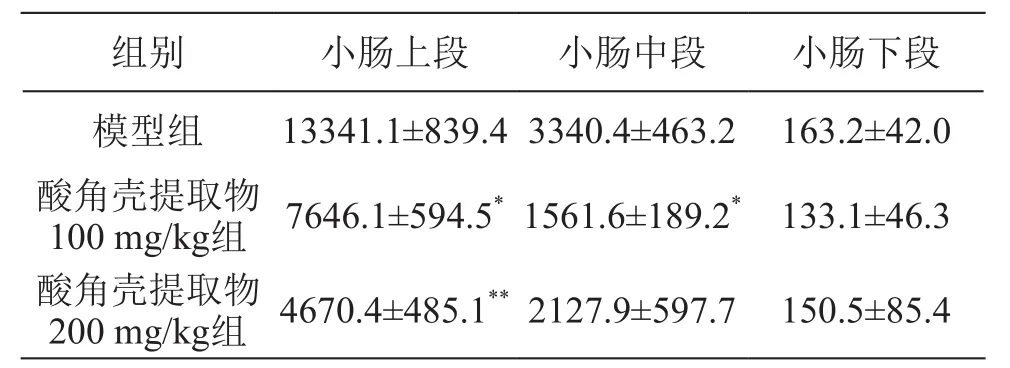
表6 酸角壳提取物对大鼠小肠内容物中胰脂肪酶活性的影响/U·g-1蛋白质(± s,n=8)
注:*P<0.05,**P<0.01 vs 模型组
组别 小肠上段 小肠中段 小肠下段模型组 13341.1±839.4 3340.4±463.2 163.2±42.0酸角壳提取物100 mg/kg组 7646.1±594.5*1561.6±189.2* 133.1±46.3酸角壳提取物200 mg/kg组 4670.4±485.1**2127.9±597.7 150.5±85.4
2.3 酸角壳提取物给药后不同时间点对小肠脂肪酶活性的影响
结果见表7~8。酸角壳提取物在给药30 min和1 h后显示较强的小肠脂肪酶的抑制作用,随后抑制作用逐渐减弱,在给药3 h后抑制作用基本消失。
表7 酸角壳提取物对大鼠小肠内黏膜中脂肪酶活性的影响/U·g-1蛋白质(± s,n=8)
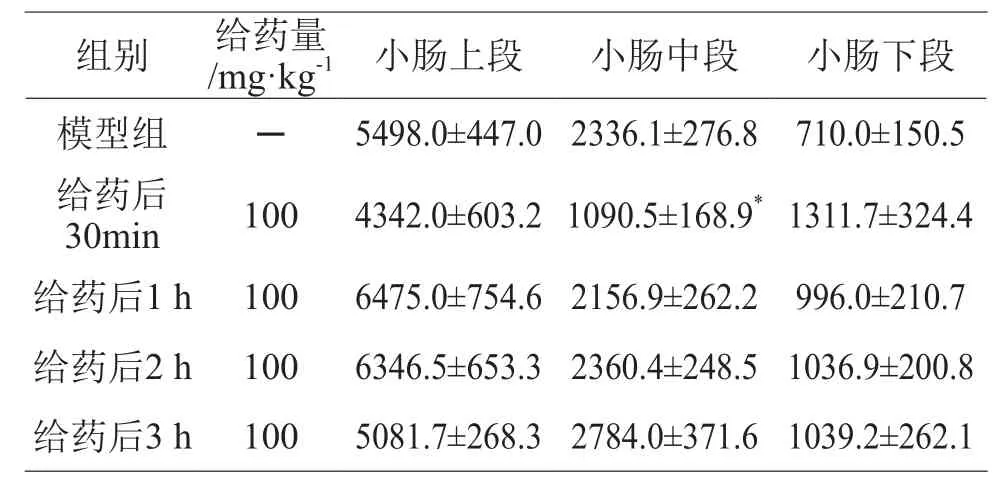
表7 酸角壳提取物对大鼠小肠内黏膜中脂肪酶活性的影响/U·g-1蛋白质(± s,n=8)
注:*P<0.05 vs 模型组
组别 给药量/mg·kg-1 小肠上段 小肠中段 小肠下段模型组 ─ 5498.0±447.0 2336.1±276.8 710.0±150.5给药后30min 100 4342.0±603.2 1090.5±168.9*1311.7±324.4给药后1 h 100 6475.0±754.6 2156.9±262.2 996.0±210.7给药后2 h 100 6346.5±653.3 2360.4±248.5 1036.9±200.8给药后3 h 100 5081.7±268.3 2784.0±371.6 1039.2±262.1
表8 酸角壳提取物对大鼠小肠内容物中脂肪酶活性的影响/U·g-1蛋白质(± s,n=8)
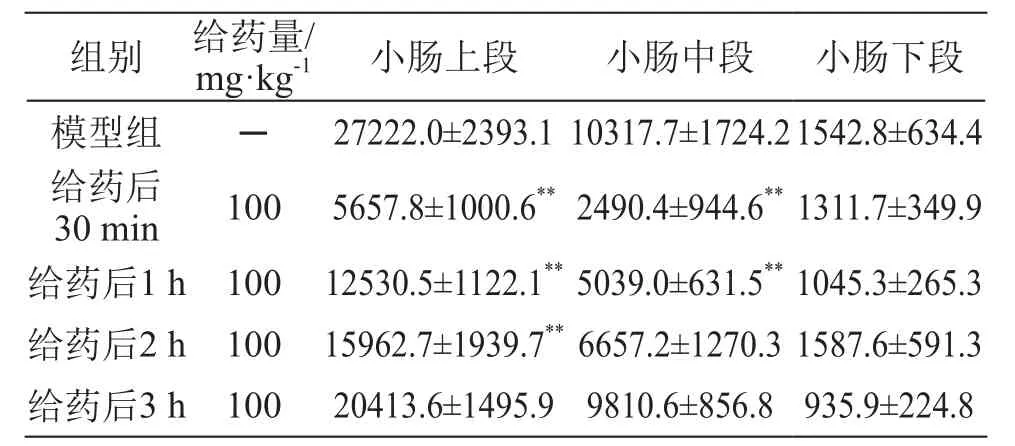
表8 酸角壳提取物对大鼠小肠内容物中脂肪酶活性的影响/U·g-1蛋白质(± s,n=8)
注: **P<0.01 vs 模型组
组别 给药量/mg·kg-1 小肠上段 小肠中段 小肠下段模型组 ─ 27222.0±2393.1 10317.7±1724.21542.8±634.4给药后30 min 100 5657.8±1000.6**2490.4±944.6**1311.7±349.9给药后1 h 100 12530.5±1122.1**5039.0±631.5**1045.3±265.3给药后2 h 100 15962.7±1939.7**6657.2±1270.3 1587.6±591.3给药后3 h 100 20413.6±1495.9 9810.6±856.8 935.9±224.8
3 讨论
本文结果表明,大鼠TG水平随给予脂肪负荷上升,并在负荷后6 h达到峰值,而在脂肪负荷前后,各组实验动物的TC与FC水平均无明显变化。这可能是由于TG可源于食物中脂肪的吸收与分解,因此在给予脂肪负荷后,TG水平显著升高;而TC和FC大部分来源于体内合成,受单次进食影响较小。与模型组比较,酸角壳提取物能降低脂肪负荷后不同时间点的TG水平,使餐后TG波动趋于平缓,提示酸角壳提取物能抑制餐后TG上升。
FFA是TG分解的中间体,给予脂肪负荷后,我们观察到在TG水平上升同时,FFA水平随之增加,但模型组与酸角壳提取物组之间的FFA水平无显著性差异。酸角壳提取物在改善餐后TG水平的同时,不会显著升高FFA水平,提示酸角壳提取物可能是通过抑制食物中脂肪水解吸收降低餐后TG水平。
胰脂肪酶能将食物中的脂肪水解,是食物中的脂肪在肠道消化吸收的关键酶之一。本实验结果表明,酸角壳提取物能显著抑制大鼠小肠胰脂肪酶活性,提示酸角壳提取物通过抑制胰脂肪酶阻碍食物中的脂肪水解和吸收,进而降低餐后TG水平。酸角壳提取物的胰脂肪酶抑制活性在给药后30 min到1 h活性最强。
综上所述,本文通过脂肪负荷模型探讨了酸角壳提取物对餐后血脂的影响,同时评价了酸角壳提取物对胰脂肪酶活性的抑制活性,结果表明,酸角壳提取物能显著降低脂肪负荷后各时间点的TG水平,并能显著抑制小肠胰脂肪酶活性,提示酸角壳提取物通过抑制小肠胰脂肪酶活性,减少食物中脂肪的吸收,从而降低餐后TG水平。脂质代谢紊乱,特别是餐后脂质代谢紊乱常见于肥胖、高脂血症、代谢综合征和2型糖尿病,与这些疾病有着密切的关系[6]。同时,餐后血脂异常还对动脉粥样硬化的发生与发展起着尤为重要的作用[7],特别是餐后高TG无论对于代谢异常患者或正常人,均是动脉粥样硬化以及心血管疾病的高风险因素[8-9]。随着生活方式改变,人们的脂肪消费水平日渐增加,脂质代谢紊乱发病率也随之上升。研究表明,餐后血脂异常早于空腹血脂异常出现,积极调节和治疗餐后高甘油三酯血症有助于改善代谢综合征,并能预防动脉粥样硬化等心血管疾病的发生[10-11]。酸角壳是酸角果实食用和加工的副产物,来源丰富,目前尚未得到充分研究,具有较好的开发前景,同时,其作用机制也有待深入研究。

