HepG2细胞胰岛素抵抗模型建立影响因素研究
刘迪迪,邱军强,程翠林,王振宇
(哈尔滨工业大学 化工与化学学院,黑龙江 哈尔滨 150001)
胰岛素抵抗(insulin resistance,IR)是Ⅱ型糖尿病的主要致病因素,其特征为机体靶组织对胰岛素反应不敏感,外周组织利用葡萄糖水平下降,肝脏细胞不能有效抑制糖异生和糖原分解,即胰岛素抑制肝脏葡萄糖输出能力下降,造成血糖调节能力紊乱[1-2]。研究表明,机体胰岛素抵抗还易引发并促进肥胖症、高血压、心血管及动脉粥样硬化等代谢疾病的发生和发展[3-4]。
从食品或中草药中筛选有效活性成分来改善胰岛素抵抗,治疗相关疾病已成为研究的热点[5-10]。建立稳定可靠的人体外IR细胞模型不仅便于筛选防治IR的有效药物及活性成分,还可在细胞及分子水平探索IR发病机制[11]。
肝脏是糖代谢最主要器官之一,对维持血糖稳定有重要作用。HepG2细胞来源于肝细胞,是一种表型与肝细胞极为相似的肝胚胎瘤细胞株,保留了肝细胞的许多生物学特性,因此,HepG2细胞是建立体外胰岛素抵抗模型的理想之选[12]。
目前相关研究中普遍以高浓度胰岛素为模型诱导剂,但文献报道中,胰岛素诱导浓度及作用时间存在一定差异[13-18],且缺乏更为详细系统的研究,培养基中是否含血清也很少有明确说明,而诸多因素均会影响到HepG2细胞对葡萄糖的消耗及细胞活性,进而影响胰岛素抵抗细胞模型的准确性与稳定性,因此,本试验展开系统研究,为建立可靠稳定的胰岛素抵抗细胞模型提供依据。
1 材料与方法
1.1 仪器与设备
二氧化碳培养箱(美国Thermo公司);SWCJ-1F单人双面净化工作台(上海蓝豹实验仪器公司);XDS-1B倒置生物显微镜(上海精密仪器仪表公司);mindray MR-96A酶标仪(深圳迈瑞)。
1.2 材料与试剂
人肝癌细胞(HepG2,哈尔滨肿瘤医院);牛胰岛素(INS,源叶生物);噻唑蓝(MTT),RPMI Medium 1640培养基,灭活胎牛血清(FBS),胰蛋白酶,磷酸盐缓冲液(PBS,Solarbio公司);葡萄糖测定试剂盒(葡萄糖氧化酶-过氧化物酶法,上海荣盛)。
2 方法
2.1 HepG2细胞的培养[19]
HepG2细胞复苏,转入100 ml细胞培养瓶中,用含10 % FBS的1640培养基,在37 ℃、5 % CO2条件下无菌培养。当细胞贴壁长满后,弃去培养基,以PBS洗涤细胞,再以0.25 % 胰蛋白酶消化,传代,取对数生长期的细胞用于实验。
2.2 HepG2细胞培养及分组
将处于对数生长期的细胞消化后,以含10 %FBS的RPMI 1640培养基调整细胞密度为105个/ml,接种于96孔板中,每孔100 μl继续培养,每块板均分为空白组(无细胞)、对照组(无胰岛素刺激,正常培养细胞)及模型组。待24 h细胞单层贴壁后,弃去含血清培养基,并以PBS洗涤,更换无血清培养基继续孵育24 h,弃去培养基,空白组、对照组加无血清培养基,模型组则加入以无血清培养基配制的胰岛素培养液,胰岛素终浓度分别为5×10-9,5×10-8,5×10-7,5×10-6、5×10-5mol/L,每组10个复孔,每孔100 μl。
2.3 HepG2细胞对葡萄糖的消耗试验[18,20]
考察不同胰岛素浓度及作用时间对细胞消耗葡萄糖的影响:于37 ℃ ,5 % CO2培养箱中孵育72 h,每12 h取培养基上清,葡萄糖氧化酶-过氧化物酶法检测葡萄糖含量,按下式计算葡萄糖消耗量。

式中:ΔGC为各组细胞的葡萄糖消耗量;GC0为未接种细胞的空白组中葡萄糖含量;GCx为测得各组培养液中葡萄糖含量。
2.4 模型稳定性研究试验
胰岛素作用48 h后,弃去含胰岛素的培养基,每孔以PBS洗涤1次,两块板分别加入无血清培养基及含10 %血清培养基100 μl,继续培养,分别于24,48,72 h取上清培养基测定葡萄糖消耗情况,每24 h更换一次培养基。按2.3项公式计算葡萄糖消耗量。
2.5 细胞增殖试验
葡萄糖消耗试验结束后,移出培养液,每孔加入5 mg/ml MTT溶液10 μl,37 ℃培养4 h,弃去培养液,每孔加入 DMSO 150 μl,用酶标仪中速振荡10 min至紫色结晶完全溶解,再于490 nm波长下检测各孔吸光度(A),根据A值计算细胞存活率(%)。

2.6 数据统计分析
3 结果与分析
3.1 不同胰岛素浓度及作用时间对HepG2细胞葡萄糖消耗量的影响
于无血清培养基中加入不同浓度胰岛素,分别作用于HepG2细胞12,24,36,48,60,72 h,测定其葡萄糖消耗量,发现添加胰岛素的模型组糖代谢出现异常(见图1)。由图1可见,葡萄糖消耗量与胰岛素浓度呈一定的剂量反应关系,胰岛素作用12 h时,随着胰岛素浓度的上升,葡萄糖消耗量也随之上升,胰岛素浓度为5×10-6mol/L时葡萄糖消耗量达到最大,胰岛素浓度继续增大时葡萄糖消耗量降低。由24,36,48 h及60,72 h反应曲线可见,葡萄糖消耗则分别在胰岛素浓度为5×10-9,5×10-8或5×10-7mol/L时达到最大,随胰岛素浓度的上升,葡萄糖消耗量下降。可见,随着诱导时间的延长胰岛素浓度升高反而会抑制细胞对葡萄糖的消耗,且作用时间越长发生趋势改变所需的胰岛素浓度越低。说明适当升高诱导浓度可缩短诱导时间,或可通过延长诱导时间来降低诱导浓度。

图1 不同胰岛素浓度及作用时间对HepG2细胞消耗葡萄糖的影响
3.2 胰岛素诱导后血清对HepG2 细胞葡萄糖消耗量的影响
HepG2细胞经胰岛素作用48 h,弃掉胰岛素,加入无血清培养基继续培养72 h,HepG2 细胞葡萄糖消耗量见图2。由图2a可见,随胰岛素浓度的升高,各时段葡萄糖消耗量均随之增大,胰岛素浓度为5×10-6mol/L时,葡萄糖消耗达最大。0~24 h葡萄糖的消耗量远大于24~48 h及48~72 h,说明随着时间的延长,细胞消耗葡萄糖的能力逐渐下降,但72 h内趋势相同。以5×10-5mol/L胰岛素浓度作用48 h后,在无血清培养基中培养24 h即可造成葡萄糖消耗量低于对照组。由图2b可见,胰岛素作用浓度为5×10-6mol/L时72 h累计葡萄糖消耗量达到最大值,之后则显著下降。说明胰岛素作用48 h后可诱导HepG2细胞在72 h内保持稳定的模型状态。

图2 胰岛素诱导后HepG2细胞在无血清培养基中的葡萄糖消耗量
HepG2细胞经胰岛素作用48 h,弃掉胰岛素,加入含10 %血清培养基继续培养72 h,HepG2 细胞葡萄糖消耗量见图3。由图3a可见,24 h时细胞葡萄糖消耗量随胰岛素浓度的增大而逐渐增大,胰岛素浓度为5×10-6mol/L时,葡萄糖消耗达最大,与无血清培养基中培养时趋势一致。24~48 h,葡萄糖消耗量随胰岛素浓度的升高呈先下降后升高趋势,但各浓度下糖消耗量均低于对照组,且在胰岛素浓度为5×10-9,5×10-8,5×10-5mol/L时差异有高度统计学意义(P<0.01),胰岛素浓度为5×10-5mol/L时糖消耗量最低。48~72 h葡萄糖消耗趋势与24~48 h相似,胰岛素浓度为5×10-8mol/L时葡萄糖消耗量最低,其他浓度时差异无统计学意义,可见随培养时间的延长,不同浓度胰岛素对细胞诱导的差异逐渐缩小。由图3b可见,72 h葡萄糖累计消耗量也随胰岛素浓度的增大呈先降低后升高趋势,说明细胞对葡萄糖消耗能力受培养时间影响很大,不同时间段可能呈现出不同趋势,葡萄糖累计消耗情况也会随之产生变化。与图2相比可见,培养基中是否含血清对细胞诱导结果会产生不同的影响。以5×10-8mol/L胰岛素浓度诱导48 h,在含血清培养基中培养48 h,即可造成HepG2细胞葡萄糖消耗量稳定低于对照组。
3.3 不同浓度胰岛素诱导对HepG2细胞增殖的影响
HepG2细胞以不同浓度胰岛素诱导后,均对其有促增殖作用,结果见表1。在未添加胰岛素的对照组中,24 h时含血清组存活率为不含血清组的1.38倍,48 h,72 h时则分别为1.67倍和2.48倍,说明随着培养时间的延长含血清培养基中HepG2细胞增殖更迅速。24 h时,胰岛素浓度为5×10-9~5×10-6mol/L时,细胞增殖情况差异不大,胰岛素浓度为5×10-5mol/L时细胞增殖受到抑制,这与无血清培养基中葡萄糖消耗趋势相一致。48 h及72 h时,各组细胞存活率均随胰岛素浓度的升高而升高,且变化幅度较24 h时更显著,即使在高浓度时也未见增殖抑制,说明细胞增殖情况与胰岛素浓度呈正相关。含血清培养基中,72 h时各组细胞较48 h时对应各组增殖显著,说明细胞生长状况良好。
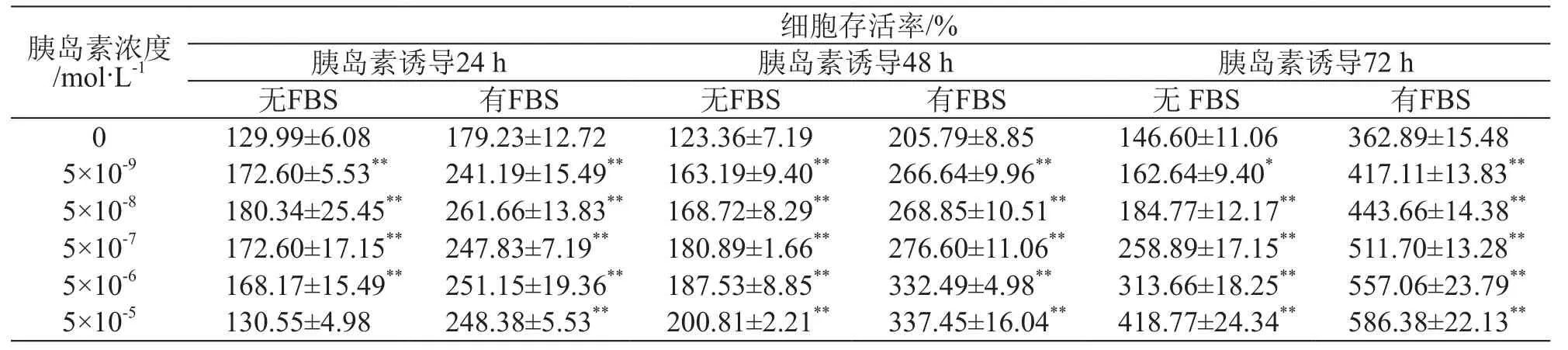
表1 不同浓度胰岛素诱导对HepG2细胞增殖的影响
3.4 不同浓度胰岛素诱导对HepG2细胞葡萄糖比消耗率的影响
不同浓度胰岛素作用不同时间后,培养基中无论是否添加血清,HepG2细胞葡萄糖比消耗率普遍低于对照组,见图4、图5。由图4、图5可见,试验浓度范围内均可诱导细胞产生胰岛素抵抗;24 h时葡萄糖比消耗率相近,可见培养基中是否添加血清对IR形成影响不大。48 h时,无血清培养基和含血清培养基中IR效果先增强后下降。72 h时葡萄糖比消耗率随着胰岛素浓度的升高呈连续下降趋势,这也与之前得出的随作用时间延长,发生胰岛素抵抗所需胰岛素浓度越来越低相吻合。在无血清和含血清培养基中培养24 h,葡萄糖比消耗率相对最低,即细胞普遍呈胰岛素抵抗最明显状态。
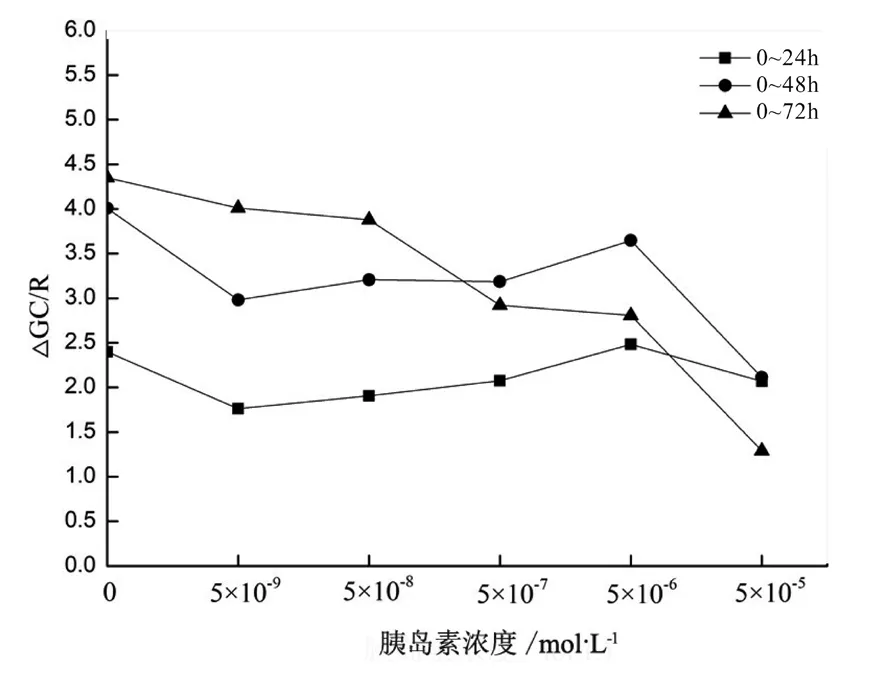
图4 无血清培养基中葡萄糖比消耗率

图5 含血清培养基中葡萄糖比消耗率
4 讨论与结论
国外从20世纪90年代初即开始这方面的研究,并已成功复制数种胰岛素耐受细胞模型[21-22],这些细胞模型主要有高胰岛素诱导培养、高葡萄糖培养、游离脂肪酸(FFA)诱导等模型,其中以高胰岛素培养模型最为稳定、可靠,使用也最为广泛。
胰岛素最主要的生物学作用是促进葡萄糖代谢。胰岛素抵抗的最主要特征是机体对胰岛素促进葡萄糖的摄取发生了抗性。既然低浓度胰岛素会促进糖消耗,高浓度胰岛素才会产生IR,那么建模所用胰岛素浓度的确定对建立模型的可靠性意义重大。
文献报道,诱导模型所用的胰岛素浓度从5.8×10-3mg/ml[17]、30 μg/ml[8]、10 mg/L[18]、10-10mol/L[15]、5×10-7mol/L[14,23]至10-4mol/L[16]不等,诱导时间也从24 h至48 h不等。通过本试验得出,诱导时间不同,出现胰岛素抵抗的浓度也不同,诱导时间越长,所需胰岛素浓度越低。HepG2细胞在胰岛素中作用48 h后,换不含胰岛素培养基继续培养,在无血清培养基中,低浓度时,葡萄糖消耗量随胰岛素浓度的升高呈增加趋势,在5×10-5mol/L时受到抑制。在含血清培养基中,48~72 h培养阶段,5×10-8mol/L浓度胰岛素诱导的细胞模型葡萄糖消耗量最低。。
不同浓度胰岛素在诱导后的72 h内均会促进HepG2细胞增殖,且对葡萄糖消耗产生相应的影响。通过计算比葡萄糖消耗率得出,在此试验浓度范围内,葡萄糖比消耗率均低于对照组,即单位细胞葡萄糖消耗能力下降,形成了胰岛素抵抗,葡萄糖总消耗量的升高是因为胰岛素能促进HepG2细胞体外增殖造成的[24],而并非单位细胞对葡萄糖消耗能力增强。在无血清培养基中,24 h时5×10-9mol/L诱导的细胞IR最明显,48 h后则5×10-5mol/L诱导的IR最严重。可能是因为在HepG2 细胞表面存在的胰岛素受体在不同作用时间下受浓度的影响也不同。在含血清培养基中,诱导后培养24 h时IR较强,其中5×10-9mol/L和5×10-8mol/L时IR最明显。综合考虑,选择5×10-8mol/L胰岛素诱导48 h后在含血清培养基中继续培养24 h,且在5×10-9~5×10-5mol/L 浓度范围内效果稳定。
因此,诱导HepG2细胞建立胰岛素抵抗模型,要根据具体试验时间,选择合适的胰岛素浓度及培养基,不可一概而论,建议以5×10-8mol/L浓度胰岛素诱导48 h,换含血清培养基继续培养2 h最易形成明显的胰岛素抵抗模型。此HepG2细胞模型在较长的时间内(72 h)均可维持胰岛素抵抗特性,可为筛选胰岛素增敏剂提供充分的时间。

