丹皮酚抑制脂多糖诱导的血管内皮细胞TNF-α释放对共培养体系中血管平滑肌细胞凋亡及p38 MAPK信号通路的影响
刘雅蓉, 吴鸿飞,戴 敏
(1. 安徽中医药大学药学院,安徽 合肥 230012;2. 新安医学教育部重点实验室, 安徽 合肥 230038;3. 安徽省中药研究与开发重点实验室,安徽 合肥 230012)
在动脉粥样硬化(atherosclerosis,AS)的发生发展过程中,血管内皮细胞(vascular endothelial cells,VECs)的炎性损伤和功能障碍是AS形成的始动环节[1]。细菌脂多糖(lipopolysaccharide,LPS)作为微生物感染的主要致病因素能够刺激内皮损伤,是公认的致内皮损伤的危险因子之一[2]。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)是构成血管壁另一重要组成成分,其凋亡参与AS及再狭窄的发生发展[3]。p38 MAPK信号通路在调控细胞凋亡方面发挥着重要的作用[4],其下游蛋白中p53和caspase-3与细胞凋亡有着密切的关系[5]。本课题组已有研究表明LPS可以诱导与VSMCs共培养的VECs黏附功能改变[6],但是LPS对VECs的炎症损伤是否会影响VSMCs的正常功能及其机制尚不知晓。
丹皮酚(Paeonol,Pae)是从毛茛科植物牡丹PaeoniaSuffruticoasAndr.的干燥根皮及萝摩科植物徐长卿Cynanchumpaniculatum(Bge.)Kitag.的干燥根及根茎中提取出来的有效成分之一。前期的研究已证实Pae可以抑制ox-LDL诱导的VECs中肿瘤坏死因子-α(tumor necrosis factor-alpha, TNF-α)释放,减少VECs的炎性反应[7-8],并且可以明显降低由LPS诱导的PI3K/AKT-NF-κB通路[9],发挥保护内皮损伤的作用。而Pae对VECs炎性反应的抑制作用是否会影响VSMCs凋亡还需进一步验证。本实验以VSMCs凋亡为切入点,阐明Pae抗AS作用的分子机制,为研究Pae治疗AS提供新的靶点。
1 材料
1.1 实验动物 健康Sprague-Dawley(SD)雄性大鼠,清洁级,体质量(160±10)g,安徽医科大学实验动物中心[生产许可证号:SCXK(皖)2016-0015]提供。
1.2 主要药物与试剂 Pae:宣城百草植物工贸有限公司,纯度99%;LPS:美国Sigma公司;Transwell小室:美国Gibco公司,孔径:0.4 μm;Annexin Ⅴ-FITC细胞凋亡检测试剂盒:上海贝博生物试剂;肿瘤坏死因子-α(tumor necrosis factor-alpha, TNF-α)ELISA试剂盒:美国Biosource公司;鼠抗β-actin抗体(批号 AP0065)、兔抗MKK3/6抗体(批号 BS1784)、兔抗P-MKK3/6抗体(批号 BS1225)、兔抗p38抗体(批号 BS6412)、兔抗P-p38抗体(批号 BS1689)、兔抗p53抗体(批号 BS3746)、兔抗caspase-3抗体(批号 BS3723):Bioworld Technology公司。
1.3 主要仪器 MCO-175型CO2培养箱:日本Sanyo公司;SW-CJ-1F型洁净工作台:苏净集团安泰公司;CK2型倒置显微镜:日本Olympus公司;ELX800uv酶标仪:Bio-TEK公司;Hoefer电泳仪:Amersham Biosciences公司。
2 方法
2.1 大鼠胸主动脉VECs及VSMCs的分离、培养与鉴定 参照文献[10-13]的方法进行操作。取大鼠胸主动脉,将血管外翻,暴露内膜,血管两端扎紧,0.25% Ⅰ型胶原酶消化1 h,切成2 mm×2 mm的小块,保持血管内膜朝下,贴在鼠尾胶原包被过的细胞培养瓶底部,放入细胞培养箱培养。另取大鼠胸主动脉血管,同样操作使血管内膜暴露出来,用刀片小心地自上而下刮1~2遍,以去除血管内皮细胞,露出中膜层,0.3% Ⅰ型胶原酶消化1 h,切成2 mm×2 mm小块,保持中膜层朝下,贴在细胞培养瓶底部,放入细胞培养箱培养。待细胞融合率达到约80%的时候,即可进行细胞传代,在原代细胞第一次传代时,采用差速消化、差速贴壁法纯化细胞。本实验所采用的细胞均是3~5代细胞。采用免疫细胞化学法鉴定VECs胞浆内Ⅷ因子相关抗原以及VSMCs胞浆内α-SMA的表达,确定分离出的细胞确实为VECs以及VSMCs。
2.2 VECs和VSMCs共培养模型的复制 借助Transwell小室建立共培养体系,无菌条件下,将VECs(1×105/mL)接种于6孔板底部,另取空白孔放上Transwell小室,将VSMCs(1×105/mL)接种在Transwell小室中,待两种细胞均贴壁生长后,吸弃原培养基,将Transwell小室移到种有VECs的孔中,重新加入DMEM(含15% FBS),建立起共培养体系,两种细胞间不发生直接细胞连接,VECs主要是通过分泌因子透过Transwell膜影响VSMCs。
2.3 MTT检测LPS损伤作用及Pae保护作用的量效时效关系 将VECs细胞混悬液(1×105/mL)接种于96孔板中培养,每孔加入含有不同浓度的LPS(1、10、100、1 000、10 000 ng/mL)培养液200 μL,另设不含LPS的培养液为正常对照组,分别于培养箱中培养不同时间(1、3、5、7、9 h)。每孔分别加入20 μL MTT(5 mg/mL),培养箱中培养4 h后,小心吸弃上清细胞培养液,加入150 μL DMSO溶解MTT,振荡器混匀,酶标仪490 nm测定吸光度(absorbance, A)值。细胞抑制率=(正常对照组A值-实验组A值)/正常对照组A值×100%。
另取细胞,每孔预先给予含不同浓度(7.5、15、30、60、120 μmol/L)Pae的培养液200 μL,分别于培养箱中培养不同时间(6、12、24、36、48 h)。吸弃原培养液,PBS轻洗1次,每孔加入含LPS(100 ng/mL)的培养液200 μL继续孵育7 h。另设单加培养液为正常对照组。同样方式检测A值。细胞存活率=实验组A值/正常对照组A值×100%。
2.4 实验分组及给药 建立共培养体系,进行分组干预。①正常对照组:用DMEM(含2% FBS)培养细胞;②LPS组:用含LPS(100 ng/mL)的培养液孵育7 h;③Pae(15、30、60 μmol/L)组:预先用含15、30、60 μmol/L Pae的培养液孵育24 h,吸弃培养液,再分别加入含LPS(100 ng/mL)的培养液孵育7 h;④TNF-α抑制剂组:先加入含10 μg/mL TNF-α抑制剂的培养液孵育24 h,吸弃培养液,再加入含LPS(100 ng/mL)的培养液孵育7 h;⑤SB203580组:先加入含20 μmol/L SB203580的培养液孵育2 h,吸弃培养液,再加入含LPS(100 ng/mL)的培养液孵育7 h。
2.5 ELISA法检测TNF-α 吸取各组细胞上清液备用。将标准品按规定浓度依次稀释;加样:空白对照孔只加显色剂和终止液,标准品孔加入50 μL标准品、50 μL链霉素-HRP,待测样品孔加入各细胞上清液样品40 μL、抗TNF-α抗体10 μL、链霉亲和素-HRP 50 μL。每组样品设置3个复孔,盖上封板膜,轻轻振荡混匀,37 ℃温育60 min。经过洗涤、显色及终止反应后,采用酶标仪在450 nm波长下测量各孔的A值,根据标准品A值绘制标准曲线,计算样品浓度。
2.6 流式细胞仪检测VSMCs凋亡率 收集各组细胞培养液,各组细胞加入500 μL不含EDTA的胰酶,于培养箱中消化50 s,1 800 r/min离心5 min,弃去培养液。加入预冷PBS重新混悬细胞,1 800 r/min离心5 min,弃去PBS,重复两次。加入400 μL Annexin Ⅴ结合液混悬细胞(1×106/mL),在细胞混悬液中加入5 μL Annexin Ⅴ-FITC染色液,轻轻混匀后于2~8 ℃避光条件下孵育15 min,再加入10 μL PI染色液后轻轻混匀,于2~8 ℃避光条件下孵育5 min,立即用流式细胞仪检测。流式细胞仪激发光波长为488 nm,FL1通道检测Annexin Ⅴ-FITC的绿色荧光信号,PI红色荧光在620 nm,通过FL3通道检测。
2.7 Western blotting检测蛋白变化 提取各组细胞总蛋白,采用BCA蛋白定量试剂盒进行蛋白定量,进行SDS-PAGE电泳,然后将蛋白转至硝酸纤维素膜。5%脱脂奶粉常温封闭4 h后,用PBST洗涤3遍,每次10 min。将硝酸纤维素膜放入一抗稀释液稀释的一抗中,4 ℃孵育过夜。用PBST洗3遍,每次10 min。加入脱脂奶粉稀释的二抗IgG-HRP,室温孵育2 h。用PBST洗3遍,每次10 min。用化学发光试剂(ECL)显影,凝胶成像系统采集图片。
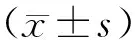
3 结果
3.1 LPS损伤VECs的量效时效关系 不同浓度的LPS作用不同时间,对VECs有不同程度的损伤。在浓度为100 ng/mL,刺激时间为7 h时,LPS对VECs的抑制率最大(P<0.05),故选择该浓度和作用时间作为最佳刺激浓度和时间。见图1。
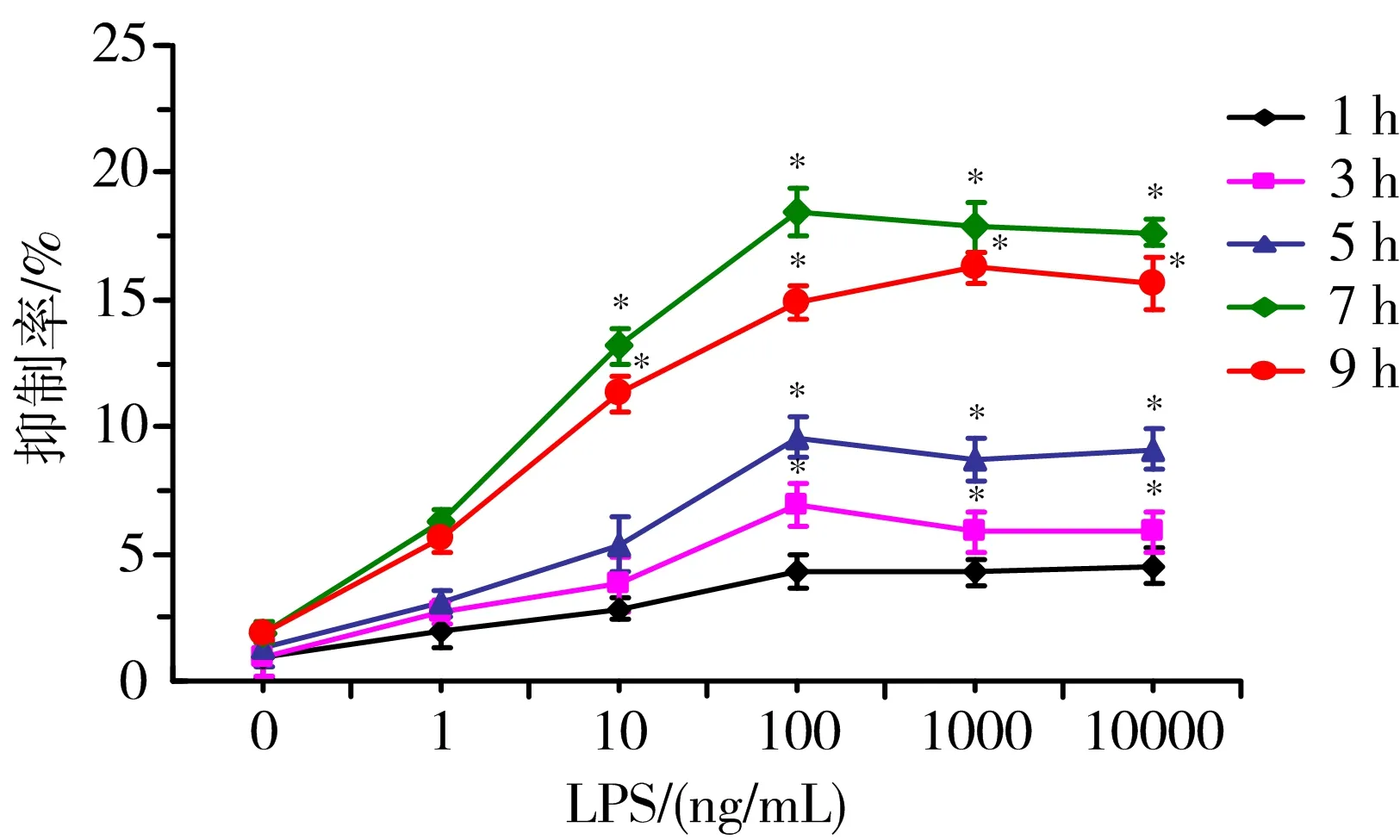
注:与正常对照组(LPS 0 ng/mL组)比较,*P<0.05
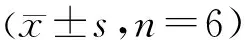
3.2 Pae对LPS损伤的VECs保护作用的量效、时效关系 LPS作用后,各组VECs存活率均有显著降低(P<0.05);不同浓度Pae作用不同时间,对LPS(100 ng/mL)诱导损伤的VECs均具有不同程度的保护作用。其中15、30、60 μmol/L Pae作用24 h对VECs损伤的保护作用最为明显,设为Pae最佳作用浓度及最佳作用时间。见图2。
3.3 Pae抑制LPS损伤的VECs分泌TNF-α 与正常对照组相比,LPS显著提高VECs分泌的TNF-α水平(P<0.05);给予15 μmol/L Pae预保护的细胞,与LPS刺激组相比,TNF-α水平显著降低(P<0.05);给予30、60 μmol/L Pae预保护的细胞,与LPS刺激组相比,TNF-α水平均显著降低(P<0.05)。见图3。表明LPS可诱导VECs释放TNF-α,而Pae可显著抑制VECs中TNF-α的释放。
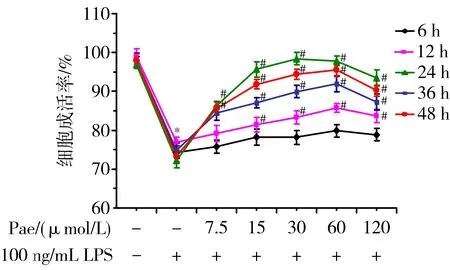
注:与正常对照组[Pae(-)、LPS(-)组]比较,*P<0.05;与LPS组[Pae(-)、LPS(+)组]比较,#P<0.05
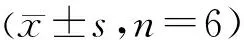
注:与正常对照组[Pae(-)、LPS(-)组]比较,*P<0.05;与LPS组[Pae(-)、LPS(+)组]比较,#P<0.05

3.4 Pae抑制共培养体系中VSMCs的凋亡 LPS组与正常对照组相比,VSMCs的凋亡率显著上升(P<0.05);Pae各剂量组与LPS组相比,VSMCs的凋亡率均显著降低(P<0.05),且呈现浓度依赖性,说明Pae可显著抑制VSMCs的凋亡;TNF-α抑制剂组与LPS组比,VSMCs的凋亡率明显降低(P<0.05),说明共培养体系中TNF-α水平降低会导致VSMCs的凋亡受抑制。见图4。
注:与正常对照组[Pae(-)、LPS(-)、TNF-α抑制剂(-)组]比较,*P<0.05;与LPS组[Pae(-)、LPS(+)、TNF-α抑制剂(-)组]比较,#P<0.05

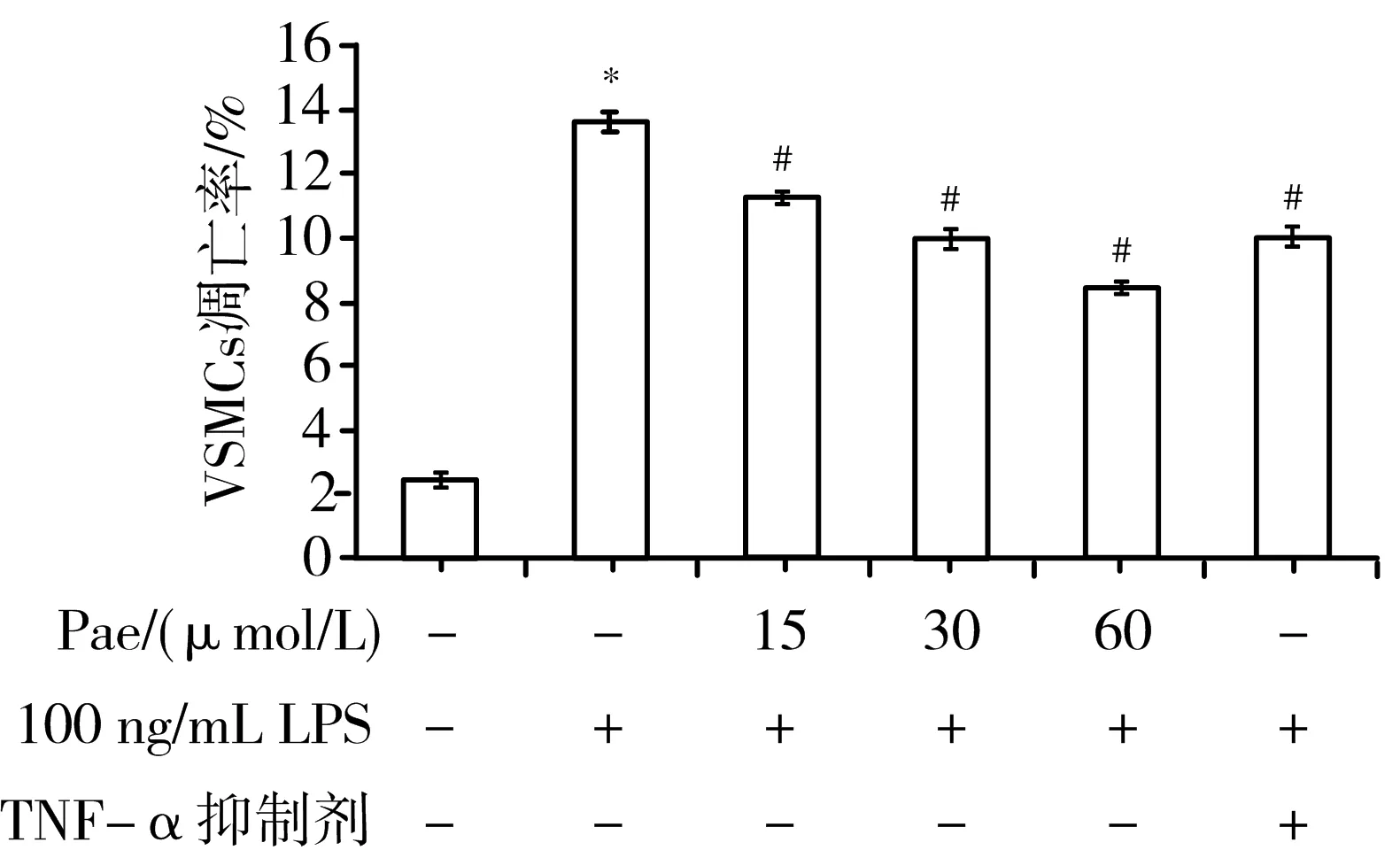
3.5 VECs与VSMCs共培养体系的建立 VSMCs单培养LPS组与正常对照组比较,VSMCs凋亡率显著上升(P<0.05);VECs-VSMCs共培养LPS组与VSMCs单培养LPS组比较,VSMCs凋亡显著上升(P<0.05);VSMCs单培养Pae组VSMCs凋亡率显著低于VSMCs单培养LPS组(P<0.05);VECs-VSMCs共培养Pae组VSMCs凋亡率显著低于VSMCs单培养Pae组(P<0.05)。见图5。说明VECs-VSMCs共培养时Pae对VSMCs凋亡的抑制作用比VSMCs单培养时更明显,证实Pae可能通过影响VECs而间接抑制VSMCs的凋亡,同时也验证共培养体系的建立成功,VECs与VSMCs之间存在相互作用。
注:与正常对照组比较,*P<0.05;与VSMCs单培养LPS组比较,#P<0.05;与VSMCs单培养Pae组比较,△P<0.05;A.正常对照组;B. VSMCs单培养LPS组;C. VECs-VSMCs共培养LPS组;D. VSMCs单培养Pae组;E. VECs-VSMCs共培养Pae组

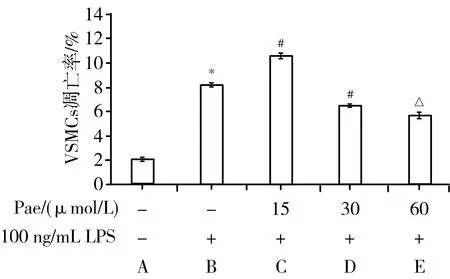
3.6 Pae抑制共培养体系中VSMCs p38 MAPK通路及凋亡效应蛋白表达 从图6A和6B中可见,LPS组与正常对照组比较,p-MKK3/6、p-p38、p53和活化的caspase-3蛋白水平显著增加(P<0.05),
说明LPS可以诱导共培养体系中VSMCs p38 MAPK信号通路和凋亡相关蛋白的激活。Pae作用后各蛋白水平显著降低(P<0.05),且呈现一定的浓度依赖性,说明Pae可以抑制LPS诱导的VSMCs p38 MAPK信号通路和凋亡相关蛋白的激活。TNF-α抑制剂组与LPS组比较,各蛋白水平均显著下降(P<0.05),说明共培养体系中TNF-α水平下降会导致VSMCs的凋亡减少。从图6C中可见,p38 MAPK通路抑制剂SB203580组与LPS组比较,凋亡相关蛋白p53和活化的caspase-3水平均显著下降(P<0.05),说明p38 MAPK通路抑制会导致VSMCs的凋亡减少。由此得出结论:Pae通过减少VECs中TNF-α的分泌,抑制与其共培养的VSMCs p38 MAPK信号通路,降低凋亡相关蛋白水平,最终抑制VSMCs凋亡。
4 讨论
VECs功能失调和损伤是AS形成的始动环节,LPS作为微生物感染的主要致病因素,在VECs损伤以及AS的病变形成中起重要作用。本实验中,正常的VECs在显微镜下为短梭形或多角形,大小均匀,胞核清晰,边界清晰,呈典型的单层铺路石样镶嵌排列。LPS刺激后,显微镜下可见细胞形态出现梭形改变,长宽比明显增加,变为成纤维细胞状,细胞皱缩,细胞内形成空泡,细胞间裂隙明显加宽,MTT结果显示细胞存活率显著降低;而预先给予Pae保护后,再加入LPS刺激VECs,显微镜下观察细胞形态未发生明显改变,并且细胞存活率与LPS组相比显著增加。有报道显示,LPS可以与细胞膜上的受体结合,诱导VECs释放多种细胞因子和炎性递质。在LPS损伤的人脐静脉内皮细胞中,ICAM-1水平上升,促使单核细胞聚集黏附并迁移至血管壁或血管外间隙,同时释放蛋白酶类和氧自由基,致使组织损伤[14]。本实验结果显示,LPS可以显著刺激VECs中TNF-α的分泌,而Pae能有效保护LPS所致的VECs炎性损伤。
注:与正常对照组[Pae(-)、LPS(-)、TNF-α抑制剂或SB203580(-)组]比较,*P<0.05;与LPS组[Pae(-)、LPS(+)、TNF-α抑制剂或SB203580(-)组]比较,#P<0.05;A. TNF-α抑制剂对p38 MAPK通路蛋白表达的影响及Pae的干预作用;B. TNF-α抑制剂对凋亡效应蛋白表达的影响及Pae的干预作用;C. p38 MAPK通路抑制剂对凋亡效应蛋白表达的影响及Pae的干预作用图6 Pae抑制VSMCs p38 MAPK通路及凋亡效应蛋白表达(x±s,n=3)
VSMCs是构成血管壁的重要组成成分,其凋亡的发生与AS的发生发展密切相关。VSMCs凋亡使粥样斑块中纤维帽细胞数量减少,间质胶原纤维合成减少,斑块稳定性下降,易发生破裂,导致心血管事件发生。在AS斑块处的VECs、巨噬细胞和T淋巴细胞由于炎性反应和免疫作用会产生各种炎性因子,诱导VSMCs凋亡[15]。本实验结果显示:LPS损伤的VECs将释放炎性因子TNF-α,加入TNF-α抑制剂以后,体系中TNF-α被结合,阻断了其与细胞表面TNF受体的结合,降低TNF-α活性,VSMCs的凋亡率便有显著下降,说明VSMCs凋亡与VECs释放的TNF-α密切相关。Pae预保护后,可以减少VECs分泌的TNF-α,从而使得VSMCs中凋亡相关蛋白表达减少,凋亡率下降。
为了最大程度地模拟体内细胞结构,观察VECs与VSMCs之间的相互作用,笔者采用膜孔径为0.4 μm的Transwell小室建立VECs与VSMCs共培养模型。有报道显示,共培养中VECs主要通过分泌各种细胞因子影响VSMCs的生长[16-17]。本实验在Transwell膜上室培养VSMCs,下室培养VECs,研究VECs分泌炎性因子TNF-α,对上室VSMCs凋亡的影响。从本实验结果可以看出,LPS作用后,VECs-VSMCs共培养中VSMCs的凋亡率显著高于单培养VSMCs;Pae作用后,VECs-VSMCs共培养中VSMCs的凋亡率明显低于单培养VSMCs,说明共培养体系建立成功,VECs与VSMCs间存在相互作用,影响VSMCs的凋亡。因此也证实Pae可以通过保护损伤的VECs,减少其释放TNF-α,间接抑制VSMCs的凋亡。
p38 MAPK信号通路是哺乳动物MAPK信号通路中一条经典途径,通过多级激酶的级联反应把细胞外信号向细胞内传递,在调控细胞凋亡方面发挥重要的作用。其级联反应需要3个关键激酶:MAPKKK,MAPKK(MKK3和MKK6)以及MAPK。因此本实验检测p-MKK3/6及p-p38蛋白的相对表达水平,以此来反映p38 MAPK信号通路的活性。激活p38 MAPK信号通路的因素有紫外线、促炎因子(TNF-α、IL-1)、缺血/再灌注、高渗环境、热损伤、LPS、抗肿瘤药物、生理应激等[18],这些因素通过激活MAPKKK,随后激活MKK3/6,最终使p38被激活[19]。p38 MAPK信号通路诱导下游蛋白p53活化,调节与凋亡相关的基因,引起细胞凋亡效应因子caspase-3发生结构变化,切割某些重要蛋白质,引起细胞凋亡。caspase-3是最重要的凋亡效应因子,是细胞凋亡发生的关键步骤及一切凋亡信号传导的共同通路蛋白[20]。正常状况下,caspase-3以无活性的procaspase-3形式存在,当细胞接受凋亡刺激时,它被剪切为cleaved caspase-3而变为活性形式,进而诱导细胞凋亡。本研究结果显示:Pae作用后,减少LPS诱导的VECs分泌TNF-α水平,VSMCs中p38 MAPK信号通路受到抑制,p-p53、cleaved caspase-3蛋白水平降低,VSMCs凋亡率明显降低。
综上所述,Pae减少VECs炎性分泌的作用将会影响VSMCs中p38 MAPK信号通路,最终抑制其凋亡。

