新藤黄酸对人胃癌SGC-7901细胞增殖抑制和诱导凋亡作用的研究
苏婧婧,侯 梅,李庆林,程 卉
(安徽中医药大学科研实验中心 新安医学教育部重点实验室,安徽 合肥 230038)
胃癌是临床常见的癌症之一[1],且发病率连续攀升,居恶性肿瘤第4位,病死率居恶性肿瘤第2位,是危害人类身体健康的重大疾病之一[2]。目前,胃癌的治疗主要依靠手术治疗、化学治疗及其他治疗。胃癌早期无明显症状,易被忽略,一般发现时已处于晚期[3-4],因此急需探索治疗胃癌的新方法[5]。
新藤黄酸(gambogenic acid,GNA)作为中药藤黄的活性成分之一,具有抗癌谱广、毒性低等特点。近年来,本课题组对GNA的抗肿瘤作用进行了一系列研究,研究表明GNA对多种肿瘤增殖有良好的抑制作用,如人胶质瘤细胞U251、非小细胞肺癌细胞A549、人鼻咽癌细胞CNE-1、人结肠癌细胞HCT-8、人肝癌细胞HepG-2[6-12],而人胃癌SGC-7901细胞对GNA的敏感性尚未见报道,故笔者就此展开研究。
1 材料与方法
1.1 材料 GNA(纯度99.0%,批号 20170503):安徽中医药大学药学院自制;抗体β-actin、p53和Caspase-9:美国CST公司;胎牛血清(fetal bovine saline,FBS):美国Gibco公司;ECL发光试剂盒:美国Thermo公司;Western blot试剂盒、BCA蛋白浓度测定试剂盒(批号 041718160925):碧云天生物技术公司。
1.2 细胞培养 胃癌SGC-7901细胞:中国科学院上海生命科学研究院细胞资源中心,细胞在含10% FBS的DMEM培养液中培养。并于5% CO2、 37 ℃的恒温恒湿培养箱中培养,待密度长至60%~70%,进行后续实验。
1.3 细胞形态变化 将SGC-7901细胞制备成单细胞悬液,调整细胞数至1×106/mL,接种于6孔板。待细胞完全贴壁,加入含GNA(1.0、2.0、4.0、8.0、16.0 μmol/L)的培养基,空白对照组(0 μmol/L GNA)为含10% FBS的完全培养基培养等量细胞,在条件培养箱中培养24 h后观察并拍照。
1.4 MTT实验 将SGC-7901单细胞悬液接种于96孔板,每孔180 μL(每孔1×104细胞),待细胞完全贴壁,加入含GNA(0.5、1.0、2.0、4.0、8.0、16.0、32.0 μmol/L)的新鲜培养基,阴性对照组为含与实验组等量细胞的细胞悬液,条件培养箱中培养24 h后,按照试剂盒的要求,配制5 mg/mL的MTT母液,每孔加入20 μL MTT后,于细胞培养箱继续孵育4 h,每孔加入150 μL DMSO,适当混匀,37 ℃培养箱再继续孵育4 h,待紫色结晶物完全溶解,采用多功能全波长酶标仪于570 nm处测定光密度(optical density, OD)。细胞存活率=处理组OD值/空白对照组OD值×100%。
1.5 流式细胞术检测SGC-7901细胞凋亡率 将SGC-7901单细胞悬液接种于6孔板,待细胞完全贴壁,加入含GNA(2.0、4.0、8.0 μmol/L)的新鲜培养基后继续培养。作用24 h后,用0.25%胰酶消化细胞(不含EDTA),细胞浓度调整为(0.5~1.0)×106/mL,1 000 r/min离心5 min,弃上清,收集细胞,PBS轻轻重悬,洗涤离心2次,1 000 r/min离心5 min,弃上清。加入195 μL Annexin Ⅴ-FITC结合液混匀,先后加入5 μL Annexin Ⅴ-FITC和10 μL PI染液轻轻混匀。室温避光孵育10~20 min,上流式细胞仪,检测凋亡率。
1.6 Western blot检测凋亡相关蛋白变化 收集总蛋白样品,为确保上样量一致,使用BCA蛋白浓度测定试剂盒。收集的蛋白样品加入5×SDS-PAGE蛋白上样缓冲液,沸水浴5 min,充分变性。冷却到室温,上层10%~15%分离胶使用40~60 V恒压电泳,溴酚蓝进入下层5%浓缩胶时使用120 V恒压电泳,目的蛋白适当分离后停止电泳。使用恒定电流200 mA电泳蛋白1.5~2 h,4 ℃转膜槽放置在冰浴中,转移至硝酸纤维素膜。水平摇床1% BSA室温封闭1 h,回收封闭液,Western洗涤液(PBST)洗涤,加入适合比例的一抗工作液,4 ℃水平摇床孵育过夜。回收一抗,加入PBST洗涤液,水平摇床洗涤3次,每次10 min。辣根过氧化物酶标记的二抗稀释液室温孵育2 h,回收二抗,加入PBST洗涤液,水平摇床洗涤3次,每次10 min。采用ECL发光试剂盒(自行配置显色液)检测蛋白表达水平,Protein Simple Alpha凝胶成像系统记录图片并分析。

2 结果
2.1 GNA对SGC-7901细胞生长的抑制作用 MTT法检测结果表明,1.0~32.0 μmol/L GNA处理SGC-7901细胞24 h后,与对照组(0 μmol/L GNA)比较,细胞存活率显著降低,差异有统计学意义(P<0.05)。GNA作用SGC-7901细胞24 h后IC50为4.673 μmol/L。见图1。
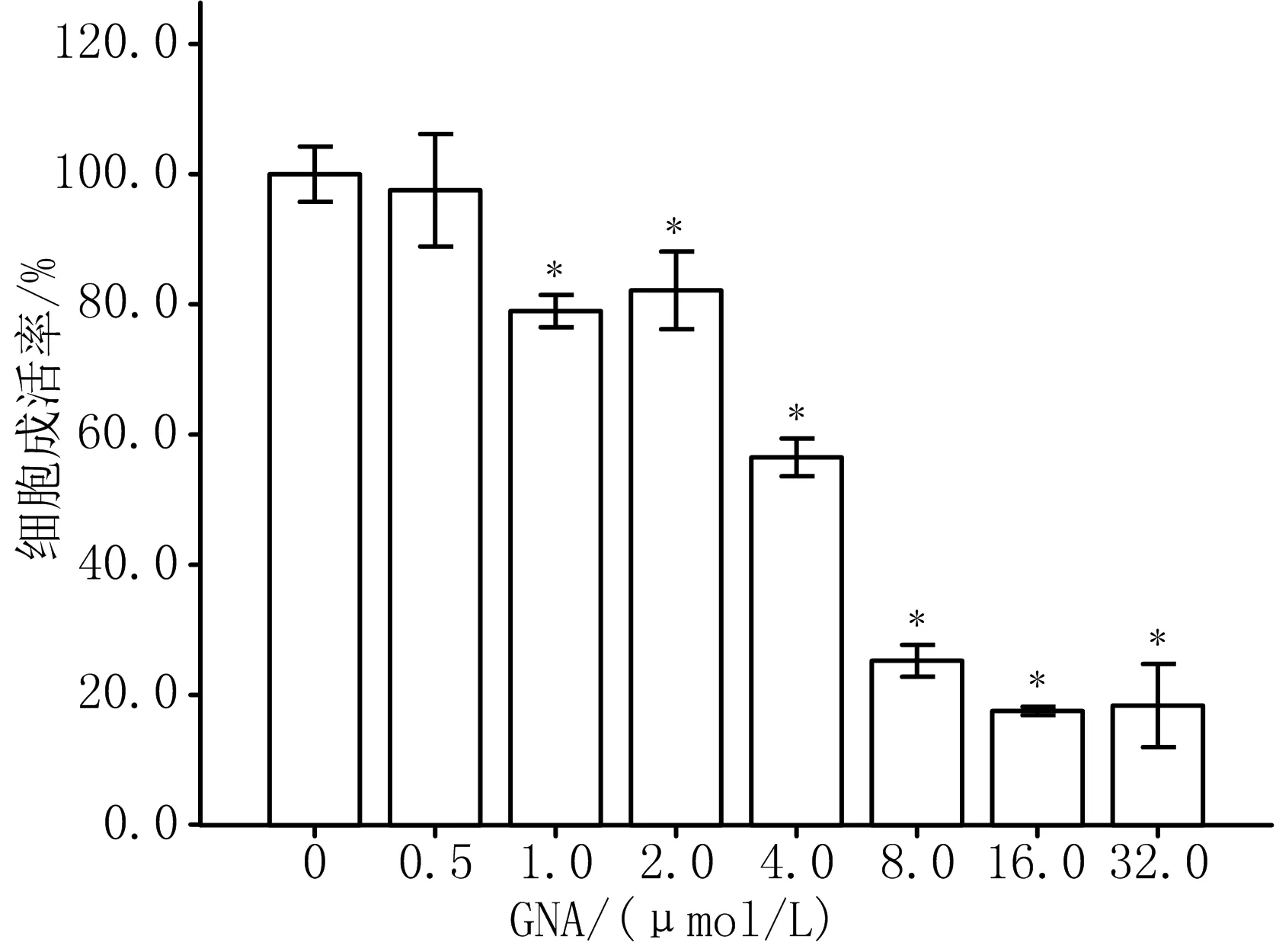
注:与0 μmol/L GNA组比较,*P<0.05
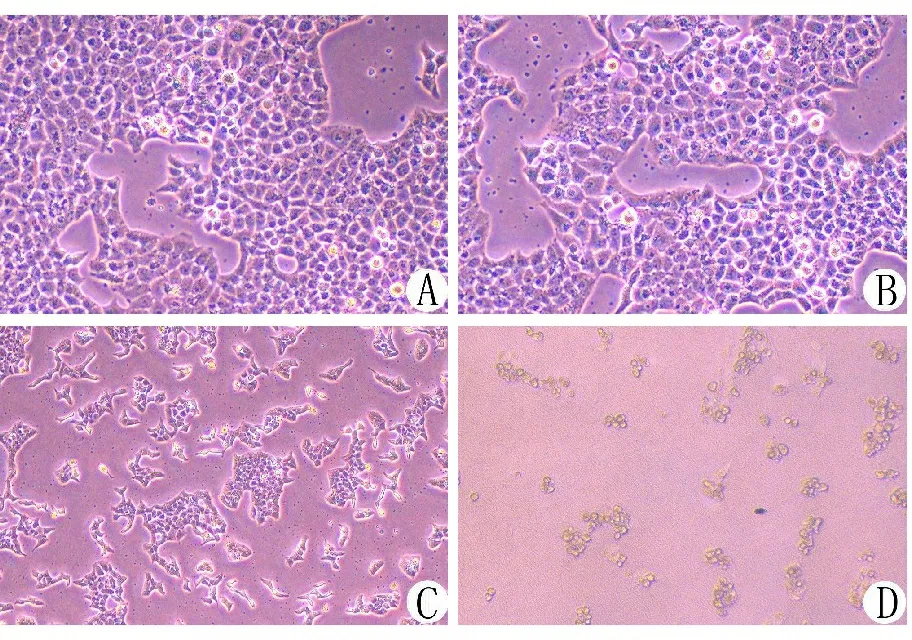
2.2 GNA对SGC-7901细胞形态的影响 不同浓度GNA作用24 h后,倒置显微镜下观察SGC-7901细胞形态。2.0、4.0 μmol/L GNA组细胞部分体积变小,皱缩变圆,少量细胞呈半贴壁悬浮状态。随着GNA浓度的增加,悬浮于培养液中的脱落细胞增多。见图2。
2.3 GNA对SGC-7901细胞凋亡率的影响 不同浓度GNA作用24 h后,均能诱导细胞发生凋亡,与对照组比较,各给药组凋亡率增加,且随着GNA浓度的增加,细胞的凋亡率逐渐增加。见图3。
注:A. 0 μmol/L GNA组;B.2.0 μmol/L GNA组;C. 4.0 μmol/L GNA组;D. 8.0 μmol/L GNA组
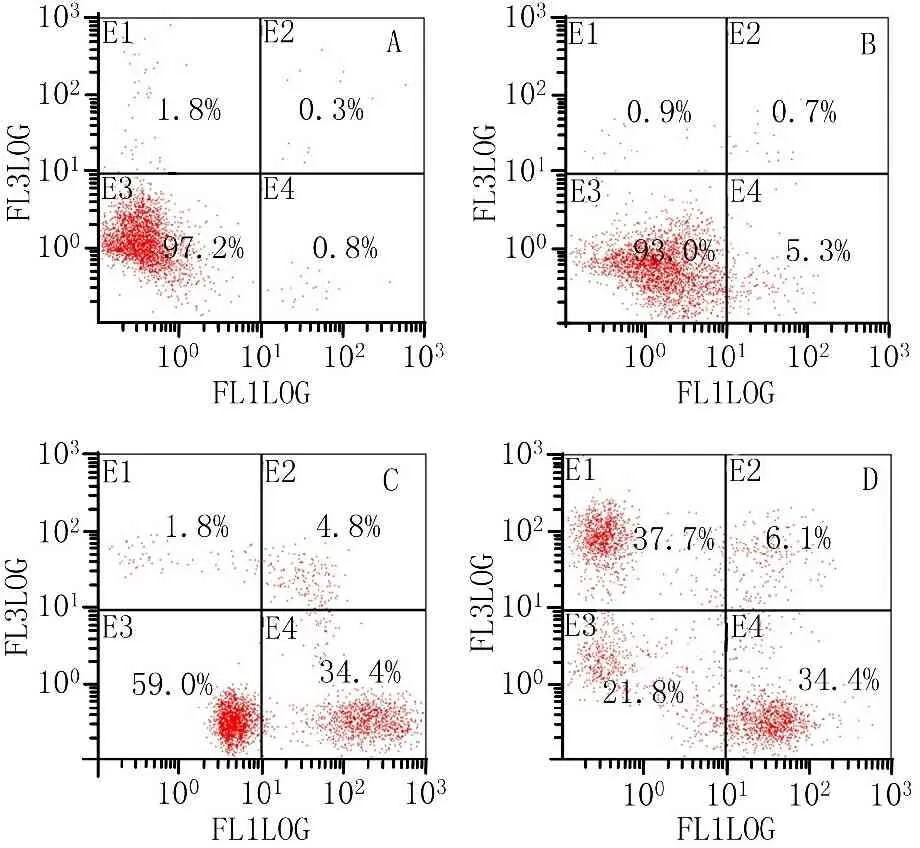
图2 倒置显微镜下观察GNA对SGC-7901细胞形态的影响(10×10倍)
注:A. 0 μmol/L GNA组;B. 2.0 μmol/L GNA组;C. 4.0 μmol/L GNA组;D. 8.0 μmol/L GNA组
图3 GNA对SGC-7901细胞凋亡的影响
2.4 GNA对SGC-7901细胞内p53和Caspase-9表达水平的影响 不同浓度GNA作用SGC-7901细胞24 h后,与0 μmol/L GNA组比较,4.0、8.0 μmol/L GNA组SGC-7901细胞内p53和Caspase-9蛋白表达显著上调(P<0.05),且随着GNA浓度的增加蛋白表达水平逐渐增加。见图4。
3 讨论
本研究观察一定浓度梯度(1.0、2.0、4.0、8.0、16.0、32.0 μmol/L)GNA作用24 h对人胃癌SGC-7901细胞增殖和凋亡的影响。MTT结果表明,GNA对胃癌SGC-7901细胞增殖有抑制作用,且具有浓度依赖性。
流式细胞仪检测发现,与空白对照组(0 μmol/L GNA组)相比,不同浓度GNA处理胃癌SGC-7901细胞24 h后,细胞凋亡率会随着GNA浓度的增加而上升,2.0 μmol/L组细胞凋亡率变化不明显;与空白对照组相比,4.0、8.0 μmol/L组的细胞凋亡率明显增加。
Western blotting实验表明,与空白对照组相比,不同浓度GNA处理胃癌SGC-7901细胞24 h后,p53和Cleaved Caspase-9蛋白表达水平会随着GNA浓度的增加而上调,2.0 μmol/L组p53蛋白表达水平变化不明显;与空白对照组相比,4.0、8.0 μmol/L组p53蛋白表达水平明显上调。与空白对照组相比,GNA组Cleaved Caspase-9蛋白表达水平均有明显升高。
细胞凋亡涉及细胞形态和生化特征的变化,如细胞体积缩小,核固缩,DNA片段化和凋亡小体的形成。p53基因作为肿瘤抑制基因,参与细胞周期的调控,介导细胞凋亡的发生,Caspase-9作为一种半胱氨酸蛋白酶,参与细胞凋亡的起始。有报道表明细胞凋亡的异常是癌症发生的重要指标之一[13],诱导细胞凋亡可用于肿瘤的治疗,许多抗肿瘤药物均能引起肿瘤细胞凋亡。
本研究发现,GNA能抑制人胃癌SGC-7901细胞生长和增殖,其机制与GNA诱导细胞凋亡有关。通过本研究以期能为GNA抗肿瘤机制的进一步研究提供实验依据,也为GNA开发为临床抗肿瘤药物提供实验基础。
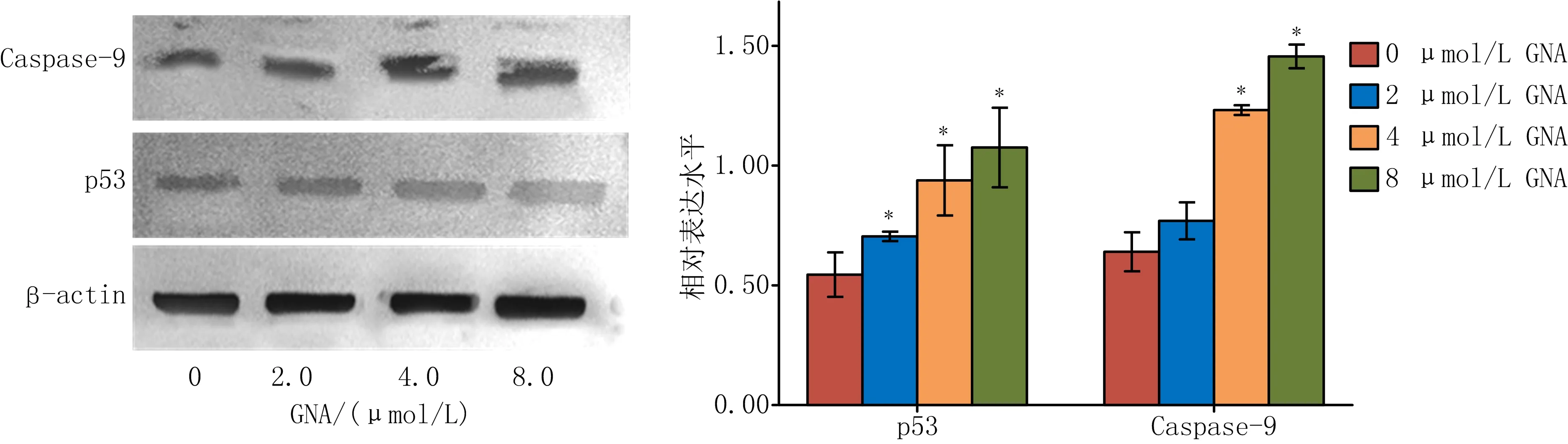
注:与0 μmol/L GNA组比较,*P<0.05

