基于近红外上转换纳米探针的固相免疫检测研究
周 进,张美玲,张 俐,李翠霞,赵慧颖,张友林,夏安东,孔祥贵*
(1.发光学及应用国家重点实验室中国科学院长春光学精密机械与物理研究所,吉林长春 130033;2.中国科学院大学,北京 100049; 3.吉林大学,长春 130012; 4.中国科学院化学研究所,北京 100190)
1 引 言
血液免疫检测是医学临床疾病诊断的重要手段[1]。在各种血液免疫检测方法中,荧光标记物为基础的光学免疫检测由于其检测方法相对简单并且具有较高的灵敏度在临床疾病诊断及监测中得到了广泛的应用[2-3]。目前普遍应用的荧光标志物的激发光均为紫外或可见光,血液中检测时,会激发血液产生荧光背景,湮灭探针的荧光信号[4]。因此,目前临床应用的光学检测技术,都必须预先进行血清/血浆分离,而多次的分离及清洗过程不可避免地会对待测生物分子的结构或构象造成破坏,从而对检测的准确性造成影响,导致错误的治疗方案,后果极其严重。
基于此,找到一种可以克服上述缺点的新的荧光标记材料显得尤为重要。稀土元素掺杂的上转换纳米粒子(UCNPs,例如 NaYF4∶Yb,Er/Tm)能够吸收红外光(980 nm)替代以往的紫外和可见光激发,通过多光子吸收过程将近红外光子上转换到可见光/近红外区域[5]。由于生物分子本身对近红外光吸收较弱,这种低能量的非入侵式激发会将对生物样品的光损伤降到很小,同时也意味着背景荧光和杂散光的信号极其微弱。另外,由于稀土离子(例如Er3+、Tm3+和Yb3+)的4f电子受到最外层5s电子屏蔽作用,其发光性质受环境变化的影响很小,具有发射谱线窄、光学性质稳定、荧光寿命长、生物毒性低、光谱峰位随掺杂稀土离子变化可调等特点[6-10],在细胞及生物体成像[11]、核酸分子检测[12]以及光动力学治疗方面[13]都得到了广泛的应用。尤其最近,UCNPs作为一种新型的荧光标记材料已经成为研究的热点。如何发展基于UCNPs的高特异性、高灵敏度固相免疫载体成为科学研究及应用方面亟待解决的问题。
在本文中,我们选择 NaYF4∶Yb3+,Tm3+上转换发光纳米粒子作为标记物,其激发(980 nm)和发射(800 nm)波段均位于生物窗口内,可以有效避免生物荧光背景的产生。进一步,利用这种近红外发光探针及生物功能化修饰的硅片构筑双抗体发光免疫夹心检测体系。首先,以共价偶联的方式把human IgG修饰到聚丙烯酸包覆的UCNPs的表面,作为发光探针(H端);特别地,为了提高r-a-g IgG分子活性以及控制其活性端的取向,我们创新性地引入protein G作“桥”将r-a-g IgG修饰在硅片表面(R端)。当把修饰好的硅片植入含有g-a-h IgG检测溶液中时,利用抗原抗体的特异性结合反应,会将UCNPs连接到硅片上。通过测量硅片上的上转换发光,从而实现g-a-h IgG的高特异性、高灵敏的检测。
2 实 验
2.1 实验材料与仪器
实验中使用的试剂如下:YCl3·6H2O(99.9%)、YbCl3·6H2O(99.99%)、TmCl3·6H2O(99.99%)、油酸(90%)、1-十八烯 (90%)、PAA 等材料购自 Sigma-Aldrich。戊二醛、human IgG、r-a-g IgG、g-a-h IgG和兔抗鼠IgG(r-a-m IgG)购自北京鼎国生物试剂公司,均为分析纯或化学纯级别。
实验中使用的仪器如下:台式离心机(型号为GT10-1);980 nm半导体二极管激光器;X射线衍射仪(Bruker D8-advance);纳米粒径电位分析仪(Nano-ZS Zetasizer ZEN3600);原子力显微镜(Bruker Multimode 8);日立F-4500荧光光谱仪。
2.2 NaYF4∶24.7%Yb3+,0.3%Tm3+上转换纳米粒子的合成
将 0.75 mmol的 YCl3、0.247 mmol的 YbCl3、0.003 mmol的TmCl3粉末和6 mL油酸、15 mL的1-十八烯依次加入到100 mL的三颈瓶中,通氩气并搅拌,缓慢升温到160℃。稀土氯化物完全溶解后,降温到30℃,加入含100 mg NaOH和148 mg NH4F的甲醇溶液。将体系升温到70℃,保持50 min以完全除去溶液中的甲醇。缓慢升温至300℃(10℃/min),反应1.5 h后降温至30℃,得到的溶液用丙酮进行沉化,离心3遍后分散在8 mL环己烷中备用。
2.3 上转换纳米粒子表面修饰human IgG
将上述制备的溶液8 mL(含有160 mg UCNPs)加入8 mL HCl溶液(0.1 mol/L)中,振荡12 h,抽取下层盐酸溶液离心2次(11 500 r/min离心20 min)。然后加入1 mL PAA溶液(质量分数2.5%,pH值用5 mol/L的NaOH调至9),超声3 min溶解后室温振荡过夜,离心后得到PAA修饰的UCNPs(UCNPs-PAA),在 PBS中具有良好的分散性。将 EDC(4 mmol/L)和NHS(10 mmol/L)加入2 mL PBS溶液中(5 mg PAA-UCNPs)活化羧基,再加入0.5 mg human IgG,室温振荡2 h后离心,得到human IgG修饰的UCNPs(UCNPs-PAA-h-IgG)。
2.4 固相载体表面修饰r-a-g IgG
依次用丙酮、三氯乙烯和乙醇等清洗硅片,加入浓盐酸和甲醇混合液(V∶V=1∶1),反应30 min,干燥后加入过氧化氢和浓硫酸混合液(V∶V=3∶7)进行羟基化,缓慢油浴升温至80℃,反应2 h,冲洗烘干。再分别用10%的APTES乙醇溶液和5%的戊二醛甲醇溶液(加入0.1%质量分数的氰基硼氢化钠)进行氨基和醛基化修饰,清洗后置入0.1 mg/mL的protein G溶液中,4℃过夜。然后加入0.2 mg/mL r-a-g IgG,4℃下反应12 h后加入1%的BSA封闭未结合位点,反应2 h,得到r-a-g IgG修饰的硅片。
2.5 缓冲液中g-a-h IgG的定量免疫检测
将g-a-h IgG加入UCNPs-PAA-h-IgG溶液,最终浓度分别为 5,10,20,50,100,200,300,400,500,600 nmol/L。将r-a-g IgG修饰的硅片插入400 nmol/L的溶液中,每隔10 min测一次980 nm激发下硅片的上转换发光光谱(即10,20,30,40 min),直到发光强度饱和,以此确定最佳检测时间。然后将功能化硅片插入上述不同浓度的g-a-h IgG溶液,充分反应后测量硅片的上转换发光光谱,每个浓度均进行5次独立实验以保证结果准确性。
2.6 免疫检测的特异性研究
按照上述方法分别配制2 mg/mL的rabbit IgG溶液、2 mg/mL的r-a-m IgG溶液和20 mg/mL的BSA溶液,将功能化硅片分别插入,测量反应后的上转换发光光谱。
3 结果与讨论
3.1 上转换纳米粒子的表征
本实验中,我们以氯化物为原料通过溶剂热法合成了尺寸均匀的NaYF4∶Yb3+,Tm3+上转换纳米粒子。图1(a)给出了UCNPs的扫描电镜图像,其显示纳米粒子尺寸分布为(23±1)nm。由此获得尺寸均匀的纳米颗粒为后续荧光标记免疫检测的重复性和精确性奠定了良好的材料基础。
样品的X射线衍射(XRD)图如图1(b)所示,其X衍射峰位置与标准卡片 JCPDS No.16-0334相一致,表明合成的样品是纯六角相,由于六角相UCNPs的发光效率比立方相高近一个数量级,这为后续的高灵敏检测提供了条件。

图1 (a)NaYF4∶Yb3+,Tm3+上转换纳米粒子的扫描电镜照片;(b)NaYF4∶Yb3+,Tm3+上转换纳米粒子的XRD衍射图。Fig.1 SEM image(a)and XRD pattern(b)of NaYF4∶Yb3+,Tm3+UCNPs
3.2 上转换纳米粒子与human IgG蛋白偶联(H端)
我们利用去配体法将UCNPs从油相转移为水相,并且通过PAA引入了可以进一步生物功能化修饰的活性基团——羧基,和human IgG表面的氨基进行偶联。
我们通过动态光散射技术(DLS)对其进行表征,DLS是通过测量散射颗粒产生的微小频移及其角度依赖性来获取粒子的尺寸分布,广泛应用于纳米粒子表面修饰的表征。由于DLS测得的结果是流体动力学直径,并不是粒子的真实直径,在粒子表面基团的作用下,测得的粒子尺寸比SEM测得的要大,但是仍可以用来定性表征粒子的尺寸变化[14]。图2是UCNPs-PAA和UCNPs-PAA-h-IgG的DLS粒径分布图,显示偶联human IgG后,粒子流体动力学直径由90 nm增大至290 nm,说明 human IgG已经成功偶联在 UCNPs表面[15]。

图2 (a)PAA修饰的的NaYF4∶Yb3+,Tm3+上转换纳米粒子的DLS粒径分布图;(b)在 (a)基础上继续偶联human IgG的上转换纳米粒子的DLS粒径分布图。Fig.2 Particle size distribution image of UCNPs-PAA(a)and UCNPs-PAA-h-IgG(b)by DLS
3.3 硅片上修饰r-a-g IgG蛋白(R端)
同时,我们利用 Protein G作“桥”,将 r-a-g IgG修饰在硅片表面,以此提高r-a-g IgG分子活性以及控制其活性端的取向。由于原子力显微镜(AFM)具有原子级的高分辨率,我们利用AFM对硅片表面抗体偶联进行了表征。经过多步清洗过程,我们排除了物理性吸附的分子对结果的影响。硅片表面平整度约为1~2 nm(图3(a)),连接protein G后高度约为4~6 nm(图3(b)),说明在硅片上成功修饰上protein G。在此基础上继续修饰r-a-g IgG,高度约为15~17 nm(图3(c))。考虑protein G、r-a-g IgG的高度分别约为3 nm和14 nm,表征结果略小于该高度,这可能是由于测试过程中探针针端的压力引起的。由于protein G特异性结合抗体的Fc区域(Fab区域为抗体抗原结合位点),实现了硅片和抗体的“柔性偶联”,为后续检测的高灵敏度提供了有力保障。

图3 (a)硅片表面的原子力显微镜成像图;(b)硅片表面修饰protein G的原子力显微镜成像图;(c)在(b)基础上继续修饰r-a-g IgG的原子力显微镜成像图。Fig.3 AFM images of the silicon wafer surface(a),silicon wafer surface modified with protein G(b);silicon wafer surface modified with protein G and r-a-g IgG(c),respectively.
3.4 检测物g-a-h IgG的定量检测
我们对缓冲液中的g-a-h IgG进行了定量检测分析,游离g-a-h IgG先和上转换表面的human IgG(H端)结合,将功能化硅片插入到g-a-h IgG溶液中后,硅片表面的r-a-g IgG(R端)通过g-a-h IgG和H端相结合,在980 nm激光的激发下,可以从硅片表面上测得UCNPs的发光,最后通过800 nm发光强度来定量计算检测物g-a-h IgG蛋白的浓度,结果如图4所示。首先,我们讨论了不同检测反应时间对检测结果的影响。图4(a)及(b)给出了g-a-h IgG浓度为400 nmol/L时,经过不同反应时间后,硅片表面的上转换发光增强情况。随着反应时间的延长,越来越多的上转换纳米粒子被结合到硅片表面,引起上转换发光的持续增强,当反应时间达到30 min后,上转换的发光增强达到饱和,此后随着反应时间的延长,上转换发光几乎不再变化。因此我们采用30 min作为后续检测反应时间。

图4 (a)功能化硅片在g-a-h IgG溶液中反应不同时间的上转换发光光谱(400 nmol/L);(b)功能化硅片在g-a-h IgG溶液中反应不同时间的发光强度变化(400 nmol/L,800 nm);(c)不同浓度g-a-h IgG检测的荧光光谱(30 min);(d)荧光强度与g-a-h IgG浓度的关系图(30 min,800 nm)。Fig.4 (a)Upconversion luminescence spectra of the bio-functional substrate at different reaction time in buffer(400 nmol/L).(b)Fluorescence intensity on reaction time with the concentration of g-a-h IgG of 400 nmol/L(at 800 nm).(c)Upconversion luminescence spectra of the bio-functional silicon wafer with increasing g-a-h IgG concentrations(30 min).(d)Relationship between the fluorescence intensity at 800 nm and the concentration of g-a-h IgG(30 min).
我们进一步研究了这种方法的线性检测范围。图4(c)和(d)给出了不同浓度g-a-h IgG下,功能化硅片的上转换发光增强情况。随着溶液中g-a-h IgG浓度的增加,硅片表面连接的上转换纳米粒子增多,荧光强度越来越大,当g-a-h IgG浓度达到400 nmol/L时,发光达到饱和,此后g-a-h IgG浓度增加,上转换光强几乎不再发生变化。在5~400 nmol/L的浓度范围内,上转换发光强度和IgG浓度呈现出良好的线性关系,相关系数达0.993。根据3σ IUPAC标准计算得出该检测系统的检测限为1.82 nmol/L。
3.5 固相生物传感器的特异性研究
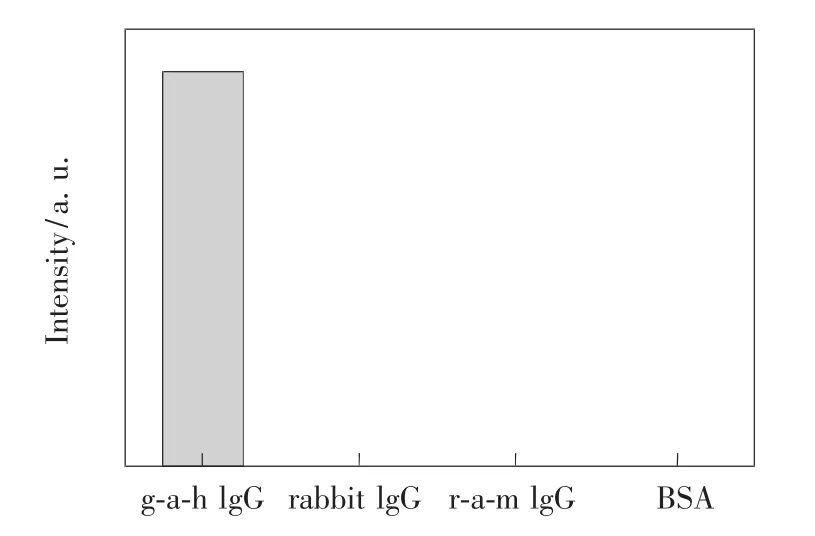
图5 固相生物传感器用于不同分析物检测的上转换荧光强度,由左至右依次为 g-a-h IgG(0.1 mg/mL)、rabbit IgG(2 mg/mL)、r-a-m IgG(2 mg/mL)和BSA(20 mg/mL)。Fig.5 Upconversion luminescence intensity of the bio-functional substrate in the presence of different analytes.From left to right:g-a-h IgG(0.1 mg/mL),rabbit IgG(2 mg/mL),r-a-m IgG(2 mg/mL),and BSA(20 mg/mL),respectively.
为了评价构建的固相生物传感器检测蛋白的特异性,我们用上述方法对g-a-h IgG(0.1 mg/mL)、rabbit IgG(2 mg/mL)、r-a-m IgG(2 mg/mL)和BSA蛋白(20 mg/mL)溶液分别进行检测,反应30 min后,将硅片用PBS缓冲液冲洗3次,检测上转换发光,结果如图5所示。在980 nm激光的激发下,对于有特异性结合g-a-h IgG蛋白的检测,硅片上可以看到有明显的上转换发光,而其他3个硅片上几乎没有发光。上述结果表明这种夹心结构的生物传感器具有良好的特异性。
4 结 论
采用溶剂热法合成了尺寸均匀的NaYF4∶Yb3+,Tm3+上转换纳米粒子,基于这种激发和发射均位于近红外区域的发光探针构建了固相生物传感器,通过双抗体夹心免疫反应,实现了对溶液中IgG的检测。该系统检测限为1.82 nmol/L,并实现了5~400 nmol/L的宽范围检测,同时表现出了优秀的检测特异性。这一工作有望用于多种抗原抗体和DNA,为血液中疾病相关生物分子的快速灵敏检测提供了一个具有广阔前景的方法和平台。

