掺氮碳量子点的微波法制备及其光学性能研究
蒋雪薇 ,叶 菁,许延涛,宁静恒,2,3,罗晓明,吕变梅,李赤翎,2*
(1.长沙理工大学化学与生物工程学院,湖南长沙 410114; 2.湖南省调味品发酵工程技术研究中心,湖南长沙 410600;3.湖南省水生资源食品加工工程技术研究中心,湖南长沙 410114)
1 引 言
近年来,食品安全已经成为全民关注的热点,其中微生物污染导致的食品质量安全问题显得尤为突出,因此建立安全快速的检测方法十分迫切。目前常用的微生物快速检测方法有PCR法、免疫法、生物传感器法等[1-2],其中以量子点为荧光探针的快速检测技术具有特异性强、检出限低、操作简单等优点[3-4]。量子点(Quantum dots,QDs)材料是决定荧光检测技术灵敏度的重要因素,传统的半导体量子点已经被广泛应用,而其具有的生物毒性限制了其在食品微生物检测领域的应用[5]。相较于半导体量子点,碳量子点(Carbon quantum dots,CQDs)具有制备简单、价格低廉,拥有良好的光学性能、稳定性与抗光漂白性等优点[6-7],此外,低细胞毒性、高生物相容性也使其在食品质量安全检测中的应用日益受到重视[8]。Qu等[9]将以柠檬酸和尿素为碳源合成的CQDs水溶液来培育豆芽,研究结果表明CQDs具有较低的毒性和较好的生物相容性。Liu等[10]研究发现,CQDs对土壤中的微生物群落的结构、功能和多样性影响较小,在生物检测方面具有巨大的应用潜力。虽然CQDs具有很多优于半导体量子点的性能,但其产率普遍低于核壳结构的量子点。为解决这一问题,学者们进行了CQDs元素掺杂研究,结果表明元素掺杂不仅可以有效地提高产率,同时还能改良CQD的光学性能[11-12]。氮(N)是一种优良的化学掺杂元素,Niu等[13]仅以谷氨酸作为前体,采用水热法合成氮掺杂碳点(N-CQDs),合成的N-CQDs表现出优异的光学特征及独特的荧光特性,证明了它们在生物成像中的潜在应用价值。
量子点的制备主要有电化学法、化学氧化法、水热法等[14]。随着研究的不断深入,CQDs的制备方法越来越简单,原料也越来越廉价。微波消解法因其工艺简单、合成时间短、设备要求低而深受国内外科研工作者的青睐[15],但该方法制备的CQDs粒径分布不均匀,可控性较差,因此需要进一步优化原材料与制备条件[16]。本研究以柠檬酸、谷氨酸为原料,采用简便的微波法合成修饰一步得到N-CQDs,探索优化制备条件以获得光学性能好、生物亲和性佳的荧光量子点,为其在食品微生物检测的应用奠定基础。
2 实 验
2.1 材料与仪器
透析袋(分子量7 000)购于北京索莱宝科技有限公司;柠檬酸、L-谷氨酸、聚乙二醇(PEG,4 000)购于上海国药集团化学试剂有限公司。
实验用到的主要仪器有NJL07-3型实验专用微波反应器(南京杰金微波设备有限公司)、CS-45型荧光分光光度计(美国PE公司)、Avatar-360型红外光谱仪(美国尼高力仪器有限公司)、UV-1800型紫外分光光度计(日本岛津公司)、JEM-3010型透射电子显微镜(日本精工JEOL公司)、Starter3C型pH计(美国奥豪斯仪器有限公司)。
2.2 N-CQDs的微波法制备及优化
2.2.1 反应时间对荧光强度的影响
将80 mg/mL柠檬酸、12 mg/mL谷氨酸、80 mg/mL PEG混合均匀,加热搅拌溶解至澄清,置于800 W 微波反应器中分别反应2,2.5,3,3.5,4 min。待反应完成后放于冷水中快速冷却,再用蒸馏水洗脱,经透析提纯后在340 nm激发波长下测荧光发射光谱。
2.2.2 反应功率对荧光强度的影响
在确定最佳反应时间的基础上,参照上述方法制备N-CQDs,微波反应功率分别为600,700,800,900,1 000 W。
2.2.3 原料浓度对荧光强度影响
确定最佳反应时间和反应功率后,在预备实验的基础上,采取L9(34)正交设计对反应原料用量进行优化,因素水平如表1所示。

表1 正交试验因素水平表Tab.1 Factors and levels in the orthogonal design
2.2.4 pH对荧光强度的影响
优化上述因素后,取1 mL制备好的N-CQDs稀释液于10 mL容量瓶中,用NaOH和HCl调节pH 值为 3,4,5,6,7,8,9,10,11,12 左右,然后用蒸馏水定容,待测定完荧光强度后再测量其pH值。
2.3 N-CQDs光学性能研究
采用透射电子显微镜、紫外分光光度计、荧光分光光度计以及红外光谱仪进行N-CQDs光学性能研究。
3 结果与讨论
3.1 影响量子点荧光强度的因素分析
3.1.1 反应时间对荧光强度的影响
荧光特性是N-CQDs最突出的性质,关于其发光机理的解释主要有量子域效应[17]、发射陷阱机理[18],可见量子点的尺寸及表面基团是影响荧光性质的关键性因素。微波法制备N-CQDs时,粒径大小与反应时间长短有关,因此反应时间是影响其荧光强度的主要因素之一。对5个不同的反应时间进行考察,在340 nm激发波下的荧光发射光谱如图1所示。由图1可知,荧光强度随反应时间的延长先增大后减小,反应时间为3.5 min时荧光强度最大。N-CQDs的制备是一系列反应依次进行的过程,原料通过水解、聚合、碳化以及包裹等反应过程最后形成荧光粒子。因此,在一定范围内延长反应时间,有利于反应的有效进行,增大粒径,从而增大荧光强度。而反应时间过长时,由于PEG的分散作用而产生了消耗,导致先合成的N-CQDs间容易发生聚合,产生相互自猝灭现象,从而出现荧光强度降低[19]。此外,从图1中还可以看出,随着反应时间的增加,发射波长发生红移,这是由于N-CQDs粒径随反应时间在增大,符合量子化尺寸效应。

图1 反应时间对N-CQDs荧光强度的影响Fig.1 Fluorescence spectra of N-CQDs nanoparticles at different reaction time
3.1.2 反应功率对荧光强度的影响
反应功率也是影响N-CQDs粒径大小的重要因素,优化微波功率能够制备尺寸可控、分布均一的量子点。在6个不同功率下反应3.5 min制备N-CQDs,其荧光发射波长结果如图2所示。在600~800 W间,随着反应功率的增大,N-CQDs的荧光强度逐渐增大,同时荧光峰位置逐步红移。其原因可能是增大反应功率,能够加快原料水解,促进N-CQDs的形成。而反应功率为800~1 000 W时,N-CQDs的荧光强度与反应功率成反比,发射波长从429 nm蓝移至411 nm。究其原因是反应功率过大时,原料碳化严重,不利于N-CQDs的生成,因此出现荧光强度降低且发射波长蓝移现象。反应功率800 W时,荧光强度最高,因此选定800 W为最佳反应功率。
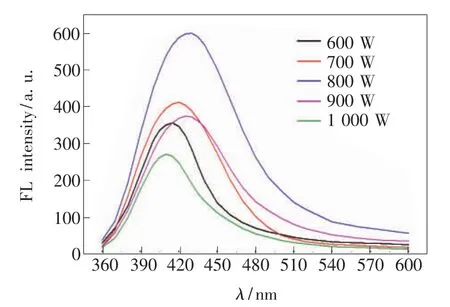
图2 反应功率对N-CQDs荧光强度的影响Fig.2 Fluorescence spectra of N-CQDs nanoparticles at different reaction power
3.1.3 反应浓度对荧光强度的影响
PEG在微波制备CQDs体系中起分散作用,同时由于其含有大量的羟基等基团,因此也具有表面钝化作用[19]。N元素的掺杂能够调节碳环结构,加快分子内的电子转移速率,进而有效地改善CQDs的荧光性能[20]。优化原料与分散剂的配比对制备荧光性能好的N-CQDs具有重要意义。在反应时间为3.5 min、反应功率为800 W的条件下,以柠檬酸、谷氨酸、PEG的添加量进行正交试验,实验方案及结果见表2。由极差分析可以看出,原料配比影响荧光强度的因素顺序为:C(柠檬酸)﹥B(谷氨酸)﹥D(空白)﹥A(柠檬酸)。其中,出现D(空白)﹥A(柠檬酸)有可能是pH过低或者搅拌不均匀等因素造成的。从表2还可知,荧光强度与 PEG的添加量呈反比,其原因是PEG的增加阻碍了柠檬酸与谷氨酸之间的聚合,导致N-CQDs的生成率降低,所以荧光强度减弱。
正交实验设计得出的最佳原料配比为C1B3A1,即柠檬酸 80 mg/mL、谷氨酸 16 mg/mL、PEG80 mg/mL。在最优化条件下合成N-CQDs,并将其与1号试验制备的N-CQDs进行比较,结果如图3。从图3中可以看出,最优化试验组和1号试验组的荧光发射峰均在430 nm处,但最优化试验组的最大荧光强度比1号试验组的提高36.3%。
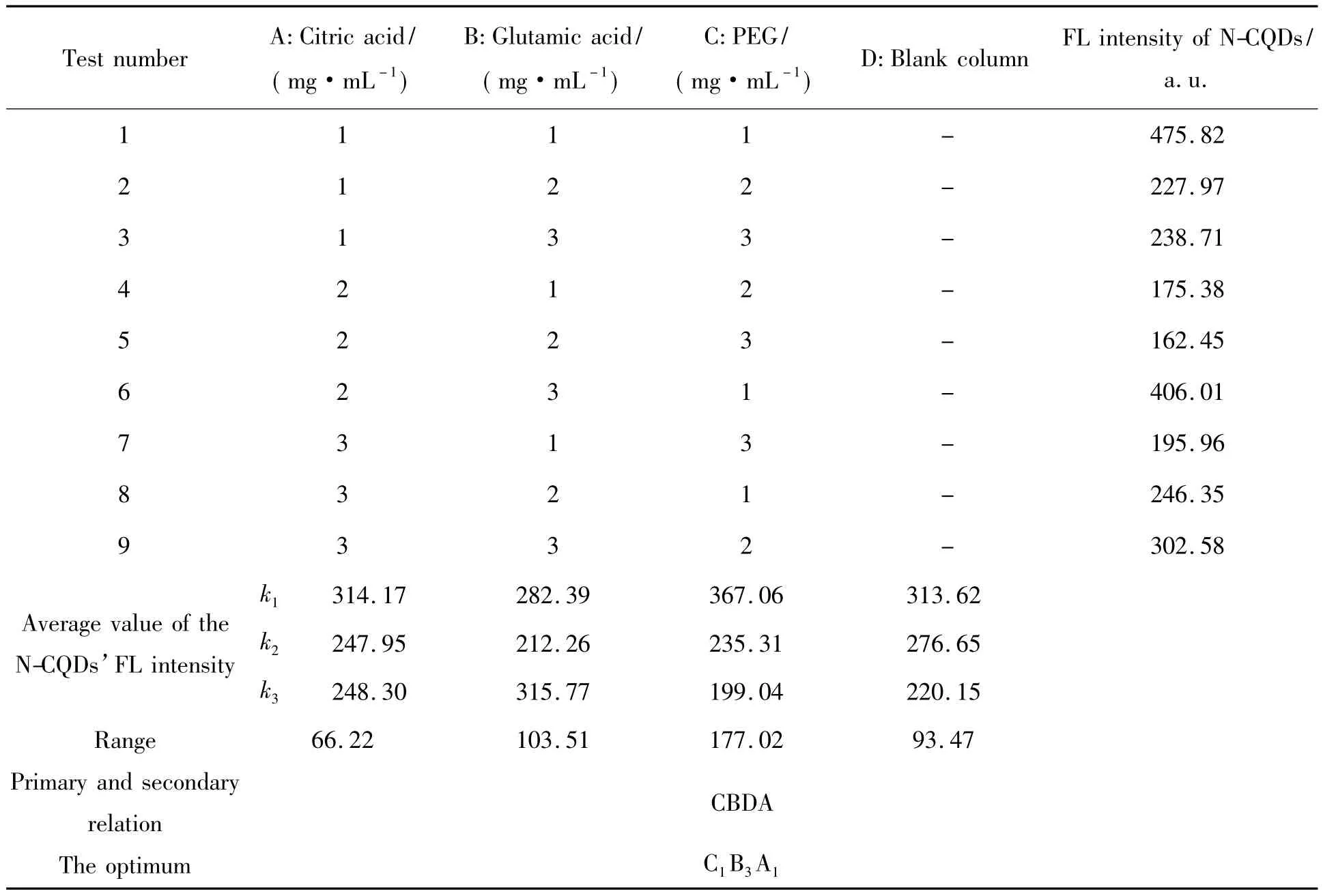
表2 原料浓度优化正交实验结果Tab.2 Orthogonal experiment results of the reaction materials
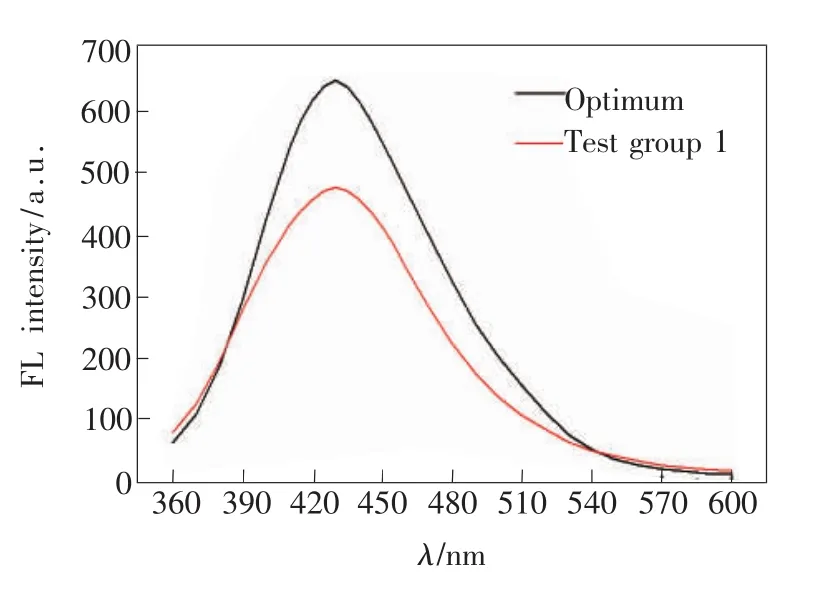
图3 最优化条件和正交最佳实验制备的N-CQDs的荧光发射光谱Fig.3 Fluorescence spectra of N-CQDs nanoparticles produced by the optimum and the test group 1
3.1.4 pH 对荧光强度影响
研究表明CQDs对pH具有依赖性,即酸碱环境能够改变CQDs表面基团的存在方式以及碳点之间的团聚水平,导致其荧光强度发生变化,但不同条件制备的CQDs对于pH的响应却是不一样的[21-22]。考察 pH对 N-CQDs的影响,对制备的N-CQDs在 pH 值为 2.48,3.00,3.92,5.28,5.99,7.32,8.41,10.59,11.07,11.72 时的实验结果分析处理后得到图4。由图4中荧光强度变化曲线可知,N-CQDs在很广的pH范围内都具有荧光发光性质,且其荧光强度随pH值的增大而增大。这有可能是由于N-CQDs四周分布了羧基、羟基等亲水基团,当溶液处于酸性条件下时,粒子之间形成氢键发生团聚,从而影响了荧光的发射。随着碱性的增强,团聚程度越来越低,单个粒子也逐渐增多,因此荧光强度增大。此外,从发射峰位置的变化图也可以看出,pH为酸性时,吸收峰位置较大,粒径也较大;当pH增大时,吸收峰发生蓝移,这表明团聚程度降低,粒子的直径逐渐减小。pH对N-CQDs的影响说明了该方法制备的荧光量子点具有较好的pH敏感性,利用该特点可以开发应用于pH敏感性微生物的检测传感器。

图4 pH对N-CQDs荧光强度的影响Fig.4 pH effect on fluorescence emission of N-CQDs
3.2 N-CQDs光学性能研究
3.2.1 透射电镜扫描分析
评判CQDs优异特性的一个重要指标是尺寸是否均一,而透射电镜分析可以直观得出粒子的尺寸分布图。图5为最优化条件下合成的NCQDs的电镜照片。从图中可以得知N-CQDs外貌呈圆球形,并且在电镜下可看到晶格条纹,说明其具有晶体结构;粒子粒径在2.3~4.2 nm之间,平均尺寸为3.5 nm,尺寸分布均匀,分散性良好,表明PEG作为分散剂能有效防止粒子团聚,其中有少量N-CQDs团聚,可能是pH过低,粒子之间形成氢键引起的。

图5 N-CQDs的透射电镜图Fig.5 TEM image of N-CQDs
3.2.2 紫外和荧光光谱分析
紫外可见光吸收光谱是一种常用的表征方法。从图6中可以看出,N-CQDs在可见光吸收区和紫外吸收区都没有吸收峰,当入射波长小于300 nm时,吸收率急剧上升,在230~300 nm间形成陡峭吸收边,具有强吸收率,这说明量子点的粒径均匀。同时,在紫光灯照射下,N-CQDs发射出明亮蓝色荧光,且荧光持久不变(图6插图)。
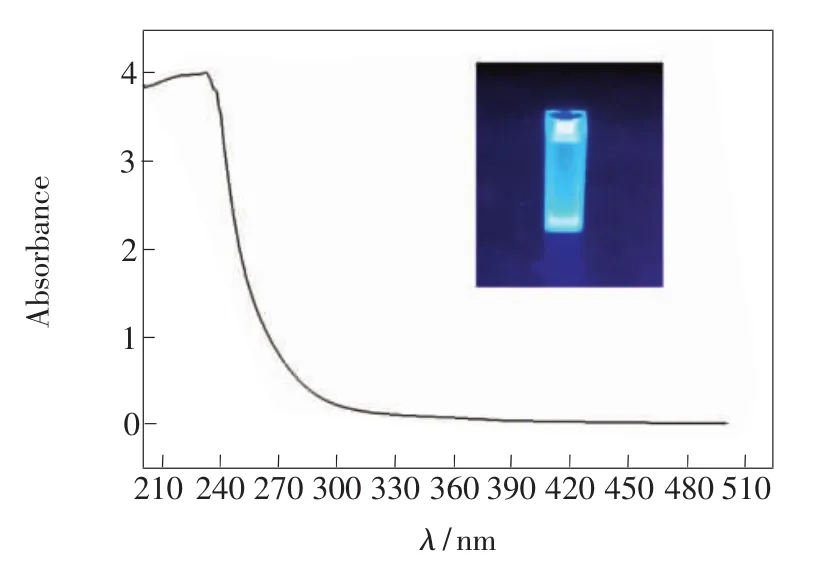
图6 N-CQDs的紫外-可见光吸收光谱Fig.6 UV-Vis absorption of N-CQDs
CQDs具有光致发光特性,即荧光发射波长及强度随着激发波长的变化而变化的性质[23-24]。从荧光发射光谱中可看到最大荧光强度和发射峰位置以及发射波长范围。图7为最优化方案制备的N-CQDs的荧光发射光谱图。由图7可知,当激发波长从300 nm增加到380 nm时,荧光发射峰的位置和强度随之发生变化。荧光强度呈现先增大后减小的趋势,340 nm为最大激发波长,同时发射峰的位置随激发波长的增大而出现红移,该现象在很多研究中都有发现[25]。CQDs的激发波长依赖性可能与其尺寸不一有关系,不同尺寸的CQDs,吸收光和发射光的波长都会不同[26]。

图7 N-CQDs的荧光发射光谱Fig.7 Fluorescence spectra of N-CQDs
3.2.3 红外光谱分析
采用红外光谱对在微波优化条件下制备的NCQDs进行表面基团分析,结果如图8所示。3 500~3 300 cm-1区域是—NH2的伸缩振动,并与其形成氢键而缔合的—OH伸缩振动(3 400~3 200 cm-1)重叠,说明碳点富含羟基和氨基。2 871 cm-1处的强吸收峰为—CH3的反对称伸缩振动,1 634 cm-1处为—CO的特征吸收频率,证明碳点四周有羧基。1 400 cm-1为—CH2的弯曲振动吸收峰,1 108 cm-1为C—O—C键伸缩振动的强吸收峰,是柠檬酸或者谷氨酸之间发生聚合的有力证据。由此看出,粒子四周布满羟基、羧基和氨基,这些官能团不仅能提高N-CQDs的水溶性和生物相容性,也有利于N-CQDs的表面修饰。
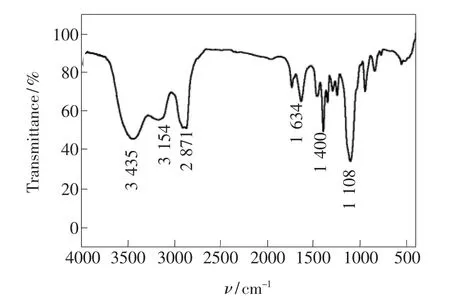
图8 N-CQDs的红外光谱图Fig.8 FT-IR spectra of the N-CQDs
4 结 论
N原子与C原子大小相似,在制备CQDs时掺杂N元素有利于改善粒子内部结构,提高荧光性能。以柠檬酸为碳源、谷氨酸为氮源、PEG为分散剂,采用一种工艺简单、成本低廉及绿色环保的微波法制备了N-CQDs。考察反应时间、反应功率、原料浓度对其荧光特性的影响,确定了最佳制备条件:柠檬酸80 mg/mL、谷氨酸 16 mg/mL、PEG 80 mg/mL,微波反应功率800 W,反应3.5 min。此外,试验还表明pH值对N-CQDs荧光强度影响显著,碱性环境能够抑制粒子间形成氢键,降低团聚水平,荧光强度呈现随pH值增大而增大的趋势。优化制备的N-CQDs尺寸均匀,大小在3.5 nm左右,分散性良好,能发出明亮稳定的蓝色荧光。NCQDs还具有激发波长依赖性,其荧光发射光谱随激发波长的改变而变化,340 nm为最大激发波长,发射峰位置在430 nm。同时红外光谱分析图显示N-CQDs表面富有羟基、羧基等亲水基团,生物相容性好,在食品检测领域具有良好的应用潜力。

