沉默Galectin-3基因对甲状腺癌细胞生长的影响
李德江,王 兵,马立人
1)平顶山市中医医院外科 河南平顶山 467000 2)郑州大学第五附属医院血管外科 郑州 450052 3)平顶山市中医医院周围血管科 河南平顶山 467000
甲状腺癌是常见的头颈部恶性肿瘤,目前临床上多根据病理类型采用手术、放化疗、内分泌等综合治疗,但对于甲状腺髓样癌及未分化癌的治疗效果并不佳[1]。因此,探讨甲状腺癌的发病机制对提高治疗效果具有重要意义。半乳凝集素-3(Galectin-3)是一种半乳糖苷结合蛋白,是凝集素家族中的一员,在细胞生长、凋亡、周期调控、损伤、修复等过程中发挥重要作用,在多种肿瘤组织中过表达,与肿瘤的恶性程度、浸润和转移密切相关[2-5]。本研究采用RNA干扰技术沉默甲状腺癌细胞SW579中Galectin-3的表达,观察对甲状腺癌细胞生长的变化,探讨Galectin-3在甲状腺癌发生发展中的可能作用。
1 材料与方法
1.1甲状腺癌组织中Galectin-3mRNA和蛋白的检测
1.1.1 样本来源 病理标本为2014年12月至2016年2月平顶山市中医医院及郑州大学第五附属医院外科手术切除的甲状腺癌组织,共46例;另取相应的距肿瘤1 cm以上的癌旁正常组织作为对照。患者中男、女分别为20例和26例,中位年龄33.5岁。所有患者在手术前均未接受过放化疗,标本均经病理医师确诊。
1.1.2 Galectin-3 mRNA和蛋白的检测 ①实时荧光定量PCR(qRT-PCR)法测定Galectin-3 mRNA:取保存的组织标本,研磨成浆,以Trizol法提取总RNA,紫外分光光度仪检测提取的RNA质量,反转录(试剂盒购自上海碧云天公司)为cDNA。以cDNA为模板进行PCR。 Galectin-3引物序列:5’-CT TATAACCTGCCTTTGCCTGG-3’(F)和5’-GCAACAT CATTCCCTCTTTGGA-3’(R)。内参GAPDH引物序列:5’-GAAGGTGAAGGTCGGAGTC-3’(F)和5’-GAAGATGGTGATGGGATTTC-3’(R)。PCR扩增程序及条件参照试剂盒说明。利用2-ΔΔCt法计算Galectin-3的相对表达量。②Western blot法测定Galectin-3蛋白:取保存的组织标本,研磨成浆,提取组织总蛋白。取蛋白样品30 μg上样,经SDS-PAGE、转PVDF膜,封闭膜,4 ℃摇床孵育,加Galectin-3和GAPDH抗体(美国CST公司,稀释度11 000),洗膜后加入二抗,37 ℃孵育1 h。洗膜,风干,滴加ECL进行发光显影,洗片后进行显影和定影。采用E-Gel Imager凝胶成像系统(美国Invitrogen公司)拍照分析。以GAPDH为内参,以目的条带与内参条带灰度值的比表示目的蛋白的相对表达水平。
1.2Galectin-3siRNA转染后SW579细胞中Galectin-3mRNA和蛋白表达的检测SW579细胞购自中国科学院上海细胞库。调整SW579细胞浓度为105mL-1,接种至6孔细胞培养板中,每孔2 mL,待细胞达30%~50%融合时,用Lipofectmine2000(美国Invitrogen公司)分别将NC-siRNA(非特异性siRNA)、Galectin-3-siRNA1、Galectin-3-siRNA2转染至SW579细胞,以仅仅加入脂质体的细胞作为空白对照,每组6个复孔。细胞转染过程中使用无血清培养基,6 h后更换为正常细胞培养基培养。NC-siRNA、Galectin-3-siRNA1、Galectin-3-siRNA2由上海凯基公司合成。培养48 h后,收集各组细胞,提取总RNA及总蛋白,按1.1.2方法测定Galectin-3 mRNA和蛋白的表达水平。实验重复3次。
1.3Galectin-3siRNA转染后SW579细胞增殖和凋亡的检测①调整SW579细胞浓度为5×104mL-1,接种至96孔板中,每孔200 μL,常规培养24 h,用Lipofectmine2000分别将NC-siRNA、Galectin-3-siRNA2转染至SW579细胞,以仅仅加入脂质体的细胞作为空白对照,每组6个复孔。于转染后12、24、48 h每孔加CCK-8试剂(美国Sigma公司)10 μL,37 ℃孵育4 h,酶标仪(美国Bio-Rad公司)测定490 nm波长处的吸光度(A),计算细胞增殖率。细胞增殖率=(实验组A/对照A)×100%。②转染48 h后,收集各组细胞,胰酶消化及PBS洗涤,binding buffer重悬。取细胞悬液(1×106mL-1)100 μL,分别加入5 μL的Annexin V-FITC和10 μL的PI,充分混匀,4 ℃避光反应10~15 min,1 h内上流式细胞仪检测。Annexin V-FITC凋亡试剂盒、流式细胞仪由美国BD公司提供。实验重复3次。
1.4Galectin-3siRNA转染后SW579细胞中相关蛋白的表达调整SW579细胞浓度为5×104mL-1,接种至96孔板中,每孔200 μL,常规培养24 h,用Lipofectmine2000分别将NC-siRNA、Galectin-3-siRNA2转染至SW579细胞,以仅仅加入脂质体的细胞作为空白对照,每组6个复孔。于转染后48 h,采用Western blot法检测细胞中Ki67、PCNA、Cleaved caspase3、PI3K、AKT、p-AKT蛋白的表达。Galectin-3(1500)、Cleaved caspase3(1500)、PI3K(11 000)、p-AKT(12 000)、AKT(11 000)、Ki67(1500)、PCNA(1200)单克隆抗体由美国CST公司提供。实验重复3次。
1.5统计学处理采用SPSS 21.0进行统计分析。癌和癌旁正常组织中Galectin-3 mRNA和蛋白表达的比较采用配对t检验,细胞中Galectin-3 mRNA和蛋白表达水平、细胞增殖率、凋亡率、相关蛋白表达水平的比较采用单因素方差分析,两两比较采用LSD-t检验;检验水准α=0.05。
2 结果
2.1甲状腺癌组织中Galectin-3的表达见图1、表1。甲状腺癌组织中Galectin-3在mRNA及蛋白水平的表达均明显高于癌旁正常组织。

1:癌旁正常组织;2:癌组织
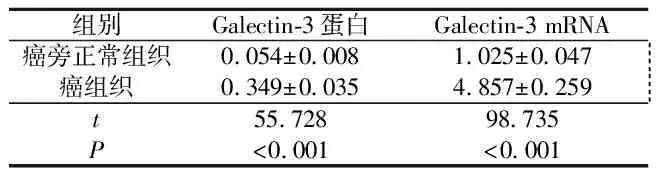
表1 甲状腺癌及癌旁正常组织中Galectin-3的表达(n=46)
2.2Galectin-3siRNA转染对SW579细胞Galectin-3mRNA及蛋白表达的影响见图2、表2。Galectin-3-siRNA1、Galectin-3-siRNA2组细胞中Galectin-3 mRNA及蛋白表达均低于空白对照组和NC-siRNA组,其中Galectin-3-siRNA2组的抑制效果更明显,选择该组进行后续实验。
2.3Galectin-3siRNA转染对SW579细胞增殖和凋亡的影响见表3。与空白对照组及NC-siRNA组比较,Galectin-3-siRNA2组细胞增殖率降低,凋亡率升高。
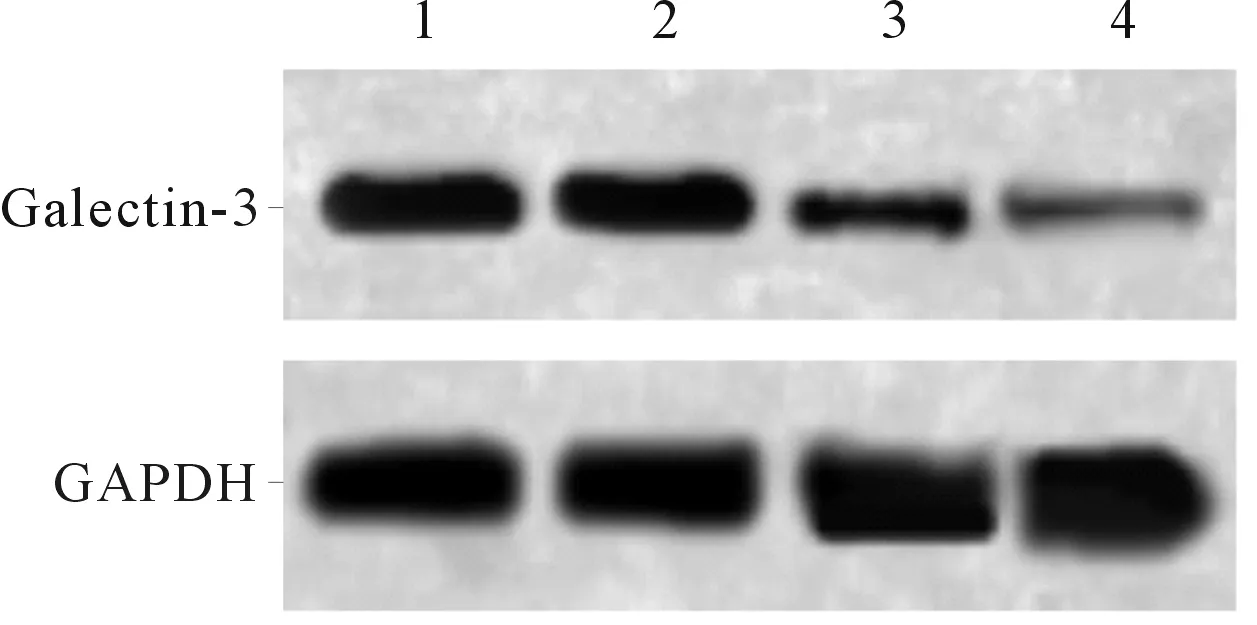
1:空白对照组;2:NC-siRNA组;3:Galectin-siRNA1组;4:Galectin-3-siRNA2组
图2Galectin-3在转染细胞中的表达

表2 4组细胞中Galectin-3的表达
*:与空白对照组及NC-siRNA组比较,P<0.05
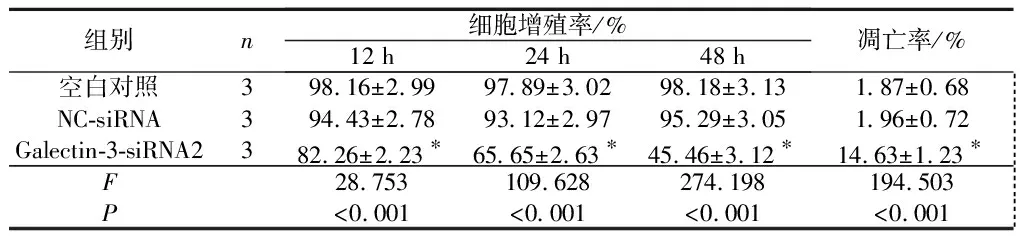
表3 3组细胞增殖率和凋亡率的比较
*:与空白对照组及NC-siRNA组比较,P<0.05
2.4Galectin-3siRNA转染对SW579细胞中相关蛋白表达的影响见图3、表4。与空白对照组及NC-siRNA组比较,Galectin-3-siRNA2组Ki67、PCNA、PI3K、p-AKT蛋白表达降低,而Cleaved caspase3蛋白表达升高;3组AKT蛋白表达差异无统计学意义。
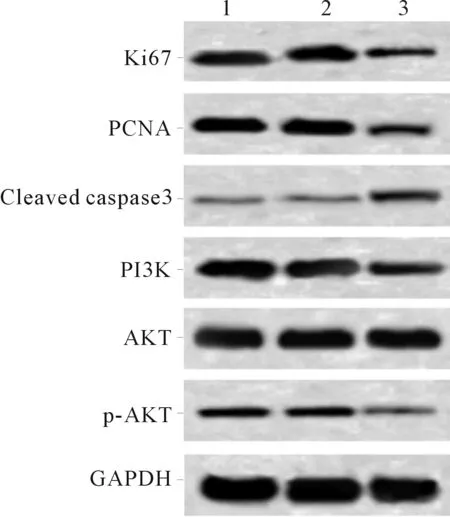
1:空白对照组;2:NC-siRNA组;3:Galectin-3-siRNA2组
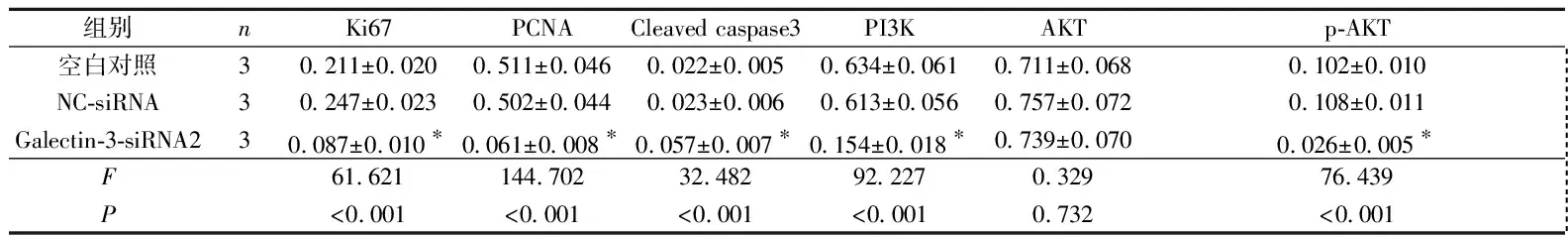
表4 3组细胞中相关蛋白表达的比较
*:与空白对照组及NC-siRNA组比较,P<0.05
3 讨论
Galectin-3位于人类染色体14q21-22,属于半凝集素家族成员,在多种肿瘤中有异常表达,参与细胞增殖、凋亡、分化、血管形成等一系列生物学活动[6]。研究显示,前列腺癌细胞中Galectin-3高表达可抑制顺铂介导的细胞凋亡[7];Galectin-3在乳腺癌中的表达可抵抗由4-羟苯基维胺脂诱导的细胞凋亡[8]。研究显示,下调Galectin-3的表达可抑制食管癌、乳腺癌细胞的增殖[9-10];抑制Galectin-3表达可抑制胃癌细胞的增殖并诱导癌细胞凋亡,还可增加癌细胞对化疗药物奥沙利铂的敏感性[11]。本研究观察到Galectin-3在甲状腺癌组织中高表达,利用siRNA抑制Galectin-3的表达后,SW579细胞增殖受抑,凋亡率增加。
Ki67是一个反映细胞活性的指标,为肿瘤预后标志物。PCNA 的合成及表达与细胞增殖率、DNA合成、肿瘤细胞的生长及侵袭密切相关,是反映细胞增殖活性的有效标志[12]。Caspase3是Caspase家族的一个关键酶,反映了细胞凋亡状况[13-14]。本研究结果显示,抑制Galectin-3表达后,SW579细胞中Ki67和PCNA的表达均明显降低,Cleaved caspase3表达升高。
PI3K/AKT信号通路与肿瘤的发生发展关系密切[15-17]。AKT为 PI3K下游的靶分子之一,PI3K可激活AKT,磷酸化的AKT激活其下游分子,进而参与炎症、肿瘤等通路的调控[18]。本研究结果显示,抑制Galectin-3的表达可降低SW579细胞中PI3K和p-AKT的表达。
综上所述,Galectin-3在甲状腺癌中高表达,抑制Galectin-3可降低甲状腺癌细胞的增殖,诱导凋亡,作用机制可能与抑制PI3K/AKT信号通路有关。该研究为Galectin-3在甲状腺癌中的作用研究奠定了一定的基础。

