MEF2A RNA干扰对apoE-/-小鼠动脉粥样硬化斑块及血清Lp-PLA2、MCP-1表达的影响
周文平,周应乾,张 辉,张金盈
1)郑州大学第三附属医院心内科 郑州 450052 2)苏州大学医学部 江苏苏州 215000 3)郑州大学第一附属医院心内科 郑州 450052
肌细胞增强因子2A(myocyte enhancer factor 2A,MEF2A)是一种新发现的维护血管内皮稳定性的重要生物活性物质,MEF2A表达水平的降低是动脉粥样硬化(atherosclerosis,AS)形成的危险标志。作者用载脂蛋白E基因敲除(apoE-/-)小鼠制备颈总动脉AS动物模型,用携带MEF2A siRNA的慢病毒感染模型小鼠颈动脉斑块,观察MEF2A表达下降对AS斑块形成的影响及对脂蛋白相关磷脂酶A2(lipoprotein associated phospholipase A2,Lp-PLA2)、单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)表达的影响,探讨MEF2A在AS发生发展过程中的可能作用,为AS的诊治提供指导和依据。
1 材料与方法
1.1实验动物10周龄雄性apoE-/-小鼠45只购自北京大学医学部,遗传背景C55/BL5。在常规小鼠饲料中添加质量分数15%脂肪和质量分数0.25%胆固醇粉高脂喂养,调节室温20~22 ℃,去除噪音等应激因素干扰。
1.2MEF2AsiRNA慢病毒的构建选择上海吉玛生物制药技术有限公司制作的MEF2A siRNA慢病毒和阴性对照(negative control,NC)慢病毒,两者均含有绿色荧光蛋白序列,即5’-GGGTCTTAG TATATTTCTTGG-3’,构建的慢病毒均标记有滴度为1×105TU/mL的绿色荧光蛋白。以病毒感染复数=50来确定慢病毒感染效率。
1.3动物模型的构建采用高脂饲料喂养apoE-/-小鼠,喂养2周后通过左颈动脉缩窄手术放置套管,诱发小鼠颈总动脉AS病变形成。小鼠均禁食12 h,采用戊巴比妥钠按40 mg/kg进行腹腔注射。达到麻醉效果后,将小鼠腹面朝上固定在手术台上,充分暴露颈前三角区,按照手术路径分离左侧颈总动脉,首先固定该动脉,然后将缩窄性硅胶管放在血管周围(硅胶管长度3 mm、内径0.3 mm)并固定套管。术后将小鼠放回鼠笼继续喂养。术后5周解除套管,观察小鼠左颈总动脉,斑块形成提示AS模型制作成功。
1.4实验分组模型小鼠采用随机数字表法分为3组,即MEF2A RNAi组、NC组和对照组,每组15只。通过定位,短暂阻断上游血流,切开动脉斑块,30°方向进针,MEF2A RNAi组动脉斑块局部用滴度为5×105TU/mL的RNAi慢病毒悬液进行注射,NC组动脉斑块局部用滴度为5×105TU/mL的NC慢病毒悬液进行注射,对照组动脉斑块局部用生理盐水进行注射。然后缝合血管,术后继续高脂喂养。5周后再次手术游离出左侧颈总动脉,截断取出,先将左颈总动脉标本用生理盐水充分漂洗,然后用40 g/L多聚甲醛浸泡12 h,达到固定效果后,取出标本,OCT包埋,制作5 μm厚冰冻切片。进行油红染色(ORO染色),染色后的组织标本在光学显微镜下观察,测定颈动脉斑块厚度和面积。
1.5AS斑块内MEF2A、Lp-PLA2和MCP-1mRNA表达的检测取实验小鼠新鲜斑块标本,采用real-time PCR法检测MEF2A、Lp-PLA2和MCP-1 mRNA的表达。采用2-ΔΔCt法分析各因子的相对表达量,以β-actin为内参照。标本总RNA的提取及RNA浓度、纯度和完整性检测均按珠海贝索生物技术有限公司试剂盒所规定的步骤和程序进行。
1.6血清MEF2A、Lp-PLA2、MCP-1水平的测定
小鼠球后静脉丛抽血,血样经3 000 r/min离心15 min取上层血清,采用ELISA法测定血清MEF2A、Lp-PLA2、MCP-1水平。所有操作步骤均按北京康为世纪生物制品有限公司试剂盒说明书进行。
1.7统计学处理采用SPSS 17.0进行统计学处理。3组间AS斑块内MEF2A、Lp-PLA2、MCP-1 mRNA相对表达量和血清水平的比较均采用单因素方差分析,组间两两比较采用SNK-q检验。检验水准α=0.05。
2 结果
2.1MEF2ARNAi对AS斑块形成的影响MEF2A RNAi组、NC组和对照组AS斑块ORO染色结果见图1。MEF2A RNAi组斑块厚度和面积较对照组和NC组升高;对照组与NC组斑块面积及厚度比较,差异无统计学意义(表1)。
2.2MEF2ARNAi对斑块内MEF2A、Lp-PLA2、MCP-1mRNA表达的影响结果见表2。对照组与NC组相比,斑块内MEF2A、Lp-PLA2、MCP-1 mRNA表达差异无统计学意义;与对照组及NC组相比,MEF2A RNAi组斑块内MEF2A mRNA表达明显降低,而Lp-PLA2、MCP-1 mRNA表达明显升高。
2.3MEF2ARNAi对3组小鼠血清MEF2A及Lp-PLA2、MCP-1水平的影响结果见表3。 MEF2A RNAi组与对照组及NC组相比,血清MEF2A水平明显降低,Lp-PLA2和MCP-1水平明显升高;对照组与NC组相比,血清MEF2A、Lp-PLA2和MCP-1水平差异无统计学意义。

A:MEF2A RNAi组;B:NC组;C:对照组图1 MEF2A RNAi组、NC组和对照组AS斑块比较(ORO染色,×200)

表1 对照组、NC组和MEF2A RNAi组AS斑块厚度和面积的比较
*:与对照组和NC组相比,P<0.05
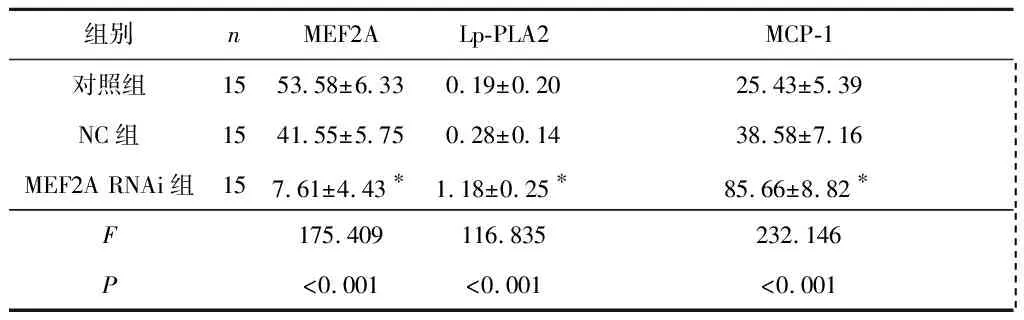
表2 对照组、NC组和MEF2A RNAi组斑块内MEF2A、Lp-PLA2及MCP-1 mRNA表达的比较
*:与对照组和NC组相比,P<0.05
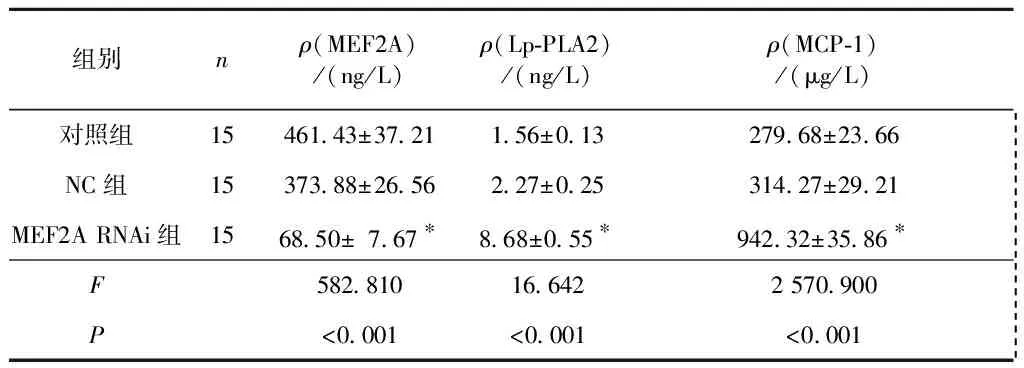
表3 3组小鼠血清MEF2A、Lp-PLA2、MCP-1水平的比较
*:与对照组和NC组相比,P<0.05
3 讨论
AS是严重威胁人类健康的常见病、多发病。AS的发生是一个慢性炎症过程,其重要特征性表现是单核细胞迁移浸润血管壁,脂质成分沉积,炎症过程和病理过程呈持续高反应状态,导致斑块形成,最终形成AS[1]。
apoE-/-小鼠AS模型是通过手术方法,给予高脂喂养,人为形成AS和AS斑块,是公认的AS模型。血管内皮和血管壁结构和功能的变化是AS病变的基础。MEF2A与血管内膜完整性和血管内皮细胞的生存密切相关,可与血管平滑肌细胞中特异性基因调控区A/T序列结合,调控血管平滑肌细胞靶基因转录[2]。血管内皮细胞ERK5/MEF2通路通过激活KLF2转录因子调节血流介导的内皮完整性,细胞内MEF2-HDAe信号在维持血管的完整性方面具有重要作用[3]。抑制MEF2A活性可激活单核巨噬细胞系统,大量单核细胞迁移到动脉内皮下并促进MCP-1生成,激发血管平滑肌细胞的增殖,促进斑块形成,加速AS病理过程[4]。Lp-PLA2是由单核巨噬细胞系统分泌的与AS发生发展密切相关的炎性标志物和调节介质,其产生过程与动脉壁炎性过程、血管硬化形成和斑块病理程度相一致,对心血管事件发生具有预测作用[5]。实验[6]表明,AS斑块中甘油磷脂二位酰基酯键通过Lp-PLA2水解,产生促炎因子,促发单核细胞迁移,浸润血管内皮,成为动脉慢性炎性过程和AS斑块不稳定性的关键环节。同时,Lp-PLA2是ox-LDL产生的启动因素,促进脂质在血管壁的浸润和沉积,成为AS启动、加重和病理演变的关键性酶[7]。MCP-1激活单核巨噬细胞系统,启动脂质沉积和血小板凝血机制,构建AS的早期特有病变[8]。Lp-PLA2可有效促进MCP-1的生成并促进MCP-1发挥单核细胞活化、趋化和转化作用,从而启动、加速AS和斑块的形成[9-10]。在AS斑块部位采用慢病毒介导的RNAi有效抑制MEF2A活性,斑块中相关因子Lp-PLA2、MCP-1活性增强,AS和斑块病变加重,说明MEF2A RNAi对apoE-/-小鼠AS及MEF2A、Lp-PLA2、MCP-1表达的影响。
本实验发现,与对照组和NC组相比,MEF2A RNAi组颈动脉AS斑块易于形成,其血清中Lp-PLA2、MCP-1水平明显升高。抑制MEF2A可以打破血管内皮功能和结构稳定,促进Lp-PLA2、MCP-1在血清中和血管壁的高表达,对AS的发生发展具有促进作用。

