纳洛酮对果糖偏好大鼠自主活动和自主运动行为影响的研究*
杜 洁,王海英, 焦广发,2
(1.河北体育学院 运动人体科学系,河北 石家庄 050041;2.河北医科大学 基础医学院,河北 石家庄,050041)
随着现代社会的快速发展,存在异常或病态摄食行为的人群数量越来越多,而运动量的大幅减少以及过度运动行为(运动成瘾)人群增多的现象也日益显现,这使成瘾行为问题成为世界范围内研究的热点问题。美味食物可以激活中脑内的奖赏机制,使摄食量和摄食次数增多[1]。当这种过度摄食行为转为强迫状态或失去控制时即称为食物成瘾[2]。脑内奖赏系统失调可能是摄食异常导致肥胖的机制[3]。根据精神疾病诊断与统计手册(The Diagnostic and Statistical Manual of Mental Disorders,DSM)的分类[4],食物成瘾主要指的是BED和神经性贪食(bulimia nervosa,BN)两种类型的摄食行为异常。近年来的研究中建立了以糖、脂高热量食物为诱导物的食物成瘾动物模型[5]。成瘾状态伴有多种行为异常,但对于食物成瘾摄食活动与运动行为之间的关系和机制尚不清楚。
运动行为主要分为无目的性的自主活动和主动性的运动。自主活动(locomotor activity)是机体除基础代谢、食物产热作用外的另一种主要能量支出形式,但是关于自主活动的调控机制和其他生理作用研究报道较少[6],而也有学者认为自主活动是一种与摄食行为相关联的重要补偿机制[7]。主动运动(voluntary exercise)是决定长期健康的重要因素,但营养因素可以改变主动运动行为的易感性[8]。大鼠进行主动转轮运动的行为不仅代表身体活动的水平,也是一种环境与基因相互作用的复杂行为,代表神经系统存在独立的改变能量平衡活动的机制[9]。
摄食与运动是机体维持能量平衡的基本生理活动,但生理学和心理学学家都认识到摄食行为异常与运动行为的改变存在某种联系的共病现象(comorbidity)[10],而对这二者之间的关联机制并不清楚。阿片肽是成瘾奖赏机制发挥作用的关键神经递质,主要由阿黑皮素原(pro-opiomelanocortin,POMC)产生。阿片肽受体在中枢内的广泛分布显示出这一物质参与正常和异常摄食行为[11]。阿片肽受体激动剂DAMGO能促进大鼠产生对糖的喜好[12]。纳洛酮(Naloxone, Nal)是阿片肽u受体阻断剂,具有治疗食物成瘾的作用[13]。激活或阻断阿片肽系统均伴有自主活动的改变,而运动成瘾现象进一步证实阿片肽也参与了自主运动行为调控的神经内分泌活动[14]。因此,POMC的阿片肽系统可能在摄食行为和运动行为之间发挥着重要关联作用。本研究推测Nal可能会对食物成瘾状态下运动行为产生影响。本研究主要观察果糖偏好大鼠注射Nal后摄食行为、自主活动和主动运动行为的变化,探讨中枢阿片肽系统在果糖成瘾大鼠摄食和运动行为的中枢调节机制。
1 材料和方法
1.1 实验动物
雄性SD大鼠,体重200~250g,鼠龄6~8周,购于河北医科大学实验动物中心,合格证编号:HB-201503002。大鼠单笼喂养,室温22~24℃,湿度50%,12h光照/12h黑暗周期,开灯时间为上午7时。动物实验方案符合动物伦理学规定(National Research Council, 1996),并得到河北医科大学动物伦理委员会批准。适应性饲养一周,大鼠随机分为正常喂养对照组(Control, Con,15只)和果糖偏好模型组(Fructose Preference,FP,15只)。
1.2 果糖偏好模型方案
FP组大鼠下午3-4点限制饮水适应3天。每日上午8时禁食后,腹腔注射LiCl(0.15M,1ml/100g 体重),2h后给予10%果糖溶液30min。下午3-4点限时饮水1h,除诱导期间2.5h外,其他时间自由摄食。连续诱导7天后再参照Avena,强化方法为大鼠每天不规律时间给予果糖溶液30min,强化期间自由摄食水[13]。Con组注射生理盐水,在相应的时间段给予水,其他安排与FP组相同。LiCl 购于MP Biomedicals (上海)公司,果糖购于Biotopped公司。
1.3 果糖偏好测试
模型制备结束后,首先监测FP和Con两组在自由摄食和饮水状态下的体重、24h内摄食量和饮水量等生理指标,测试前3天Con组每天下午给予10%果糖溶液30min,避免大鼠新奇恐惧对测试实验的影响[15]。
两瓶法测定FP和Con两组大鼠果糖溶液偏好,同时给大鼠提供10%果糖溶液和纯水各一瓶,测定30min内大鼠对果糖溶液和水的摄取量,测试前大鼠禁水12h。24h果糖溶液摄入量测试是测定FP和Con两组大鼠一个光照/黑暗周期24h的10%果糖溶液摄取量。
1.4 Nal干预后监测
FP组大鼠分别监测自由饮水(ad libitum+Water)、腹腔注射生理盐水自由饮用果糖溶液(Saline+Fructose)、腹腔注射Nal(Sigma, St. Louis; 3mg/kg, i.p.)[13]后自由饮用果糖溶液(Nal+Fructose)三种干预下的24h代谢活动和主动运动行为。注射时间为早上7:00。三种干预条件的代谢活动监测间隔1d进行,间隔期间大鼠自由摄食、饮水,并在上午10时给予果糖溶液30min。在整个实验期间大鼠均自由摄食普通饲料。
1.4.1 代谢活动监测
大鼠摄食、摄水行为和自主活动采用美国Columbus代谢分析系统(CLAMS; Columbus Instruments)进行监测。上午9-10时将大鼠放入代谢笼中,进气流量2L/min,系统持续提供饮水和饲料,实时监测大鼠自主活动。自主活动是通过大鼠阻断红外光线束的次数表示,指标为中断总次数和活动的中断次数,差值为大鼠重复动作次数。系统记录的重复动作主要指大鼠的整理活动,这种动作通过监测重复阻断同一个光束的次数获得。
1.4.2 主动运动监测
采用自主运行跑轮对大鼠主动运动行为进行监测,监测前于造模最后三天每天下午训练大鼠在跑轮中活动30min。监测时大鼠于上午7:00单笼喂养于具有转轮的笼中,记录24h跑轮转数,同时监测大鼠摄食食量、摄水或摄果糖溶液量。由于主动运动行为个体差异较大,FP组大鼠主动运动变化以其自身在摄水条件下的运动量为参照,计算比值。
1.5 统计学处理
实验数据以平均数±标准误(M±SME)表示,并用SPSS 19.0统计软件进行分析,FP组与Con两组各指标比较,以及FP组注射Saline和Nal下主动运动量比较采用独立样本t检验。FP组自由摄食水,以及注射Saline和Nal干预果糖喂养状态下的摄食量和自主活动次数比较采用one-way ANOVA检验,方差分析后采用Tukey检验,FP组的饮水量与注射Saline和Nal后果糖摄入量比较因方差不齐采用Wilcoxon秩和检验。统计学差异为P<0.05。
2 结果
2.1 果糖偏好BED模型检验
大鼠诱导果糖BED模型后,FP组与Con两组大鼠体重(t(28)=-0.446, p=0.659)、摄食量(t(28)=0.695,p=0.493)和摄水量(t(28)=-1.512,p=0.142)无差异指标比较无差异(Table1)。利用双瓶测试对两组大鼠进行果糖偏好测试(Fig.1A、B),结果显示FP组大鼠果糖摄入量高于Con组大鼠(t(28)=19.219,p<0.001),FP组嗜好比显著高于Con组(t(28)=15.170,p<0.001),同时FP组大鼠24h果糖摄入量高于Con组(t(28)=13.326,p<0.001)(Fig.1C)。
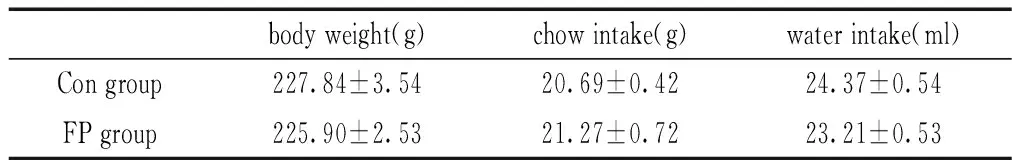
Table 1. Body weight, food intake and water intake in FP and Con rats after food addiction model procedure
Data represent M±SEM. n=15 per group. Differs from Con *p<0.05, ** p<0.01.
2.2 Nal对果糖偏好BED大鼠摄食活动的影响
FP组大鼠正常饮水量与注射Saline或Nal后24h果糖溶液的摄入量结果显示(Z=-3.408,p=0.001),注射Saline后果糖摄入量高于饮水量(p<0.001),注射纳洛酮后果糖摄入量下降(P<0.001),但仍高于饮水量(P<0.001)。FP组大鼠24h普通饲料的摄入量(F(2,42)=34.350, p<0.001)果糖喂养状态低于饮水状态期间(p<0.05),但注射纳洛酮后果糖喂养状态下摄食量下降(p<0.001)(Fig.2)。
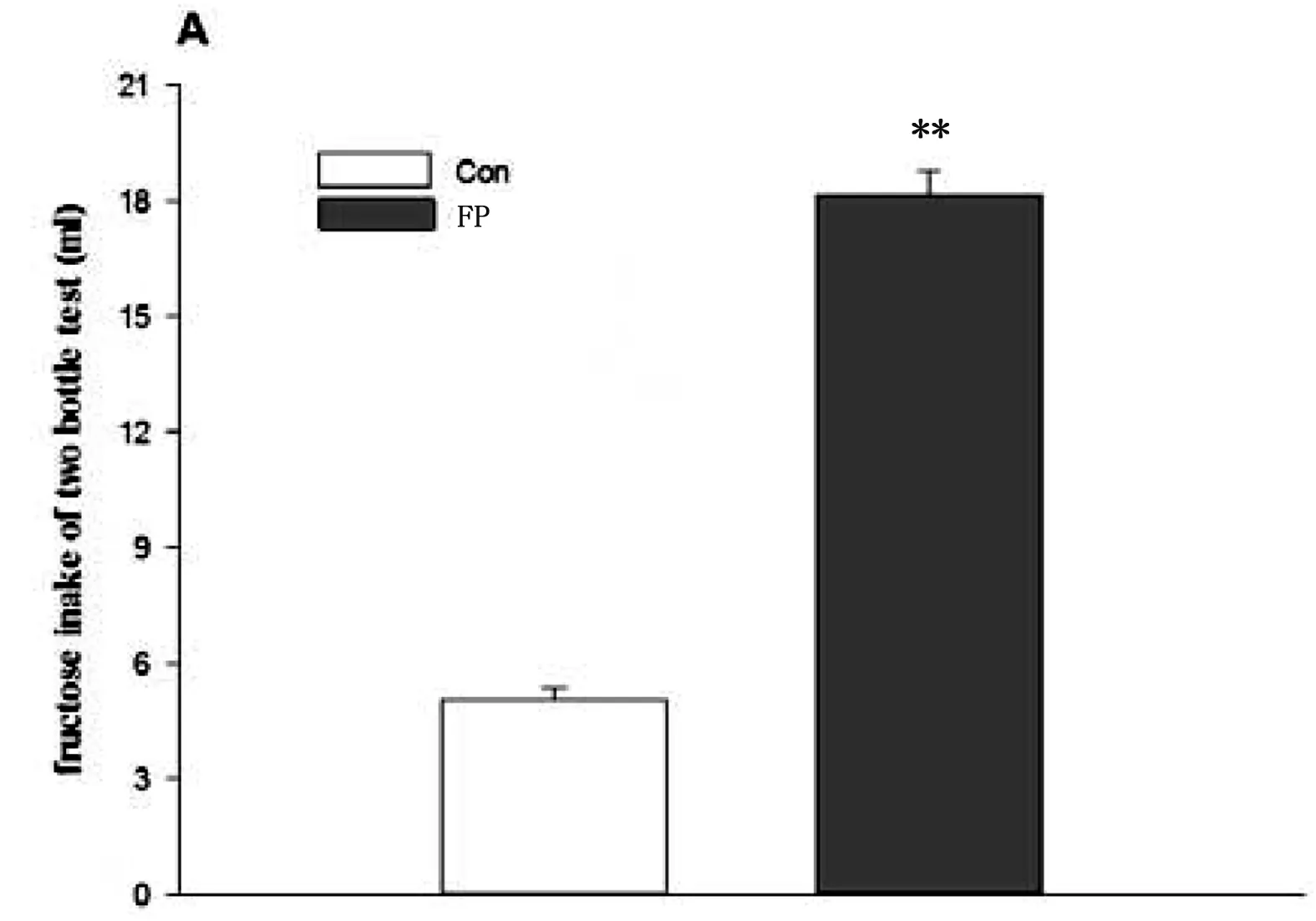
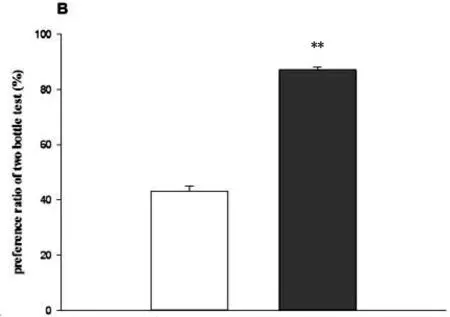
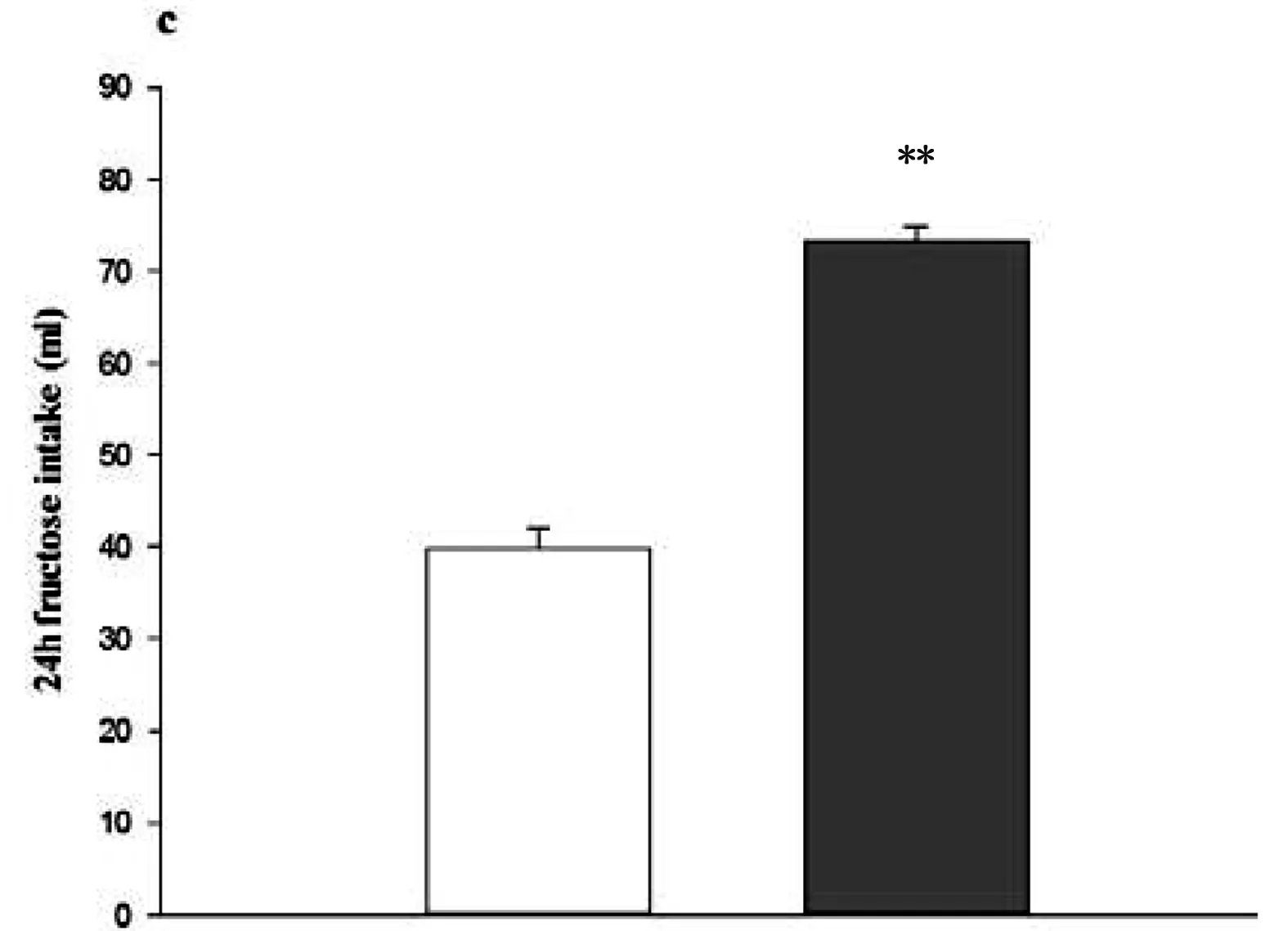
Fig.1. Two-bottle test(A、B) and 24h-fructose intake test(C)Data represent M±SEM. n=15 per group. Differs from Con *p<0.05, ** p<0.01.
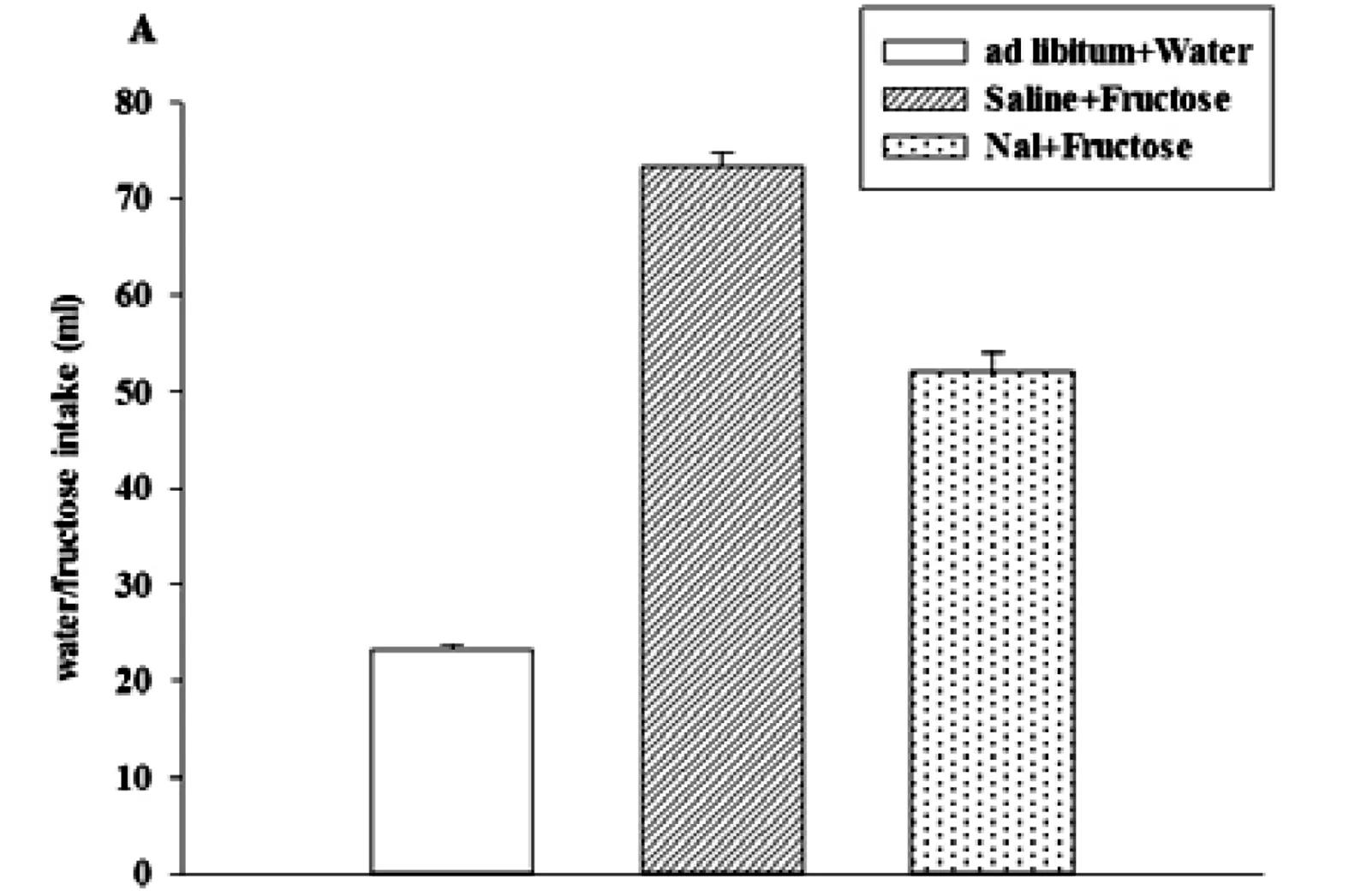
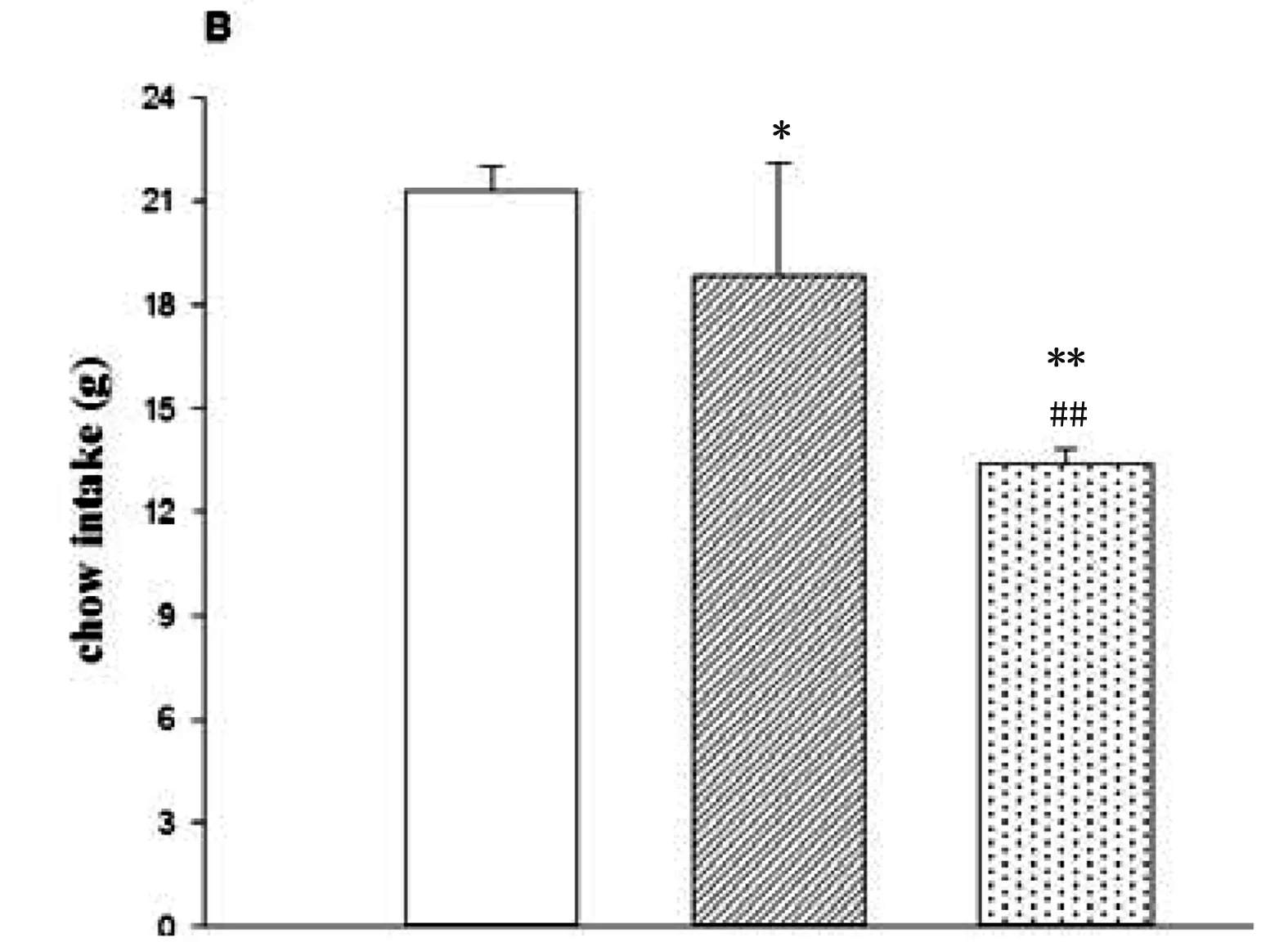
Fig.2. The 10% fructose intake (A) and chow intake (B) for 24h were decreased by Nal in FP rats
2.3 Nal对果糖偏好BED大鼠自主活动和主动运动的影响
FP组大鼠果糖喂养期间24小时水平方向上自主活动的总次数(F(2,42)=93.151,p<0.001)、位置移动次数(F(2,42)=54.966,p<0.001)和重复动作次数(F(2,42)=211.723,p<0.001),以及垂直方向自主活动总次数(F(2,42)=76.78,p<0.001)均高于饮水状态下相应指标(p<0.001)。注射纳洛酮后FP组大鼠水平方向和垂直方向自主活动水平均下降(p<0.001),并且水平方向上的自主活动低于饮水状态(p<0.001)(Fig.3)。
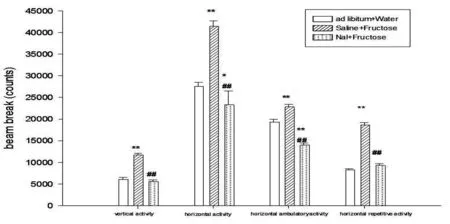
Fig.3.The locomotor activity for 24h was decreased by Nal in FP ratsNal: naloxone. Data represent M±SEM. n=15 per group. Differs from ad libitum water *p<0.05, **p<0.01. Differs from I.P saline #p<0.05, ##p<0.01.
由于FP组大鼠自主活动的个体差异和时相性,Fig.4A,B显示FP组中一只大鼠在不同状态下24h内不同时间段内的变化趋势。按白天和夜晚分段统计垂直活动(F(2,42)=76.793,p<0.001; F(2,42)=76.777,p<0.001)和水平活动(F(2,42)=94.635,p<0.001;F(2,42)=90.904,p<0.001)状态,FP组大鼠在果糖喂养期间24h内水平方向和垂直方向自主活动总次数趋势白天和夜晚增多高于饮水状态(p<0.001),注射纳洛酮后昼夜自主活动水平均下降(p<0.001)(Fig.4C)。
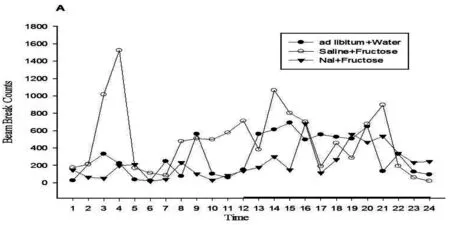
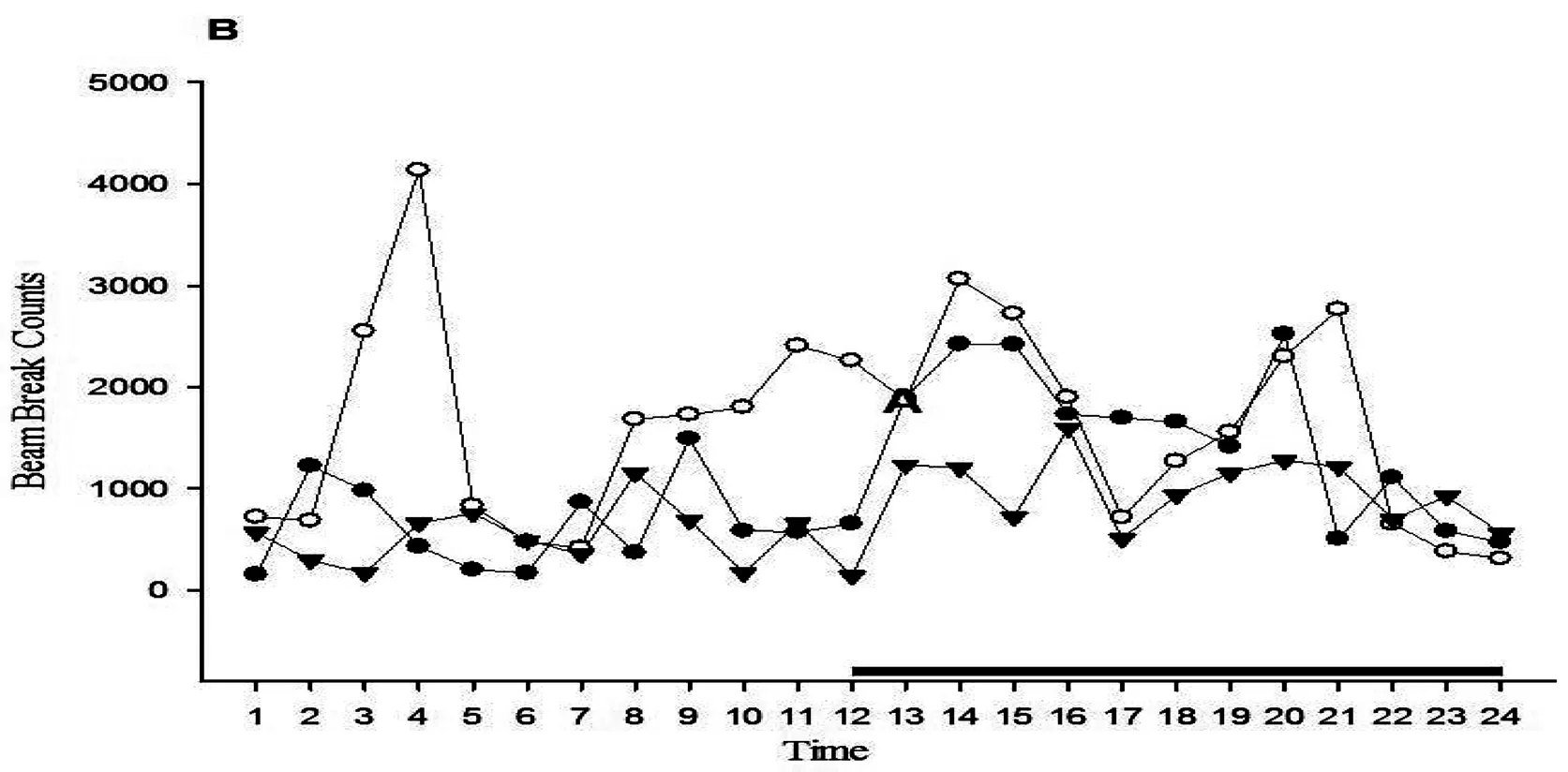
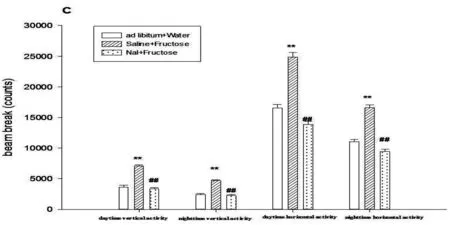
Fig.4.The locomotor activity for light-dark cycle was changed bye Nal of a representative rat in FP group (A,B). The locomotor activity for light cycle and dark cycle was decreased by Nal in FP rats(C)Nal: naloxone. Data represent M±SEM. n=15 per group. Differs from ad libitum water *p<0.05, **p<0.01. Differs from I.P saline #p<0.05, ##p<0.01.
以FP组大鼠饮水状态下24h主动运动量为参照,计算出注射纳洛酮前后主动运动比值。结果显示,注射纳洛酮后果糖喂养期间主动运动量增多(t(28)=-14.732,p<0.001)(Fig.5)。
3 讨论
本研究中果糖偏好BED模型大鼠在一系列的果糖摄入量测试中表现出明显的果糖喜好,并且在短时间摄入大量果糖溶液,符合食物成瘾动物模型基本标准[16]。本研究发现,Nal降低果糖BED大鼠果糖溶液和普通饲料的摄入量,同时还表现出自主活动水平的下降和主动运动行为的增强。
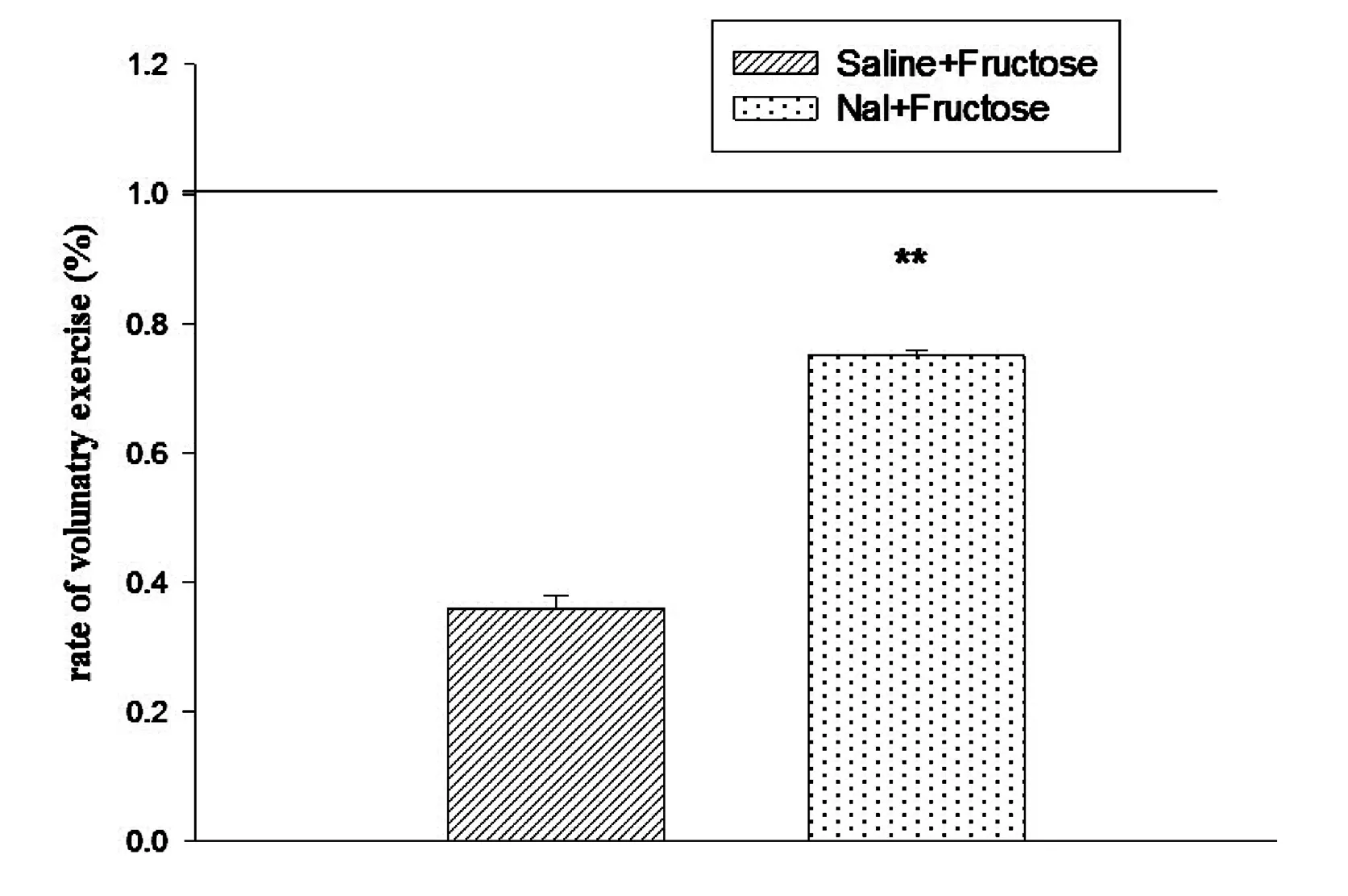
Fig.5.The change rate of voluntary exercise for 24h was decreased by Nal in FP rats.
本研究发现Nal抑制果糖偏好大鼠果糖溶液和食物的摄入,这与多数研究结果一致。激活阿片肽系统可快速增加摄食量和次数[17],Nal是吗啡样物质的特异拮抗剂,能竞争性阻止并取代吗啡样物质与受体结合,阻断吗啡样物质的作用。Nal能够降低阿片肽信号通路改变摄食偏好行为[18]。大鼠脑内注射吗啡后酒精和摄食量增多,而注射Nal可使酒精摄入量减少,但对摄食和饮水量没有影响,注射DAMGO后刺激摄食,但对酒精摄入没有作用[19]。这提示Nal阻断阿片肽系统能对果糖成瘾大鼠奖赏系统产生对食物非选择性的抑制。
自主活动重复动作的增多,如摇头和舔毛,也可以间接反映模型组大鼠存在一定戒断症状,但本研究结果显示此症状并不典型。垂直方向的自主活动主要代表大鼠站立的次数,也可以间接反映大鼠吮舔活动的增多。站立活动增多通常反应大鼠处于焦虑状态,提示本研究模型组大鼠存在类成瘾行为的特征。自主活动的变化并不与能量平衡调节相一致[20]。肥胖摄食增多往往伴有显著的自主活动减退[21],而毒品引起的成瘾却表现为自主活动增多[22]。阿片肽受体负责调节自主活动的基础信号水平,并与其他神经内分泌物质一同维持长期的效应[23]。阿片肽能神经元兴奋水平升高导致焦虑行为[24],而在焦虑状态下大鼠的自主活动会增加。吗啡诱导自主活动增多,另一种阿片肽受体拮抗剂纳美芬能在短时间内反转自主活动行为[25]。综合分析,阻断阿片肽系统奖赏机制后果糖偏好大鼠的自主活动行为有所好转。从行为学角度分析,果糖偏好大鼠自主活动中重复动作的变化说明模型大鼠在果糖条件下存在成瘾的焦虑状态,而Nal降低了果糖成瘾大鼠的焦虑水平。
本研究发现,Nal可以抑制果糖成瘾大鼠饮用果糖溶液时的自主活动同时增强自主运动行为。自主运动也表现为自愿进行的主动运动,是一种更为复杂形式的运动,正常情况下许多种类的动物在没有奖赏的条件下也具有很强烈的主动运动行为[26]。动物实验发现主动转轮运动可以做为奖赏的动机,大鼠能形成通过按压的行为方式获得转轮[27]。人类中也发现存在运动成瘾或运动依赖的现象,说明运动与奖赏系统存在复杂的联系[28]。习惯从事转轮运动的小鼠存在对转轮运动可变的奖赏阈值,实验发现使用可卡因可以增加正常小鼠的自主运动行为,但却降低了过度运动小鼠的运动行为[29]。大鼠主动运动行为的增多会伴有摄食的减少和体重下降,这一现象也被称为运动性厌食[30]。主动运动与成瘾行为在中枢内存在重叠的调控区域[31]。大鼠进行主动转轮运动降低位置偏好测试吗啡的奖赏作用[32],而耐力运动也可以增加内源性阿片肽的释放[33]。综合本研究实验结果,可以推测摄食成瘾行为与自主活动和主动运动行为在中枢系统可能存在相互增强或抑制的调控机制,这是否可以解释肥胖人群过度摄食但运动行为意愿下降还需要进一步的研究。
4 小结
阿片肽系统参与果糖偏好大鼠果糖的奖赏效应下自主活动增多、主动运动行为抑制的中枢调节过程。

