体外沉默PD-L1在T淋巴细胞细胞毒作用中的影响
白云龙 王建杰
(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
PD-L1(程序性死亡受体配体1)是免疫负向调控共刺激分子[1],主要表达于上皮细胞、肿瘤细胞、活化的T淋巴细胞、调节性T淋巴细胞和树突样细胞等[2]。一部分肿瘤细胞可以激发出特异性免疫应答,当T淋巴细胞对肿瘤进行特异性细胞免疫应答时,肿瘤细胞的TLRs(Toll样受体)可以介导上调PD-L1的表达量,而且一部分肿瘤细胞特异性高表达PD-L1,比如三阴性乳腺癌细胞株MDA-MB-231。从而削弱针对肿瘤细胞的特异性细胞免疫应答[3]。所以PD-L1对于增强细胞特异性免疫应答有着重要的意义,从而以PD-L1为靶点的药物开发有着重要的临床意义。本实验正是以体外实验为基础,评价PD-L1对于增强T淋巴细胞的细胞毒作用的效果。
1 材料与方法
1.1 主要试剂:MDA-MB-231人乳腺癌细胞株购自上海诺辰生物技术有限公司。胎牛血清购自clark公司,L15培养基购自gibco公司。转染试剂脂质体3000购自themor公司。淋巴细胞分离夜购自biosharp公司。PD-L1干扰质粒、无关对照干扰质粒、过表达质粒和空白质粒均由上海吉凯基因生物技术公司合成。细胞裂解液和蛋白酶抑制剂购自biosharp公司。PD-L1抗体、GAPDH、辣根过氧化物酶的兔抗鼠二抗购自成都正能生物技术公司。CD107a单克隆抗体购自R&D公司,FITC兔抗鼠标记抗体购自sigma公司。
1.2 人乳腺癌细胞株MDA-MB-231的培养:由于人乳腺癌细胞株MDA-MB-231需要L15培养基和无CO2的条件,所以在培养时选用细胞培养瓶瓶盖不透气的那种,除此之外其他条件相同。培养基中加10%的胎牛血清,37 ℃培养,2 d传代1次。
1.3 外周血单个核细胞的分离和与肿瘤细胞共培养:抽取志愿者外周血10 mL,放入抗凝管中,混匀,用等体积生理盐水稀释共20 mL。分装入事先装有2 mL淋巴分离夜的4个离心管中,2500 rmp离心20 min。悬浮于淋巴分离夜中的细胞即为外周血单个核细胞。将外周血单个核细胞吸入新的离心管中加入RPMI1640培养基10 mL,2500rmp离心5 min洗涤3次以洗除血小板。洗后倒掉培养基加入含10%胎牛血清的RPMI1640重新悬浮细胞,加入六孔板中每空1.5 mL,而后每孔加入溶于1 mLL15培养基中的1.5×106个肿瘤靶细胞。由于想得到活化的T淋巴细胞,必先活化抗原提程细胞包括树突状细胞。所以首先每孔加入一万单位的重组人干扰素伽玛使树突状细胞处于可激活状态。1 d后,加入脂多糖,一种Toll样受体配体,每孔10 μL,浓度100 μg/μL,培养3 d。
1.4 用western blotting的方法检测转染PD-L1siRNA干扰质粒和过表达PD-L1质粒PD-L1的表达情况。
共培养3 d后,T淋巴细胞被激活,活化的靶向肿瘤细胞的特异性T淋巴细胞开始形成[4]。由于T淋巴细胞不贴壁,悬浮于培养液中,所以换液时将细胞培养液吸入离心管中再加入PBS定容混匀,离心2500 rmp,5 min,倒掉液体加入培养基吹匀,继续和靶细胞共培养。1 d后将六孔板的细胞分成5组,分别是不做任何处理组、转染PDL1siRNA组、转染无关siRNA组、空质粒组、PD-L1过表达组。
1.5 用流式细胞方法检测:取六孔板中已转染细胞,将细胞刮下用PBS清洗3遍,用4%多聚甲醛固定0.5 h,之后用PBS洗3遍,4 ℃一抗孵育1 h后,用PBS洗1遍,再4 ℃避光二抗孵育0.5 h后洗3遍,然后上机检测。
2 结 果
2.1 western blotting 检测,一共做了3次,蛋白表达情况趋势均相同,取其中一次结果,见图1,PD-L1siRNA干扰组,PD-L1的表达明显下调,而PD-L1过表达组PD-L1表达上调,不做任何处理组、空质粒组、无关siRNA组无明显变化。
2.2 流式细胞检测,一共做了3次,波峰移动趋势均相同,其中一次结果见图2,PD-L1siRNA组与不做任何处理组、空质粒组、无关siRNA组、PD-L1过表达组比较,荧光强度增加,波峰右移。
3 讨 论
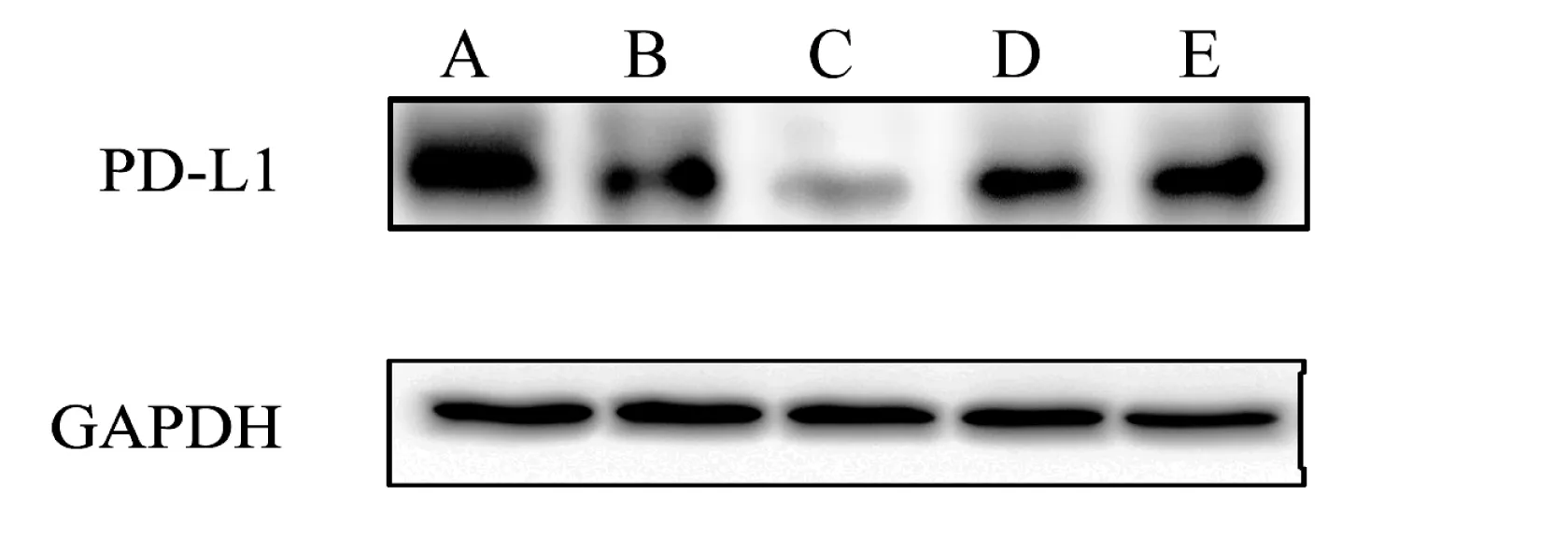
图1 WESTERN BLOT法检测各组细胞PD-L1蛋白表达情况
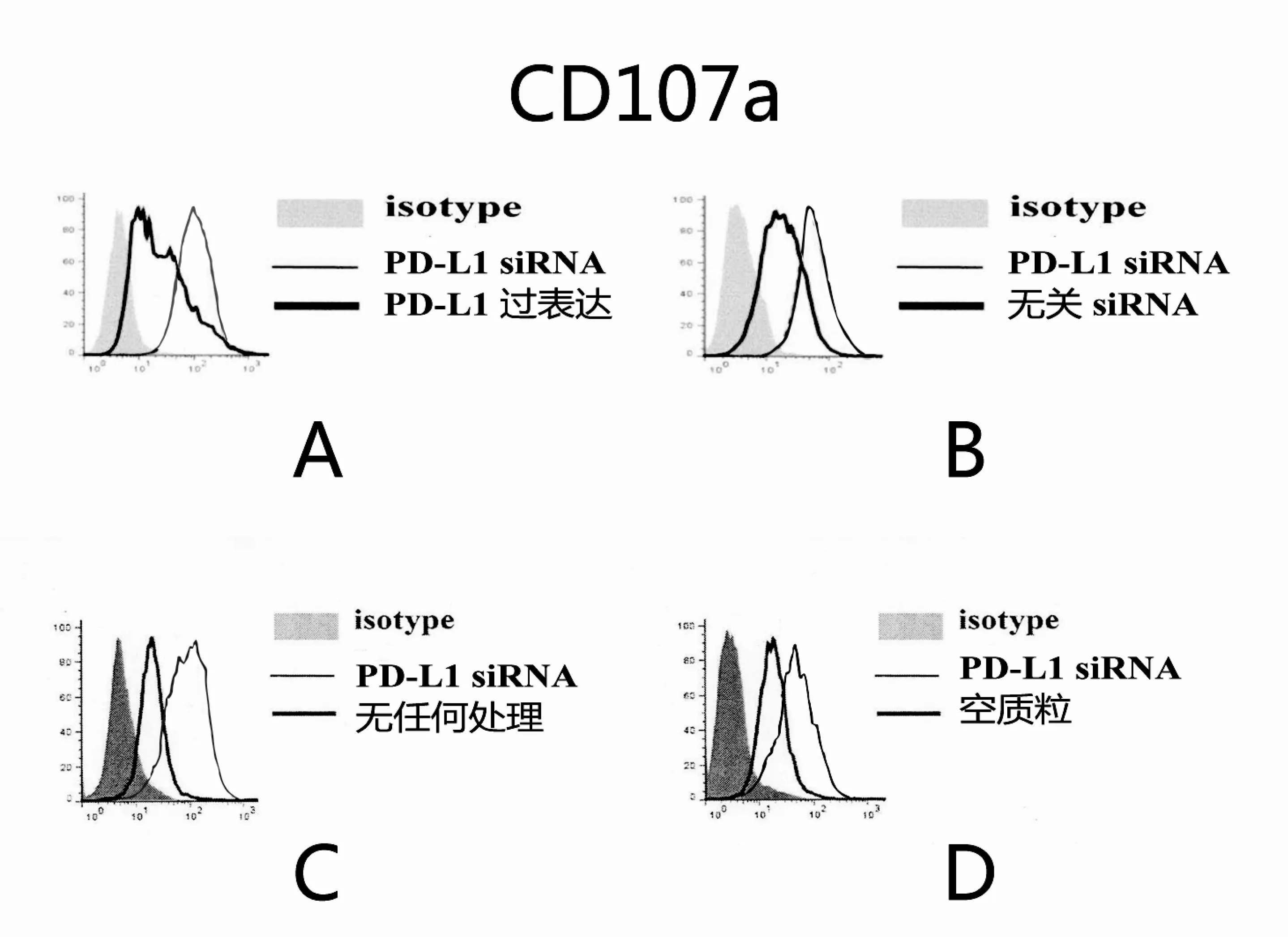
图2 流式细胞检测PD-L1对T淋巴细胞细胞毒作用的影响
依靠人体自身免疫系统去预防和治疗肿瘤,这无疑是最理想的治疗方式。从1863年德国医师魏尔啸发现肿瘤组织浸润大量免疫细胞开始,到现在科学家一直为这个理想努力着,但是这一理想始终没能实现。除了肿瘤本身因素比如恶性程度比较高的肿瘤细胞抗原提程能力下降使机体免疫系统无法有效识别,此外最主要的原因就是机体免疫系统对肿瘤的杀伤存在负向调控机制[5]。本实验研究的PD-L1就是其中之一。无论是正常上皮细胞还是恶变的细胞,也就是肿瘤细胞,都存在PD-L1的表达,一些肿瘤细胞表面的表达量更高[6]。PD-L1的表达主要受TLR4-NF-κB -IL-6-stat3信号通路的调控[7]。CD107a是溶酶体膜相关糖蛋白,活化的T淋巴细胞杀伤靶细胞依靠的是颗粒酶和穿孔素。它们的本质就是分泌型溶酶体。CD107a就存在于包绕它们的脂质双分子层中。在活化的T淋巴细胞脱颗粒时,溶酶体膜和细胞膜发生融合,溶酶体膜中的糖蛋白即CD107a也融在了细胞膜表面,所以CD107a可以衡量T淋巴细胞细胞毒作用的强度。流式检测结果,PDL1siRNA干扰组的细胞与其他组相比波峰右移,说明荧光强度比其他组要强,证明了下调PD-L1可以增强细胞免疫强度。这也为肿瘤的生物治疗提供了一个思路。
——一道江苏高考题的奥秘解读和拓展

