微创内镜保胆取息肉术与腹腔镜胆囊切除术治疗胆囊息肉的效果比较
李兵内蒙古赤峰市赤峰学院附属医院普外一科,内蒙古赤峰 024000
随着影像学技术的不断发展以及人们健康意识的增强[1],胆囊息肉的检出率逐年升高。胆囊息肉在消化系统疾病中发病率较高[2]。手术能够有效治疗胆囊息肉,但临床上对是否应该行胆囊切除术治疗胆囊息肉存在争议。医学技术的发展提高了临床对胆囊息肉性质以及胆囊功能的认识,进而出现了微创内镜保胆取息肉术。该文旨在对比微创内镜保胆取息肉术和腹腔镜胆囊切除术治疗胆囊息肉的临床效果,从该院2015年5月—2016年4月期间收治的胆囊息肉患者中抽取84例作为对象展开研究,见下文。
1 资料与方法
1.1 一般资料
将该院收治的胆囊息肉患者84例计算机随机分为观察组和对照组,每组患者42例。纳入标准:①经多种影像学检查方法(CT、B超、胆囊彩超)确诊为胆囊息肉。②息肉直径范围为0.5~1.5 cm。③临床主诉均为上腹部不适以及食欲减退等。排除标准:①存在心肺功能衰竭、肝肾功能衰竭、凝血功能异常疾病的患者。②合并急性胆囊炎的患者。③存在既往上腹部手术史的患者。④腹腔粘连明显的患者。⑤存在手术禁忌证的患者。观察组:男24例,女18例,年龄24~67(43.18±5.76)岁,病程 1~7(3.26±1.42)年。 单发胆囊息肉30例,多发胆囊息肉12例。对照组:男25例,女17 例,年龄 25~68(43.24±15.81)岁,病程 1~8(3.32±1.48)年。单发胆囊息肉29例,多发胆囊息肉13例。两组胆囊息肉患者之间对比基线资料方面差异无统计学意义(P>0.05)。
1.2 方法
腹腔镜胆囊切除术--对照组,予以全身麻醉,之后将患者摆放成平卧位,在脐部下缘作一切口,将10 mm的套管针置入,在人工气腹建立后,维持气腹压在10~15 mmHg之间,将腹腔镜置入,对胆囊及其周围情况进行详细探查。分别作切口于右锁骨中线、右腋前线肋缘下2 mm、剑突下,将套管针以及操作器械置入。分离胆囊和腹壁,将胆囊提起并切除。若存在胆囊解剖位置不明的情况,应在将胆囊剥离后切除;顿性分离壶腹部膨大者的三角区,在腹壶提升后切除胆囊;患者若存在胆囊管增粗的情况,将胆囊管使用阶梯上肽夹法夹闭,之后再将胆囊切除。术后予以抗生素。
微创内镜保胆取息肉术--观察组,患者行全麻以及取平卧位,作一横向切口于脐部下缘,在置入套管针(10 mm)后建立人工气腹(气腹压为 10~15 mmHg),腹腔镜从套管针内置入,在腹腔镜下对胆囊及其周围组织情况进行观察。在腹腔镜引导下作一2~3 cm的斜行切口于右肋缘下墨菲点处,将肌层逐层切开,在穿透腹膜后将胆囊底提起,打开腹膜,将胆囊提到切口处,使用牵引线4根缝合至胆囊底无血管区浆肌层,在将胆囊底切开之后,吸尽胆汁。将纤维胆道镜插入,探查胆囊情况,在胆囊镜的观察下注入生理盐水进行冲洗,在胆囊腔内液体转为清亮后停止注入,依次检查胆囊腔和胆囊管开口。对胆囊腔内息肉的数量、大小以及性状进行观察,使用活检钳对息肉蒂根部进行夹持并摘除;如息肉位置在胆囊底部,则将部分胆囊壁切除。术中存在活动性出血情况,需立即进行电凝止血或局部喷洒肾上腺素溶液。在摘除息肉后迅速送检,以排除恶性病变,良性病变者在观察到胆囊内无息肉残留及活动性出血后,使用冰生理盐水对胆囊腔进行反复冲洗,直至胆囊管开口流出胆汁,退出纤维胆道镜。连续外翻缝合胆囊底部切口,将胆囊回纳到腹腔内,通过腹腔镜再次观察胆囊情况,吸尽腹腔残留积液,将腹腔镜撤出,排空腹腔内气体,之后将腹部切口缝合。
1.3 观察指标及疗效判定标准
1.3.1 观察指标 观察两组胆囊息肉患者的围术期相关指标,包括手术时间、术中出血量、术后肛门排气时间、恢复进食时间、住院时间。观察两组胆囊息肉患者在术后临床症状的变化,评估临床治疗效果[3]。统计两组胆囊息肉患者术后并发症发生率以及疼痛发生率。1.3.2疗效判定标准 ①显效标准:患者术后临床症状完全消失,经复查未发现胆囊息肉。②有效标准:患者的临床症状及体征在术后出现较大改善,胆囊息肉切除率在50.00%以上。③无效标准:上述标准均未达到。两组胆囊息肉患者的临床总有效率为①+②的概率之和。
1.4 统计方法
将该文数据录入到SPSS 20.0统计学软件进行统计处理,计数资料和计量资料分别用[n(%)]、均数±标准差(±s)表示,并分别行 χ2检验,t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组的围术期相关指标
在经过治疗后,观察组胆囊息肉患者的5项围术期相关指标均比对照组优,差异有统计学意义。见表1。
表1 对比两组胆囊息肉患者的围术期相关指标(±s)
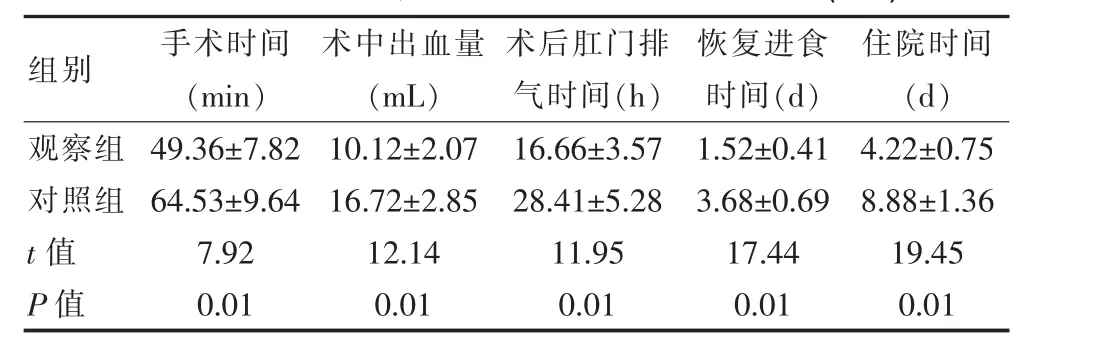
表1 对比两组胆囊息肉患者的围术期相关指标(±s)
组别 手术时间(min)术中出血量(mL)术后肛门排气时间(h)恢复进食时间(d)住院时间(d)观察组对照组t值P值49.36±7.82 64.53±9.64 7.92 0.01 10.12±2.07 16.72±2.85 12.14 0.01 16.66±3.57 28.41±5.28 11.95 0.01 1.52±0.41 3.68±0.69 17.44 0.01 4.22±0.75 8.88±1.36 19.45 0.01
2.2 两组的临床疗效
观察组胆囊息肉患者的临床总有效率与对照组相比明显更高(P<0.05),见表 2。
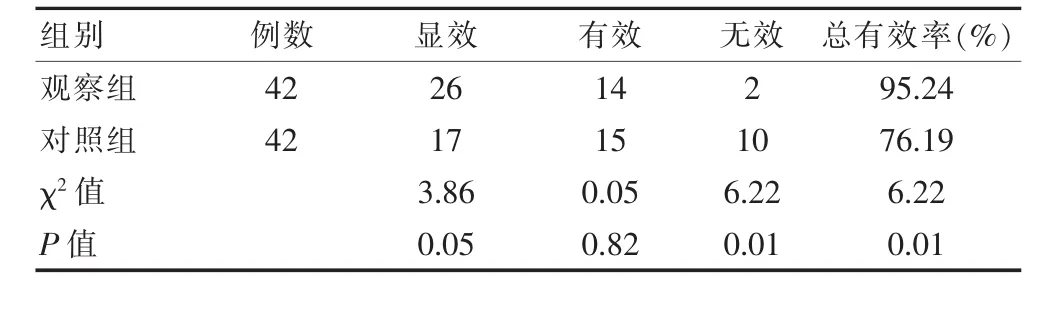
表2 两组胆囊息肉患者临床总有效率的对照
2.3 两组的术后并发症发生情况和疼痛发生率
观察组胆囊息肉患者中出现恶心呕吐2例,腹泻1例,其他2例,总发生率为11.90%;术后疼痛发生率为7.14%(3/42)。对照组胆囊息肉患者的并发症发生率为30.95%,包括6例恶心呕吐,3例腹泻,4例其他;术后疼痛发生率为23.81%(10/42)。两组胆囊息肉患者之间对比并发症发生率和疼痛发生率差异有统计学意义(χ2=4.53、4.46,P<0.05)。
3 讨论
胆囊是人体内储存胆汁、浓缩胆汁、分泌粘液、排空胆汁的重要器官[4],以阵发性呕吐、腹胀、腹痛以及不能耐受脂肪食物等为主要临床症状[5],尽早为患者进行治疗有利于缓解患者的疼痛,改善临床症状。
腹腔镜胆囊切除术是治疗胆囊息肉的传统术式[6],其通过将胆囊切除能够使胆囊疾病问题彻底解决,术后胆囊息肉不容易出现恶变以及复发,但在术后并发症发生的概率较大,且切除胆囊会导致腹泻、反流性胃炎、消化不良等消化道并发症发生[7],甚至还会损伤患者胆道。另外,胆囊息肉患者在切除胆囊后,胆总管存在代偿性扩张的风险,极易出现胆总管结石。
微创内镜保胆取息肉术的手术方式主要包括完全腹腔镜和腹腔镜辅助、小切口3种,该文使用腹腔镜辅助的方式进行微创内镜保胆取息肉术,能够在明确胆囊位置后进行保胆术,另外术中采用胆囊镜能够对胆囊分布情况、数目、大小及其性状进行明确[8],将术中观察盲区消除,避免息肉残留。微创内镜保胆取息肉术能够避免腹腔镜胆囊切除术造成的血管损伤及医源性胆道损伤,还能通过病理检查对发现的胆囊恶性病变进行及时处理,术中及时对创面进行止血处理,有利于胆囊壁出血量的减少,进而使保胆成功率提高[9]。同时微创内镜保胆取息肉术能够使胆囊功能保留,维持胆囊的正常形态,不会对全身造成影响,可使术后机体的生理消化功能得到满足,具有手术简捷、创伤小、并发症少、术后恢复快等优势,被广大患者所接受。与腹腔镜胆囊切除术进行比较,微创内镜保胆取息肉术可更好的提高胆囊息肉患者的生活质量。
该文研究数据显示,观察组胆囊息肉患者的手术时间、术中出血量、术后肛门排气时间、恢复进食时间、住院时间5项围术期相关指标与对照组相比更具优势(P<0.05),说明微创内镜保胆取息肉术效果更有利于胆囊息肉患者的恢复,不会对患者的机体正常生理功能造成较大影响;观察组胆囊息肉患者的临床总有效率(95.24%)、并发症发生率(11.90%)和疼痛发生率(7.14%)同对照组进行比较差异有统计学意义(P<0.05),说明微创内镜保胆取息肉术更加安全有效。宁建功[10]在《微创内镜保胆手术与腹腔镜胆囊切除术治疗胆囊息肉对比研究》一文中提及,采用微创内镜保胆手术治疗的胆囊息肉患者并发症发生率为16.67%,疼痛发生率为13.69%,同该文数据相差不大,说明该次研究结果的可靠性较高。
综上所述,在治疗胆囊息肉中,微创内镜保胆取息肉术同腹腔镜胆囊切除术相比优势更加明显,适合推广应用在临床中。
[1]郭庆峰,李娜,姜涛.微创内镜保胆取息肉术与腹腔镜胆囊切除术治疗胆囊息肉的临床对比研究[J].现代消化及介入诊疗,2015,20(4):368-369.
[2]刘庆阳,卢进业,张飞,等.微创内镜保胆取息肉术治疗胆囊息肉64例临床分析[J].承德医学院学报,2015,32(3):212-213.
[3]张蔚,薛皓皓,李雯,等.腹腔镜内镜微创保胆术治疗胆囊息肉的meta分析[J].中国医科大学学报,2016,45(11):1013-1016.
[4]贺小俭.探析腹腔镜内镜微创保胆治疗胆囊息肉的临床效果[J].国际医药卫生导报,2016,22(4):494-496.
[5]王辉华,陈勇,李江华.微创内镜保胆术与腹腔镜胆囊切除术治疗胆囊息肉疗效比较[J].海南医学,2016,27(15):2526-2528.
[6]赖光芒,黄宏伟,陈志伟.微创内镜保胆术与腹腔镜胆囊切除术治疗胆囊息肉疗效比较[J].海南医学,2016,27(13):2206-2207.
[7]张保柱.两种不同手术疗法在胆囊息肉治疗中的应用价值对比[J].基层医学论坛,2017,21(13):1655-1656.
[8]刘家勇,胡世荣,谢可可.腹腔镜联合胆道镜保胆取息肉术在胆囊息肉患者中的应用[J].中国医学工程,2015,23(8):173.
[9]陈敏胜.两种手术对胆囊息肉的疗效对比[J].中国实用医刊,2015,42(21):104-105.
[10]宁建功.微创内镜保胆手术与腹腔镜胆囊切除术治疗胆囊息肉对比研究[J].饮食保健,2017,4(1):287-288.

