两株野生桑黄液体发酵产物抗氧化活性比较
吕国英 王 霄 宋婷婷张作法*
两株野生桑黄液体发酵产物抗氧化活性比较
吕国英1王 霄2宋婷婷1张作法1*
(1. 浙江省农业科学院园艺研究所,浙江 杭州 310021;2. 浙江工业大学药学院,浙江 杭州 310014)
以采自四川和安徽的两株野生桑黄液体发酵所得的菌丝体和发酵液为比较分析对象,检测其抗氧化活性。结果表明,发酵液和菌丝体对DPPH自由基、ABTS自由基和羟自由基的清除能力均较强,表现出较高的抗氧化活性;黄酮含量与抗氧化活性基本呈正相关;安徽菌株A的抗氧化活性略优于四川菌株S。
桑黄;液体发酵;抗氧化
桑黄(s)是一种大型药用真菌,主要生长在桑树等活立木上[1,2]。桑黄提取物具有明显的抗肿瘤、抗氧化、提高免疫等一系列药理作用,目前已成为药用真菌研究领域的热点[3]。由于桑黄有严格的寄主选择和特殊的环境要求,自然界中子实体生长缓慢,且大量的人工采伐导致野生桑黄越来越少。桑黄虽能人工栽培,但所需条件苛刻,获得效率低下,目前难以实现规模化栽培。桑黄较容易分离培养,菌丝体发酵培养能获得大量的代谢物,有些活性物质含量比子实体还要高,而且生产周期短、易于控制,不受季节气候限制,并可自动化控制规模化生产[4]。对其活性成分研究最多的是多糖抗肿瘤活性,其次为抗氧化作用。
本研究以两株野生桑黄液体发酵后菌丝体和发酵液为指标,考察其DPPH自由基清除能力、ABTS自由基清除能力和羟自由基清除能力,以期为该种药用真菌的功能性成分提取和保健产品的开发应用提供理论依据。
1 材料与方法
1.1 供试材料
菌株:桑黄菌株S和A,分别采自四川和安徽的活桑树,经分离纯化获得,保存在本实验室。试剂: DPPH、ABTS、过硫酸钾购自Sigma;其他的试剂为分析纯。
1.2 培养基
PDA斜面培养基(g/L)配方:土豆200 g、葡萄糖20 g、琼脂20 g,水1 000 mL。PDA液体培养基(g/L)配方:马铃薯200 g,葡萄糖20 g,水1 000 mL。
1.3 摇瓶发酵培养
从活化的斜面培养基上取一定量的菌丝块接种到装有100 mL PDA液体培养基的250 mL三角瓶中,150 r/min、25 ℃下振荡培养8天。
1.4 样品制备
将发酵液进行减压抽滤,收集抽滤所得的滤液,为发酵培养液(S培和A培),用于测定抗氧化活性。
1.5 DPPH清除率的测定
1 mL样品加入1 mL 0.01%的DPPH溶液(乙醇︰二甲基亚砜=1︰1的溶液溶解),振荡反应30 min后,在517 nm处测定吸光度。以纯溶剂代替同样体积的样品作为空白[5]。
DPPH清除率(%)=(1-A517样品/A517空白)×100%。
1.6 ABTS+清除率的测定
配制2.46 mM过硫酸钾,用过硫酸钾溶解ABTS,配成7 mM ABTS储备液,在室温、避光条件下静置12~16 h;将ABTS+以磷酸缓冲液(10 mmol/L,pH=7.4)稀释,使其吸光度在734 nm波长处达到0.7±0.02。然后取4 mL的ABTS+测定液,加入40 μL的样品待测液,准确振荡30 s,在734 nm处测定吸光度[6]。
ABTS+清除率(%)=(1-A734样品/ A734空白)×100%。
1.7 羟自由基清除率的测定
1 mL样品加入1 mL FeSO4(12 mmol/L),再加入1 mL H2O2(12 mmol/L),37 ℃下保温10 min,再加入1 mL 6 mmol/L的水杨酸,37 ℃下保温30 min,然后10 000 r/min,4 ℃下离心10 min,取上清液在510 nm处测定吸光度。以纯溶剂代替同样体积的样品作为空白[7]。
1.8 黄酮含量的测定
标准曲线的制作:准确称取25.0 mg芦丁标准品,用80%乙醇溶解并定容至50.0 mL,即为标准液。标准液分别稀释为0.1、0.2、0.3、0.4、0.5 mg/mL,各取1 mL,加60 μL 5%的NaNO2,摇匀,静置5 min,加入60 μL 10%的Al(NO3)3,混匀,静置6 min,加入0.8 mL 1 M的NaOH溶液,再补充80 μL纯水/或者80%乙醇至2 mL总体积。反应10 min,在510 nm下测试吸光度,用80%乙醇代替同样体积的样品作为空白。做3组平行测试,最终吸光度值为3次测试的平均值[8]。
以反应体系中芦丁标准品的浓度为横坐标,吸光值为纵坐标作标准曲线,计算回归方程为y = 2.019 9x + 0.046 3,2= 0.996 3。
2 结果与分析
2.1 清除DPPH自由基的能力
有自由基清除剂存在时,·DPPH的单电子被配对而使其颜色变浅,在最大吸收波长处的吸光度变小,而且这种颜色变浅的程度与配对电子数是成化学剂量关系的。因此可用于检测自由基的清除情况,从而评价实验样品的抗氧化能力。几个不同浓度梯度的样品进行了DPPH清除率的测定,结果见表1。
可以看出,两个菌株菌丝体和发酵液均有良好的·DPPH清除能力。菌株A(安徽)的清除效果略优于菌株S(四川);特别是稀释64倍的A菌株发酵液的清除率达到100%,完全可以忽略空白培养基本身的清除能力。说明有一大部分的抗氧化物质分泌在细胞外。菌株A优于菌株S。
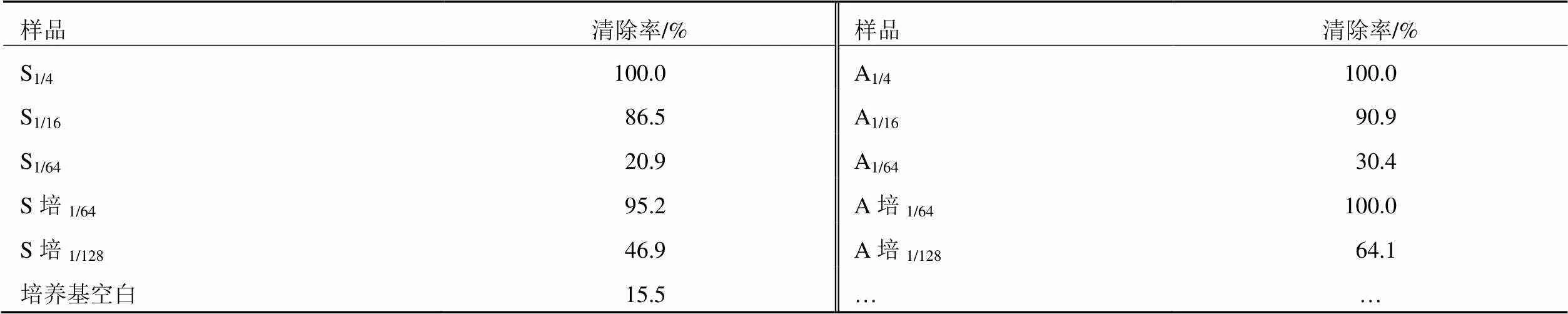
表1 发酵样品DPPH清除率
注:1/4,1/16等表示稀释4倍,16倍;培养基空白表示灭菌后未接种。
2.2 清除ABTS+的能力
ABTS经过硫酸钾氧化后生成稳定的蓝绿色阳离子自由基ABTS+,能溶于水相或酸性乙醇介质中,在734 nm处有最大吸收。被测物质加入ABTS+溶液后所含抗氧化成分能与ABTS+发生反应而使反应体系褪色。结果如表2。
可以看出,菌株A的菌丝体和发酵液的ABTS+清除率都明显优于菌株B;菌株A的发酵液稀释16倍后,清除率为94.5%,尽管空白培养基有较大的干扰,但稀释16倍后基本可以忽略其影响。菌株A明显优于菌株S。
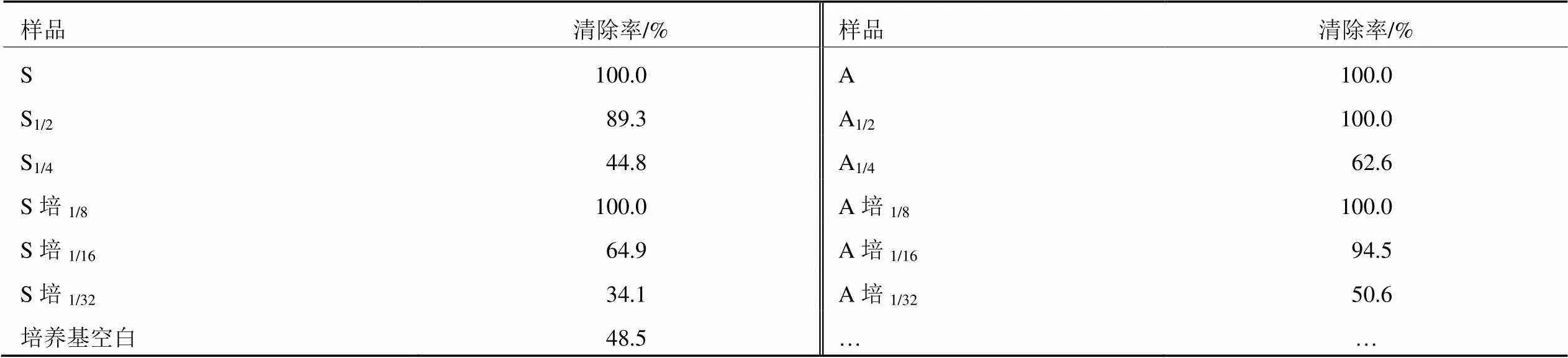
表2 发酵样品ABTS+清除率
注:1/4,1/16等表示稀释4倍,16倍;培养基空白表示灭菌后未接种。
2.3 清除羟自由基的能力
H2O2和Fe2+混合产生羟自由基,在体系内加入水杨酸,可捕捉羟自由基并产生有色物质,该物质在510 nm处有最大吸光值。当反应体系中存在·OH自由基清除剂时,此氧化过程受到抑制,吸光度值则降低,通过测定A510,可以间接测定样品的·OH自由基清除能力。
两种菌株发酵液对羟自由基清除能力明显低于对前两种自由基的清除能力(表3),空白培养基本身的清除能力对结果产生一定的干扰;菌丝体的羟自由基清除效果仍很明显。菌株S效果略优于菌株A。

表3 发酵样品羟自由基清除率
注:1/2,1/4等表示稀释2倍,4倍;培养基空白表示灭菌后未接种。
2.3 黄酮含量
黄酮是一类天然产物,广泛存在于植物和真菌的次级代谢产物中,具有抗癌、抗衰老、抗炎、降血糖、降血压、调节内分泌等多种功能,还可有效地清除羟自由基等,是一类具有广阔开发前景的天然抗氧化剂[9]。本研究中空白的培养液510 nmAbs为0,故可以排除培养液所含物质对吸光度的干扰。安徽菌株A的发酵培养液中黄酮含量为5.25 mg/mL,明显高于四川菌株S的2.89 mg/mL(图1);菌丝体的黄酮含量安徽菌株A略优于四川菌株S。发酵培养液的总黄酮含量要高于菌丝体的细胞破碎液,说明随着菌种的新陈代谢,有大量的黄酮类物质被排出细胞外,进入培养液中。
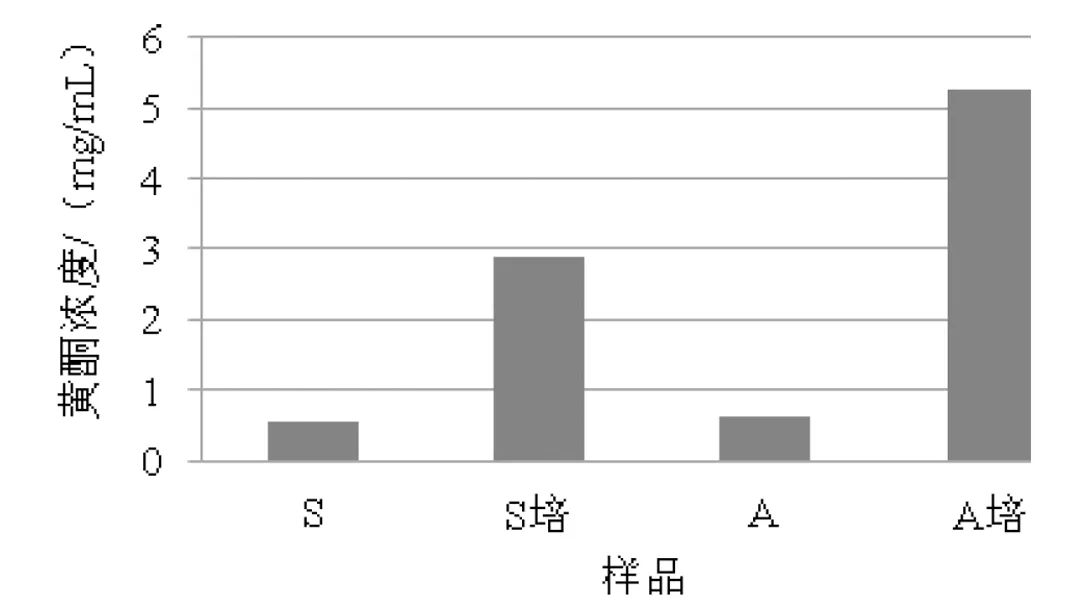
图1 样品中的黄酮含量
3 结论与讨论
研究表明,癌症、衰老或其他疾病大都与过量自由基的产生有关,能够消除过多的氧化自由基,对于许多自由基引起的及与老化相关的疾病都能起预防作用。本研究中选取几种典型的自由基为对象,考察桑黄发酵物对其清除能力。结果显示,安徽菌株优于四川菌株,特别是安徽菌株发酵液稀释64倍,DPPH清除率仍达到100%。两种菌的发酵液在稀释的情况下对几种自由基的清除率都可以达到100%,这与发酵液中黄酮含量高有关。黄酮类化合物因酚羟基上的氢原子可与过氧自由基结合生成黄酮自由基,进而与其他自由基反应,从而终止自由基链式反应[9, 10]。而黄酮类物质在植物中普遍存在,但在大型真菌中则很少见。
本研究评价了在液体培养条件下桑黄的抗氧化能力,为其生物活性的研究奠定了基础,同时也为进一步开发利用该药用真菌提供了理论依据。
[1] 戴玉成, 崔宝凯. 药用真菌桑黄种类研究[J]. 北京林业大学学报, 2014, 36(5): 1-6.
[2] 戴玉成.中国木本植物病原木材腐朽菌研究[J]. 菌物学报, 2012, 31(4): 493-509.
[3] Yan JK, Wang YY, Ma HL, Wang ZB. Ultrasonic effects on the degradation kinetics, preliminary characterization and antioxidant activities of polysaccharides frommycelia[J]. Ultrasonics Sonochemistry, 2016, 29: 251-257.
[4] Ma XK, Zhang H, Peterson EC, Chen L. Enhancing exopolysaccharide antioxidant formation and yield fromspecies through medium optimization studies[J]. Carbohydrate Polymers, 2014, 107: 214-220.
[5] 王钦博, 杨焱, 冯娜, 等. 桑黄抗氧化活性化合物的分离纯化及结构解析[J]. 天然产物研究与开发, 2013, 25: 17-21.
[6] 樊锦艳, 王秋颖, 薛梅, 等. 桑黄胞外多糖生产培养基的初步研究[J]. 食品科技, 2004(2): 93-95.
[7] Nicholas S, Quinton JC. Hyroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry, 1989, 28(4): 1057-1060.
[8] Zhang ZF, Lv GY, Song TT, Jin QL, Huang JB, Fan LF, Cai WM. Comparison of the preliminary characterizations and antioxidant properties of polysaccharides obtained from Phellinus baumii growth on different culture substrates[J]. Carbohydrate Polymers, 2015, 132: 397-399.
[9] 孙庆雷, 王晓, 刘建华, 等. 黄酮类化合物抗氧化反应性的构效关系[J] . 食品科学, 2005, 26(4): 69-73.
[10] 唐功. 活性氧∙抗氧化酶及抗氧化剂之间关系的探讨[J]. 安徽农业科学, 2010, 38(33): 18619-18621.
浙江省“十三五”食用菌育种专项(项目编号:2016C02057-8)
,E-mail:269837576@qq.com。
S646
B
2095-0934(2018)03-175-04

