ChRM3对胆管癌神经浸润的影响
(青岛大学附属医院,山东 青岛 266003 1 肝胆外科; 2 崂山院区业务部)
胆管癌是一种恶性程度极高,具有高度侵袭性的肿瘤,起病隐匿,早期即可发生周围浸润及远处转移,具有诊断率低,病死率高的特点[1]。手术切除是唯一有效的治疗方法,但是手术切除率低,术后复发率高,对放、化疗不敏感,导致其预后较差[2]。近年来研究显示,胆管癌术后易复发及预后差与其具有的一种生物学特性—神经浸润密切相关。研究表明胆管系统具有十分丰富的自主神经,胆管恶性肿瘤距腹腔神经丛的距离较近,肿瘤易侵犯周围的神经丛,发生神经浸润[3]。许多学者认为,胆管癌周围神经递质的分泌对胆管癌的神经浸润具有积极影响。我们推测周围神经递质可能是通过激活毒蕈碱型乙酰胆碱受体M3(ChRM3)来发挥作用,ChRM3在胆管癌神经浸润过程中起到重要作用,本实验目的是通过建立体外神经浸润模型,观察ChRM3在激动剂匹罗卡品及其拮抗剂阿托品作用下对胆管癌神经浸润能力的影响。
1 材料与方法
1.1 标本来源
2010年1月—2013年12月,我院肝胆外科手术切除后经石蜡包埋的胆管病理组织标本90例,其中60例为腺癌组织标本,30例为正常胆管组织标本。
1.2 细胞系和主要试剂
胆管癌RBE细胞系购自中国科学院上海细胞库,RPIM1640培养基以及胎牛血清(FBS)由美国Hyclone公司提供,匹罗卡品购自美国Sigma公司,硫酸阿托品由武汉昌恒生物医药制品研究所提供,昆明种纯系胚胎小鼠由青岛市药检所动物实验中心提供。
1.3 细胞培养
RBE胆管癌细胞系,用含体积分数0.10胎牛血清的RPMI 1640培养液,于37 ℃、含体积分数0.05的CO2的恒温培养箱内进行培养,定期换液,待细胞80%~90%融合后用含有2.5 g/L EDTA的胰酶消化,配成细胞悬液,接种于培养瓶,取对数生长期的细胞用含2.5 g/L EDTA的胰酶消化备用,每天用倒置显微观察细胞生长情况,定期拍照记录。
1.4 免疫组化法检测ChRM3的表达情况
标本均采用40 g/L中性甲醛溶液固定,常规脱水,石蜡包埋,4 μm厚连续切片,采用免疫组化PV-6000二步法对切片进行免疫组化染色。每批实验均设阳性对照,用PBS代替一抗作为阴性对照。免疫组化阳性判断标准为细胞膜及细胞质出现棕褐色颗粒,分级如下:随机选择8~10个视野(100倍)的阳性细胞核的数目来进行半定量评估,分为4级:阴性(-),阳性细胞数<5%;弱阳性(+),阳性细胞数占5%~25%;阳性(),阳性细胞数占26%~50%;强阳性(),阳性细胞数>50%;所有标本均经2名病理科高年资主治医师审核证实。
1.5 体外胆管癌神经浸润模型的建立
本实验小鼠DRG-RBE细胞共培养模型培养液分共为4组,分别为mock组(单独加含血清RPMI 1640培养基)、PILO组(含有血清RPMI 1640培养基+匹罗卡品1 mmol/L)、PILO+ATR组(含血清RPMI 1640培养基+匹罗卡品1 mmol/L+阿托品0.1 mmol/L)、ART组(含有血清RPMI 1640培养基+阿托品0.1 mmol/L)。取对数期生长的RBE胆管癌细胞用2.5 g/L胰酶消化,离心并重悬于含胎牛血清RPMI 1640培养液中,细胞计数板计数,调整细胞密度至1.0×108个/L备用。整个操作在超净工作台上进行,将小鼠脱颈处死,在显微镜下切取并修剪背根神经节(DRG)后置于生理盐水中清洗备用。6孔板各孔均放入0 ℃预冷的1 cm×1 cm大小的消毒盖玻片,将备用的DRG置于盖玻片中央,从冰浴中取50 μL Matrigel覆于DRG上,然后将6孔板置于37 ℃培养箱中,固化30 min后分别加入预先制备好的细胞悬液2 mL,将Matrigel和DRG完全覆盖,操作完后将6孔板置于37 ℃、含体积分数0.05 CO2的培养箱中培养,每隔4 h倒置显微镜下观察RBE细胞与神经纤维的黏附状况,并照相记录。36 h后经40 g/L中性甲醛溶液固定,通过Nissl染色、Gomori染色和神经丝蛋白免疫组化染色(NF IHC)后,置于倒置显微镜下观察,在高倍镜下计数,分别取5个高倍镜视野下细胞计数,并取平均值。
2 结 果
2.1 ChRM3在两种组织中的表达
ChRM3在胆管癌组织和正常胆管组织中的阳性表达率分别为90.00%(54/60)、3.33%(1/30),差异有统计学意义(P<0.01)。见图1a、b。并且神经浸润在胆管癌组织中发生率为91.7%(55/60)。见图1c、d。
2.2 各组RBE细胞浸润DRG及其周围神经纤维的比较
通过Nissl染色发现,体外培养的DRG存活良好,其尼氏体呈颗粒状,核周尼氏体颗粒明显,核边缘处较小,而且活力旺盛(图2a)。Gomori染色以及NF IHC染色见有神经突起自DRG周缘长出,多数突起结构有分支,大体呈放射状排列(图2b、c、d)。在DRG-RBE细胞共培养模型培养36 h后,可见RBE细胞浸润DRG及其周围神经纤维(图3a),浸润细胞数目为18.00±0.71,在DRG-RBE细胞共培养模型中加入匹罗卡品后,RBE细胞浸润DRG及其周围神经纤维的数量明显增加(图3b),浸润细胞数目为31.60±0.93,差异具有统计学意义(t=11.66,P<0.05)。在加入匹罗卡品拮抗剂阿托品后明显减弱,表现为浸润DRG的RBE 细胞的数量减少(图3c),浸润细胞数目为20.00±0.71,差异具有统计学意义(t=9.95,P<0.05)。而在DRG-RBE细胞共培养模型中单独加入阿托品以后,RBE细胞浸润DRG及其周围神经纤维的数量无明显的变化(图3d),浸润细胞数目为20.20±0.86,与对照组相比差异无统计学意义(P>0.05)。
3 讨 论
肝胆系恶性肿瘤中,胆管癌是除肝癌之外发病率最高的恶性肿瘤,约占10%~15%。手术根治性切除是胆管癌唯一有效的治疗方法,但由于胆管癌早期不易被发现,且易发生周围浸润,导致大部分病人诊断时已处于中晚期,R0切除率降低且术后复发率升高。
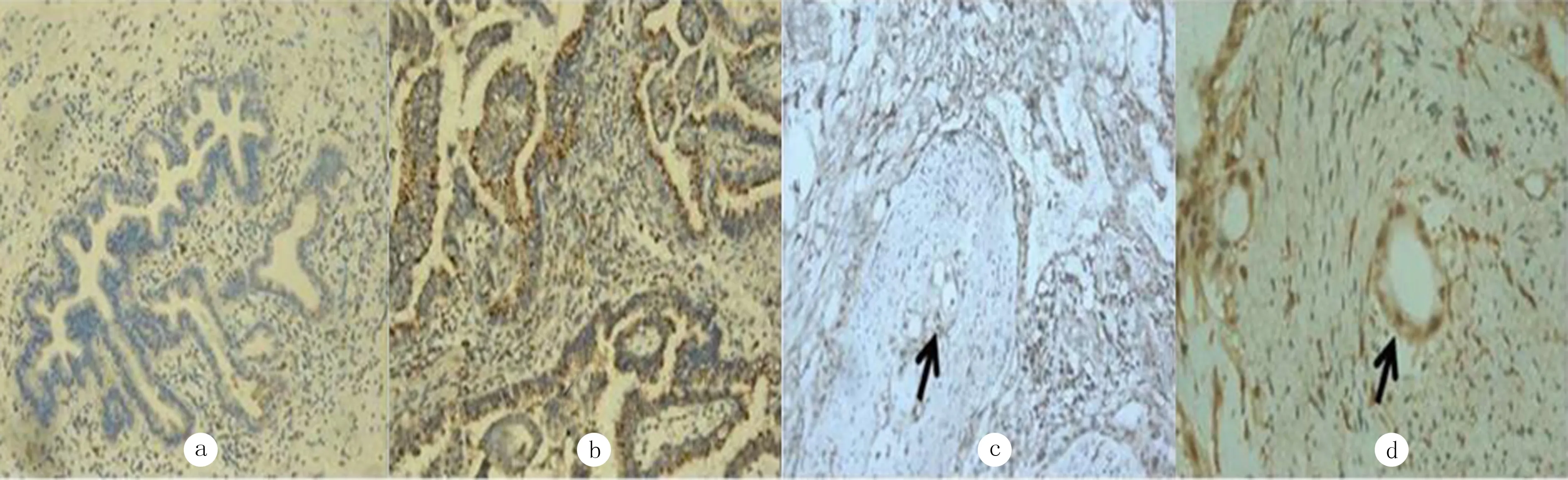
a:ChRM3在正常胆管组织中的表达,200倍;b:ChRM3在胆管癌组织中的表达,200倍;c、d:胆管癌浸润神经纤维(箭头所指),PV-6000染色,分别为200、400倍。
图1ChRM3在两种组织中的表达情况
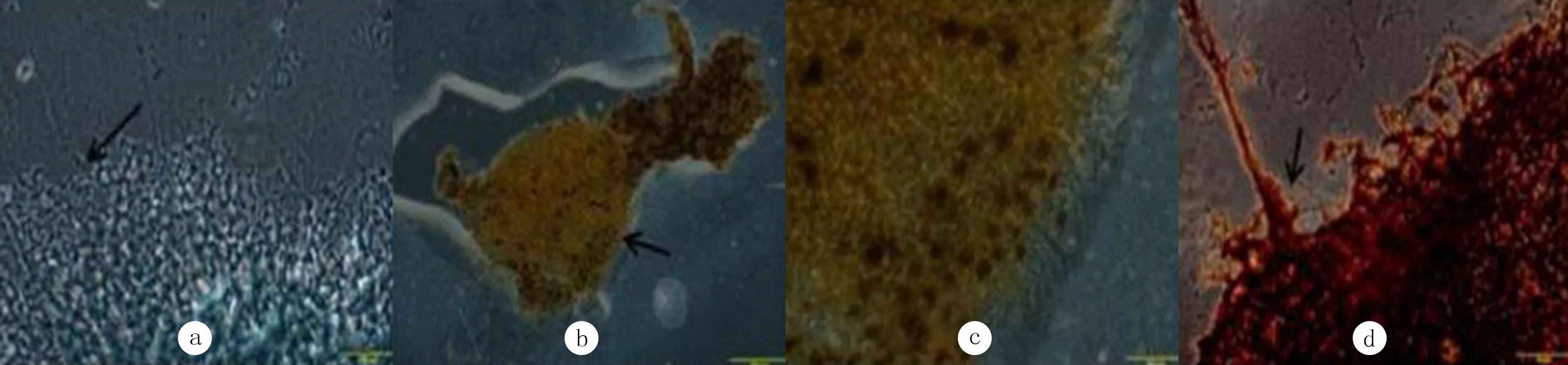
a:Nissl着色后的DRG(箭头所指),400倍;b、c:Gomori着色后的DRG(箭头所指),分别为200、400倍;d:NF IHC着色后的DRG(箭头所指),400倍。
图2DRG体外培养36h后的生长状态、胞体大小及轴突生长状况
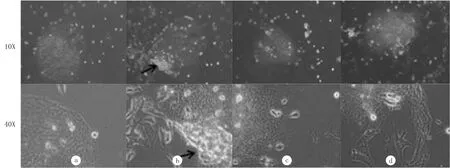
a:RBE细胞浸润DRG及其周围神经纤维情况;b:加入匹罗卡品后RBE细胞浸润DRG及其周围神经纤维情况;c:同时加入匹罗卡品和阿托品后RBE细胞浸润DRG及其周围神经纤维情况;d:单独加入阿托品后RBE细胞浸润DRG及其周围神经纤维情况。
图3不同因素影响下RBE细胞对DRG的浸润情况
神经浸润是胆管癌一种独立的转移方式,与淋巴转移无关[4]。BHUIYA等[5]的研究显示, 70例胆管癌标本中81.4%出现了神经浸润,且R0术后5年存活率仅为32%,而无神经浸润病人为67%。以上研究显示,神经浸润在胆管癌中普遍发生且与术后复发相关。胆管系统是一个由多种神经支配的自主神经器官。许多学者认为肿瘤的神经浸润可能与神经递质有关,尤其是胆管癌这种具有嗜神经浸润性的肿瘤[6]。研究显示胆管癌周围的交感神经递质及其受体在调节胆管癌的生长及转移中的重要作用已经被证实[7-8],但是副交感神经在胆管癌中作用的研究尚少。SHAH等[9]以及SAID等[10]研究表明,副交感神经也与肿瘤的发生发展关系密切。mAChRs是副交感神经分泌的主要递质乙酰胆碱(ACh)受体的一种,包括M1~M5 5种受体,其中,ChRM3分布于消化道腺体和血管平滑肌,控制腺体分泌和平滑肌松弛。实验证明,ACh在多种肿瘤中高表达,包括常见的肺癌及其他恶性肿瘤[11-12]。研究显示ChRM3在消化道肿瘤中广泛表达,在肿瘤的增殖、分化、侵袭和转移中起重要作用[13-14]。张亮等[15]研究显示,ChRM3活化能够通过PI3K/Akt信号通路促进肝癌细胞的侵袭和转移。据报道,胆管癌细胞系MZ-Cha-1有ChRM3的表达,而在mAChRs激动剂作用下,IP3信号被激活,细胞内Ca2+水平升高,胆管癌细胞的数量增加[16]。FENG等[17]研究显示,ChRM3的表达在胆管癌细胞增殖和转移中起关键作用,并受肿瘤分化程度、远处转移的影响。以上研究证明,ChRM3广泛参与了肿瘤细胞,包括胆管癌细胞的增殖、分化、侵袭和转移,但是与神经浸润有关的报道很少。本课题组之前的研究已经证实了胆管癌细胞可能存在ChRM3,并受副交感神经分泌的神经递质的调节,在胆管癌的侵袭和转移中发挥积极作用[18]。对本院90例标本进行免疫组织化学染色显示,ChRM3主要在胆管癌细胞膜和细胞质中表达,胆管癌组织中神经浸润的发生率约为91.7%,并且在胆管癌组织中ChRM3的阳性表达率明显高于正常胆管组织。据此推测,ChRM3可能与胆管癌神经浸润具有相关性。研究显示,肿瘤组织中存在多种神经递质的异常表达,神经递质和受体激动剂可影响肿瘤的增殖、分化和转移,受体拮抗剂可阻断这些作用[19]。而本研究结果显示,加入匹罗卡品或阿托品后,ChRM3激动剂匹罗卡品可明显增强RBE细胞对DRG及周围神经纤维的浸润能力;而阿托品可明显抵消匹罗卡品所产生的促浸润作用;阿托品能够与匹罗卡品竞争与ChRM3结合,对匹罗卡品的作用产生竞争性抑制,而阿托品本身与ChRM3结合不发挥作用,所以单独应用阿托品对RBE细胞的神经浸润无影响。
综上所述,匹罗卡品可明显增强胆管癌细胞的神经浸润能力,阿托品可明显抵消匹罗卡品所产生的促浸润能力,其机制可能通过改变ChRM3的活性而发挥作用。这可能为抑制胆管癌的神经浸润提供新的治疗靶点。
[参考文献]
[1] RAZUMILAVA N, GORES G J. Cholangiocarcinoma[J]. Lancet, 2014, 383(9935):2168-2179.
[2] FRIMAN S. Cholangiocarcinoma-current treatment options[J]. Scand J Surg, 2011, 100(1):30-34.
[3] 冯玉杰,张炳远,卢云. 胆管癌周围神经浸润的研究进展[J]. 国际外科学杂志, 2010,37(7):489-483.
[4] HASSAN M O, MAKSEM J. The prostatic perineural space and its relation to tumor spread: an ultrastructural study[J]. Am J Surg Pathol, 1980,4(2):143-148.
[5] BHUIYA M R, NIMURA Y, KAMIYA J, et al. Clinicopa-thologic studies on perineural invasion of bile duct carcinoma[J]. Ann Surg, 1992,215(4):344-349.
[6] 刘磊,黄强,刘臣海,等. 肝外胆管癌神经及脉管浸润转移的危险因素[J]. 肿瘤, 2012,32(5):376-379.
[7] KANNO N, LESAGE G, PHINIZY J L, et al. Stimulation of α 2-adrenergic receptor inhibits cholangiocarcinoma growth through modulation of Raf-1 and B-Raf activities[J]. Hepato-logy, 2002,35(6):1329-1340.
[8] 黄竹,刘子沛,夏锋,等. α1-肾上腺素受体对胆管癌细胞增殖的影响[J]. 中华消化外科杂志, 2009,8(3):193-196.
[9] SHAH N, KHURANA S, CHENG K, et al. Muscarinic receptors and ligands in cancer[J]. Am J Physiol Cell Physiol, 2009,296(2):C221-232.
[10] SAID A H, HU S, ABUTALEB A, et al. Interacting post-muscarinic receptor signaling pathways potentiate matrix me-talloproteinase-1 expression and invasion of human colon cancer cells[J]. Biochemical Journal, 2017,474(5):647-665.
[11] TROMBINO S, CESARIO A, MARGARITORA S, et al. α7-Nicotinic acetylcholine receptors affect growth regulation of human mesothelioma cells role of mitogen-activated protein kinase pathway[J]. Cancer Res, 2004,64(1):135-139.
[12] SONG P, SEKHON H S, PROSKOCIL B, et al. Synthesis of acetylcholine by lung cancer[J]. Life Sci, 2003,72(18):2159-2168.
[13] FRUCHT H, JENSEN R T, DEXTER D, et al. Human colon cancer cell proliferation mediated by the M3 muscarinic cholinergic receptor[J]. Clin Cancer Res, 1999,5(9):2532-2539.
[14] WEGENER C, HAMASAKA Y, NASSEL D R. Acetylcholine increases intracellular Ca2+ via nicotinic receptors in cultured PDF-containing clock neurons of Drosophila[J]. J Neurophysiol, 2004,91(2):912-922.
[15] 张亮,宦宏波,温旭东,等. 毒蕈碱型胆碱能受体M3调控肝癌细胞侵袭转移的研究[J]. 第三军医大学学报, 2017,39(6):509-514.
[16] ELSING C, HUBNER C, FITSCHER B A, et al. Muscarinic acetylcholine receptor stimulation of biliary epithelial cells and its effect on bile secretion in the isolated perfused liver[J]. Hepatology, 1997,25(4):804-814.
[17] FENG Y J, ZHANG B Y, YAO R Y, et al. Muscarinic acetylcholine receptor M3 in proliferation and perineural invasion of cholangiocarcinoma cells[J]. Hepatobiliary Pancreat Dis Int, 2012,11(4):418-423.
[18] 刘昆鹏,张炳远,卢云,等. Transwell侵袭实验测定M受体对胆管癌细胞侵袭的影响[J]. 国际外科学杂志, 2011,38(5):298-301.
[19] RADU A, PICHON C, CAMPARO P, et al. Expression of follicle-stimulating hormone receptor in tumor blood vessels[J]. N Engl J Med, 2010,186(2):1621-1630.

