TACE联合索拉非尼治疗中晚期肝细胞肝癌55例疗效分析
(青岛大学附属医院介入医学中心,山东 青岛 266003)
肝细胞肝癌(HCC)是我国最常见的实体恶性肿瘤之一,由于其发病隐匿,确诊时多已发展至中晚期,失去根治性手术切除机会。经导管动脉化疗栓塞术(TACE)作为不可手术切除HCC的首选治疗方案[1],临床疗效已获得广泛认可,但其远期疗效并不理想。索拉非尼作为一种口服多激酶的抑制剂,具有抑制肿瘤细胞增殖及阻断肿瘤血管生成的双重效果[2-3]。大量临床研究已初步证实TACE与索拉非尼联合应用可以获得极好的协调互补效果。本研究对55例中晚期HCC病人采用TACE联合索拉非尼治疗,观察分析其临床疗效,通过分层对比分析影响联合治疗临床因素。现将结果报告如下。
1 资料与方法
1.1 一般资料
2010年7月-2018年1月在我院接受TACE联合索拉非尼治疗的中晚期HCC病人55例,男54例,女1例;年龄39~81岁,平均58.8岁。其中B期28例,C期27例,合并有血管侵犯23例,合并有肝外转移13例(11例肺转移、2例骨转移),合并有慢性肝炎49例,22例为肝脏单发肿瘤,共计联合微波消融治疗14例、联合125I放射性粒子植入治疗7例。纳入标准:①依据2017版HCC规范化诊治专家共识,经影像学检查、或病理检查诊断为HCC;②无法接受根治性外科治疗;③肝功能Child-Pugh分级A或者B级;④至少有1个可测量病灶;⑤ECOG评分≤2分。排除标准:①服用索拉非尼时间<3个月;②预计生存期<3个月;③因无法耐受不良反应或其他原因停服索拉非尼超过1个月;④其他TACE治疗禁忌证。
1.2 治疗方法
TACE治疗:采用改良式Seldinger技术穿刺右侧股动脉建立通路,应用肝管行腹腔动脉、肝总动脉、肠系膜上动脉造影,明确病灶位置、供血动脉、血管瘘、瘤栓等,随后应用2.7F微导管超选择性插管至肿瘤靶动脉内,进行适量动脉化疗栓塞。化疗药物方案:吡柔比星30~50 mg,奥沙利铂100 mg,超液化碘油10~20 mL,必要时应用栓塞微球栓塞末梢小动脉。术后给予积极保肝、水化、利尿等对症治疗。术后3 d复查血常规、血凝常规、肝肾功能变化,术后1个月复查腹部CT或MR检查明确肝脏病灶活性变化。TACE治疗间隔时间根据影像学结果决定。索拉非尼治疗:首次TACE治疗后3周开始服用索拉非尼定义为同步治疗,2次及以上TACE治疗后开始口服索拉非尼定义为序贯治疗。本研究同步治疗病人21例,序贯治疗病人24例。服用剂量索拉非尼400 mg,每日2次,根据不良反应调整频率和剂量。TACE治疗期间停药3~5 d,副反应较重难以耐受者半量口服(每次400 mg,每日1次)或暂停服药,停药不超过1个月,副反应症状缓解后恢复全量或半量服药。索拉非尼服用至病变进展或病人死亡,累计服药时间不少于3个月。
1.3 随访
病人服用索拉非尼开始随访至死亡或至2018年1月31日,每4~6周记录病人肝肾功能、甲胎蛋白水平、以及腹部CT或MR检查,采用mRECIST标准评价肿瘤局部控制疗效。观察服用索拉非尼不良反应的发生情况,不良反应分级标准采用美国国立癌症研究所常见毒性反应分级标准3.0版,记录严重不良反应情况。总体生存时间(OS),定义为联合治疗至病人死亡或随访结束。疾病进展时间(TTP)定义为联合治疗至影像学明确疾病出现进展。分别对B期、C期病人进行分层分析。
1.4 统计学分析
采用SPSS 22.0软件进行统计分析,行Kaplan-Meier法对生存率及生存时间曲线进行分析,采用Log-Rank检验分析不同因素对TTP、OS的影响,以P<0.05为差异有统计学意义。
2 结 果
2.1 生存期及存活率
本组55例病人截至2018年1月死亡34例,存活病人21例,mOS为17.4个月,522 d(95%CI=391~700 d),1年累积生存率为69.09%,2年的累积生存率为36.36%。其中B期病人存活10例,B期mOS为25.4个月,763 d(95%CI=700~929 d),1年的累积生存率为96.42%,2年的累积生存率为53.57%。C期尚存活11例,C期mOS为10.2个月,305 d(95%CI=227~376 d),1年累积生存率为40.7%,2年累积生存率为18.5%。
2.2 mTTP统计
本组55例病人mTTP为9个月,270 d(95%CI=218~315 d),其中B期病人mTTP为10.5个月,315 d(95%CI=270~465 d),C期mTTP为7.4个月,223 d(95%CI=105~270 d)。Kaplan-Meier法分析治疗前有无血管侵犯病人的mOS、mTTP差异具有显著性(χ2=20.771、8.291,P<0.05)。图1、2。肝炎背景、病灶数目、肝外转移、序贯或同步联合治疗、有无其他治疗等因素的mTTP差异均无统计学意义(P>0.05)。针对多次TACE治疗无法达到完全栓塞的病灶(图3A、B),在联合索拉非尼的基础上,根据具体病情适当联合微波消融(图3C)、放射性粒子植入等其他介入治疗方法可有效提高肝脏肿瘤的局部控制率,部分病例可获得局部长期CR效果(图3D)。
2.3 不良反应
本研究病人服用索拉非尼后不良反应发生率为9.0%,主要为手足皮肤反应、腹泻、高血压,多为1~2级反应,对症治疗后症状多可耐受。发生4级反应并停药2例(3.6%),1例为顽固性腹泻停药后好转;1例为服药40 d出后现肝衰竭,立即停止服用索拉非尼,接受保肝、血浆置换等治疗后逐渐好转。
3 讨 论
原发性肝癌手术切除率较低,术后复发率高,大多数病人只能接受非手术治疗。近年来,TACE已成为不可切除肝恶性肿瘤的基础治疗方法,2017版卫计委肝癌诊疗规范将TACE列为作为不可手术切除HCC的首选治疗方案。TACE治疗可有效控制局部肿瘤生长、明显延长病人生存时间[4]。中晚期HCC往往需要多周期TACE治疗方能达到较好的局部控制效果[5]。但受到多种因素限制,TACE远期有效率较差,疾病进展率高,TACE耐受率逐渐升高[6]。分析原因包括:TACE术后VEGF过度表达;多次栓塞后动脉闭塞;侧支循环形成影响栓塞剂沉积;多次栓塞、反复损害肝功能,肝硬化程度加重,无法耐受手术;肝内病灶爆发性生长、弥漫性改变,难以达到完全栓塞等。其中TACE治疗后局部缺血、低氧促进了VEGF的活化,残存的肿瘤细胞VEGF高表达,刺激新的肿瘤血管的生成,是影响TACE远期效果的重要因素[7]。有研究证实应用抗血管生成治疗药物联合TACE治疗HCC可降低肿瘤血管密度、减小肿瘤体积、延长生存时间[8]。
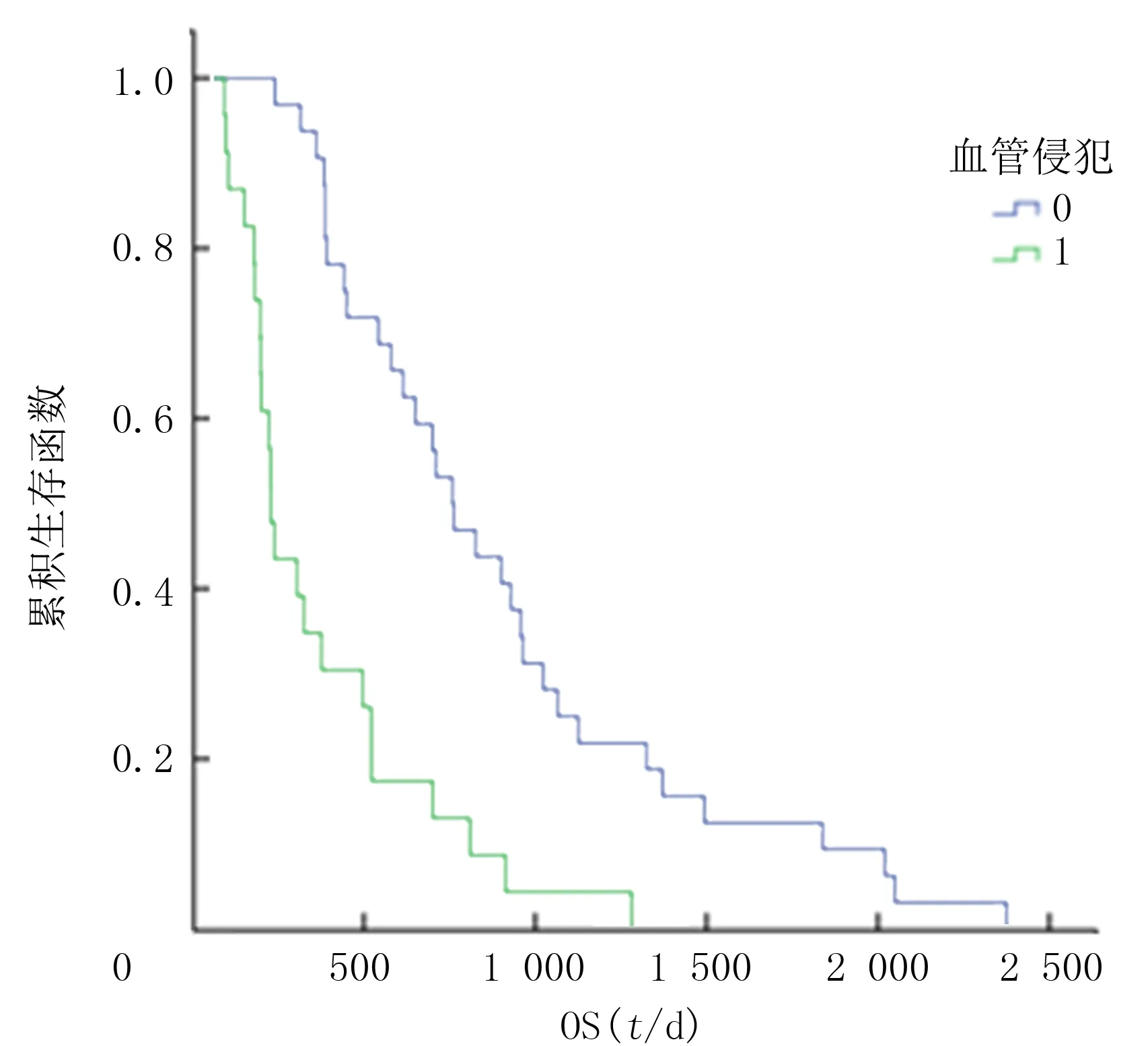
图1 Kaplan-Meier法绘制有无血管侵犯OS曲线
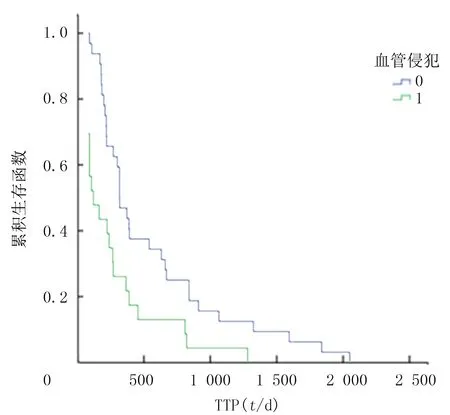
图2 Kaplan-Meier法绘制有无血管侵犯TTP曲线
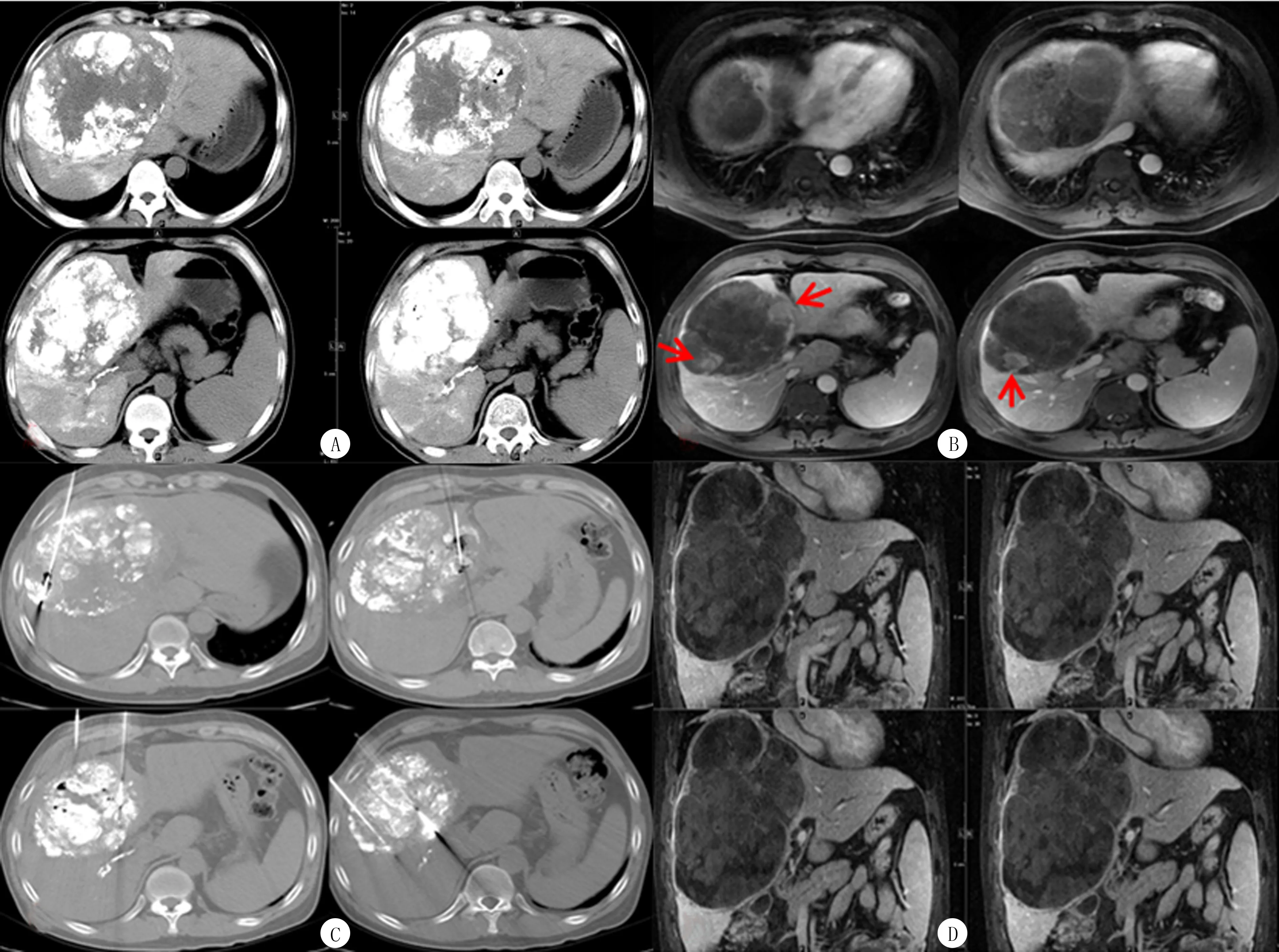
A:病人,男,39岁,临床及影像检查诊断为HCC,先后行4次TACE,首次TACE后1周开始联合口服索拉非尼,TACE术后肝内病灶大部分碘化油沉积良好,部分边缘区域碘化油沉积欠佳;B:肝脏增强MR检查示病灶周边强化结节,提示肿瘤周边仍有活性壁结节(箭头所示);C:后联合CT引导微波消融治疗,多针多角度穿刺,针对活性壁结节进行局部微波消融灭活;D:消融术后1月增强MR检查肝脏肿瘤完全灭活,局部获得CR疗效(持续12个月)。
图3双介入联合索拉菲尼治疗巨块型HCC
索拉非尼作为一种多激酶受体抑制剂,其作用机制主要体现在抑制肿瘤细胞增殖、阻断肿瘤血管生成两方面[9]。索拉非尼通过阻断Raf信号通路等,发挥抗肿瘤生长及抗血管生成作用,从而延缓肝脏肿瘤进展。多项国际性临床试验均表明索拉非尼可使死亡风险降低、延长晚期HCC病人mOS以及mTTP时间[1,10]。我国多项治疗指南和规范亦明确指出索拉非尼可以作为延长晚期HCC病人生存期的标准治疗方法。对于不可手术切除的中晚期肝癌病人,索拉非尼全身治疗联合TACE局部治疗成为近年来的研究热点。索拉非尼通过抑制VEGF水平[11],进而抑制HCC新生血管和微血管的生成,对TACE术后VEGF高表达发挥极高的抑制作用,二者从治疗机制上具有协同作用。国内外近期的初步研究证明,TACE联合索拉非尼治疗中晚期HCC病人,安全性好,可明显地延长病人的总体生存时间[12-15]。SPACE(索拉非尼同步联合TACE治疗中期HCC的随机双盲安慰剂对照研究)研究结果显示,联合治疗组mTTP为5.6个月(169 d),疾病进展风险降低20.3%[16]。SANSONNO等[17]研究表明,TACE联合索拉非尼mTTP为9.2个月,明显优于较单纯TACE的4.9个月,研究同时发现联合治疗可明显降低对于多结节病灶进展的发生。国内姚雪松等[18]应用TACE联合索拉非尼治疗不能手术切除HCC病人50例显示,mTTP为7个月(210 d)。孙向阳等[19]研究显示,TACE联合索拉非尼治疗不可手术切除的HCC mOS为12.5个月,mTTP为8个月。本研究所得结果中mOS及mTTP数据均高于同期国内外研究报道数据,分析原因与索拉非尼的早期同步联合治疗、其他介入治疗方法(微波消融、放射性粒子植入等)的联合应用密切相关。TACE联合微波消融、放射性粒子植入等其他介入治疗方法可有效提高肝脏肿瘤的局部控制率,本研究共有14例病人获得局部长期CR效果。但本组数据应用Kaplan-Meier法进行单因素分析,其他介入治疗、TACE与索拉非尼同步联合均未获得阳性差异结果,可能与样本量过小、大部分多介入联合治疗病人为近期就诊病人、总体病程时间尚短等原因有关,进一步长期随访分析后可能获得更明显的效果。
对于可能影响联合疗效的各种因素,国内外研究者已进行了多方位的探讨,性别、Child-Pugh分级、BCLC分期、病灶数目、有无肝外转移、有无血管侵犯、是否合并肝炎背景、是否抗病毒治疗、AFP值变化等诸多因素均可能影响治疗效果[12,18-20]。不同研究所得结果大相径庭,样本量大小、单(多)中心数据来源、单因素所占比例等因素均可影响研究结果。本组研究为单中心收集TACE联合索拉非尼治疗中晚期HCC 55例,分别对肝炎背景、病灶数目、肝外转移、序贯或同步联合治疗、有无血管侵犯、有无其他治疗等因素进行分析,发现有无血管侵犯为影响疗效的独立预测因素。
索拉非尼常见的不良反应是消化系统不良反应和皮肤型不良反应,有研究预测出现手足皮肤反应和腹泻,往往提示索拉非尼治疗有效。有研究报道索拉非尼治疗的不良反应的发生率为80%,由于不良反应导致的停药的比例高达38%,分析原因与其入组病人均为晚期的病人密切相关[3]。PAWLIK等[21]研究结果显示,索拉非尼联合药物洗脱微球动脉化疗栓塞治疗HCC最常见的不良反应为皮肤反应、乏力、厌食、肝功能异常等,且通过对症治疗后不良反应可逐渐控制。本组病人累计不良反应发生率为89%,多为1~2级反应,最多的是手足皮疹、腹泻、高血压、乏力等,给予对症药物治疗后可逐渐缓解或耐受。1例病人出现不可耐受的严重腹泻,药物减量后仍无法缓解,后停止服药;1例病人服药40 d后出现肝功能明显异常、皮肤黏膜黄染等肝衰竭表现,立即给予停药,入院接受积极保肝、退黄、血浆置换等治疗后逐渐好转,后停止服用索拉非尼。本组病人不良反应的发生率较高,但全组mOS及mTTP高于同期文献报道,具体不良反应与临床疗效的关系有待进一步研究论证。
综上所述,本研究进一步验证了索拉非尼联合TACE治疗中晚期HCC的安全性及有效性,通过研究证实,有无血管侵犯为影响联合疗效的独立因素。针对不同病人的具体病情,TACE治疗早期联合索拉非尼以及微波消融、放射性粒子等其他局部介入治疗可有效延长疾病OS及TTP。但本研究为单中心研究,研究样本数相对较少,对于影响疗效的因素尚有待进一步分层、对照研究。
[参考文献]
[1] EUROPEAN ASSOCIATION FOR THE STUDY OF THE L, EUROPEAN ORGANISTATION FOR R, TREATMENT OF C. EASL-EORTC clinical practice guidelines: Management of hepatocellular carcinoma[J]. J Hepatol, 2012,56(4):908-943.
[2] LLOVET J M, RICCI S, MAZZAFERRO V, et al. Sorafenib in advanced hepatocellular carcinoma[J]. N Engl J Med, 2008,359(4):378-390.
[3] CHENG A L, KANG Y K, CHEN Z, et al. Efficacy and safety of sorafenibin patients inthe Asia-Pacific region with advancedhepatocellular carcinoma: AphaseⅢrandomised, double-blind, placebo-controlled trial[J]. Lancet Oncol, 2009,10(1):25-34.
[4] VERSLYPE C, ROSMORDUC O, ROUGIER P, et al. Hepatocellular carcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2012,23(Suppl 7):41-48.
[5] PARK J W, AMARAPURKAR D, CHAO Y, et al. Consensus recommendations and review by an International Expert Panel on Interventions in Hepatocellular Carcinoma (EPOIHCC)[J]. Liver Int, 2013,33(3):327-337.
[6] GILLMORE R, STUART S, KIRKWOOD A, et al. EASL and mRECIST responses are independent prognostic factors for survival in hepatocellular cancer patients treated with transarterial embolization[J]. J Hepatol, 2011,55(6):1309-1316.
[7] SERGIO A, CRISTOFORI C, CARDIN R, et al. Transcatheter arterialchemoembolization (TACE) inhepatocellularcarcinoma(HCC): Therole of angiogenesis and invasiveness[J]. Am J Gastroenterol, 2008,103(4):914-921.
[8] JIANG H, MENG Q, TAN H, et al. Antiangiogenic therapy enhances the efficacy of transcatheter arterial embolization for hepatocellular carcinomas[J]. Int J Cancer, 2007,121(2):416-424.
[9] SALEM R, LEWANDOWSKI R J, MULCAHY M F, et al. Radioembolization for hepatocellularcarcinoma using Yttrium-90 microspheres: Acomprehensive report of long-term outcomes[J]. Gastroenterology, 2010,138(1):52-64.
[10] MAZZAFERRO V, SPOSITO C, BHOORI S, et al. Yttrium-90 radioembolization for intermediate advanced hepatocellular carcinoma: A phase 2 study[J]. Hepatology, 2013,57(5):1826-1837.
[11] ERHARDT A, KOLLIGS F, DOLLINGER M, et al. TACE plus sorafenib for the treatment of hepatocellular carcinoma: results of the multicenter, phase Ⅱ SOCRATES trial[J]. Cancer Chemother Pharmacol, 2014,74(5):947-954.
[12] 韩国宏,白苇,梁洁,等. TACE联合索拉非尼治疗中晚期肝细胞肝癌的初步观察[J]. 临床肿瘤学杂志, 2009,14(5):401-404.
[13] DUFOUR J F, HOPPE H, HEIMMH, et al. Continuous administrationof sorafenib in combinationwith transarterial chemoembolization in patientswith hepatocellular carcinoma:Results of a phase Istudy[J]. Oncologist, 2010,15(11):1198-1204.
[14] ZHAO Y, WANG W J, GUAN S, et al. Sorafenib combined with transarterial chemoembolization for the treatment of advanced hepatocellular carcinoma: A large-scale multicenter study of 222 patients[J]. Ann Oncol, 2013,24(7):1786-1792.
[15] PARK J W, KOH Y H, KIM H B, et al. Phase Ⅱ study of concurrent transarterial chemoembolization and sorafenib in patients with unresectable hepatocellular carcinoma[J]. J Hepatol, 2012,56(6):1336-1342.
[16] LENCIONI R, LLOVET J M, HAN G, et al. Sorafenib or placebo plus TACE with doxorubicineluting beads for intermediate stage HCC: The SPACE trial[J]. J Hepatol, 2016,64(5):1090-1098.
[17] SANSONNO D, LAULETTA G, RUSSI S, et al. Transarterial chemoembolizationplus sorafenib: A sequential therapeutic scheme for HCV-related intermediate-stage hepatocellular carcinoma: Arandomizedclinicaltrial[J]. Oncologist, 2012,17(3):359-366.
[18] 姚雪松,闫东,曾辉英,等. TACE联合索拉非尼治疗不能手术切除肝细胞肝癌50例[J]. 介入放射学杂志, 2013,22(5):381-386.
[19] 孙向阳,李彩霞,张凯,等. TACE联合索拉非尼治疗不可手术切除的肝癌[J]. 中国介入影像与治疗学, 2017,14(1):3-7.
[20] 周学士,任雷,彭蕾,等. 索拉非尼联合肝动脉化疗栓塞术治疗中晚期肝细胞癌疗效观察[J]. 实用肝脏病杂志, 2015,18(1):59-62.
[21] PAWLIK T M, REYES D K, COSGROVE D, et al. Phase Ⅱtrial of sorafenib combined with concurrent transarterial chemoembolization with drug-eluting beads for hepatocellular carcinoma[J]. J Clin Oncol, 2011M,29(30):3960-3967.

