Hedgehog通路对肺腺癌增殖、凋亡及间隙连接蛋白Cx32和Cx43表达的影响
(1 吉林大学中日联谊医院肿瘤血液科,吉林 长春 130033; 2 吉林大学第一医院发育行为儿科)
肺癌是我国发病率及死亡率居于第1位的恶性肿瘤,其中腺癌是最常见的病理类型[1]。虽然表皮生长因子受体(EGFR)抑制剂、免疫治疗等的应用,明显提高了肺腺癌病人的生存期,但其发生转移仍极为常见[2]。所以,研究肺腺癌细胞的转移机制对于研发新型药物至关重要。Hedgehog通路激活是肿瘤干细胞的重要特征,与肿瘤的增殖和转移密切相关[3]。本实验通过研究Hedgehog阻断剂环巴胺对肺腺癌细胞系A549的体外生长抑制效应,以及对细胞凋亡与间隙连接蛋白32(Cx32)、Cx43胞膜表达的影响,初步探索Hedgehog通路在肺腺癌增殖和转移中的作用机制。
1 材料与方法
1.1 细胞株和主要试剂
A549细胞购自中国医学科学院肿瘤医院细胞库。MEM细胞培养基和胎牛血清购自美国Gibco公司,环巴胺购买自美国Biomol公司,胰蛋白酶、MTS以及DMSO购买自美国Sigma公司,Anne-xiV-FITC/PI凋亡试剂盒购自凯基公司,FITC标记CX43及Cx32单克隆抗体购自上海信然公司。
1.2 细胞培养
将A549细胞置于含体积分数0.10的FBS、100 kU/L青霉素、100 kU/L链霉素MEM培养基于37 ℃、含体积分数0.05 CO2培养箱中培养。细胞融合度达80%~90%后,用含EDTA胰酶消化,1∶3传代培养,每3~4 d传代1次,细胞处于对数生长期后用于实验。
1.3 MTT法检测细胞生长抑制效应
取对数生长期的A549细胞,调整细胞密度为5×107/L,接种于96孔板中,每孔加100 μL细胞悬液(约5×103个细胞)。每组设3个复孔,置37 ℃、含体积分数0.05 CO2条件下培养。24 h后弃各孔内培养基,加入含不同浓度环巴胺培养基,浓度为0(阴性对照)、10、20、30和40 μmol/L。分别继续培养24、48和72 h后,每孔加入5 g/L的MTS溶液20 μL,37 ℃继续孵育4 h后,小心吸弃各孔内的培养上清液,加入0.5 g/L DMSO,每孔100 μL,在水平摇床上振荡10 min,使结晶物充分溶解。同时设无细胞DMSO组(空白对照组)。在酶联免疫检测仪上于492 nm波长处测定各孔的吸光度(A)值,取平行对照孔均值。将吸光度值代入公式计算细胞生长抑制率,比较不同浓度及时间细胞生长抑制率的变化,细胞生长抑制率=1-(实验组A值-空白对照组A值)/(阴性对照组A值-空白对照A值)×100%。
1.4 AnnexinV/PI双染流式细胞法检测细胞的凋亡率
取环巴胺对A549细胞48 h的半数的致死量40 μmol/L为作用浓度,Annexin V-FITC、PI双标记染色,采用流式细胞仪检测环巴胺对A549细胞作用48 h的凋亡效应,并计算细胞凋亡率,细胞凋亡率=凋亡细胞数/检测细胞总数×100%。
1.5 流式细胞术检测环巴胺对A549胞膜Cx32及Cx43表达的影响
细胞生长至对数期,以2 g/L胰酶消化至单细胞悬液,计数细胞后,按每孔2 mL(约5×105个细胞)将细胞接种于6孔板,培养24 h后弃去原培养基,加入含不同浓度环巴胺的培养基,浓度分别为0(阴性对照组)、40 μmol/L,各组设3个复孔。药物处理48 h后,刮除细胞并收集;以0.1 mol/L PBS洗涤细胞2次(1 000 r/min离心10 min);分别加入100 μL 1∶100 FITC-Cx32(或Cx43)稀释液;4 ℃、避光孵育1 h后加入0.1 mol/L PBS 300 μL,混匀,流式细胞仪检测胞膜Cx32及Cx43的表达。
2 结 果
2.1 环巴胺对A549细胞的生长抑制效应
与阴性对照组比较,当环巴胺浓度达10 μmol/L或以上时,细胞生长明显受到抑制。处理组A549细胞经10、20、30和40 μmol/L环巴胺作用24 h后,生长的抑制率分别为10.23%±1.25%、18.31%±2.11%、25.18%±2.92%、39.75%±4.24%;于48 h后分别为20.12%±2.45%、28.60%±2.61%、36.25%±3.16%、50.04%±4.89%;72 h后分别为32.51%±3.83%、45.34%±3.60%、65.76%±4.31%、74.52%±5.52%(P<0.05)。环巴胺对A549细胞生长抑制作用随浓度增加而增大,随作用时间延长而增加,表明环巴胺对A549细胞生长的抑制作用具有浓度、时间依赖性(图1)。
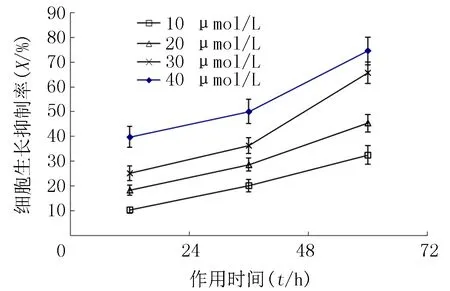
图110、20、30和40μmol/L环巴胺作用24、48和72h对A549细胞增殖的影响
2.2 环巴胺对A549细胞凋亡作用
经40 μmol/L环巴胺作用于A549细胞48 h后,细胞凋亡率为16.25%±1.52%,明显高于阴性对照组的10.23%±0.99%(P<0.05)。见图2。表明环巴胺抑制细胞生长可能是通过促进A549细胞发生凋亡所致。
2.3 流式细胞术检测环巴胺对A549细胞细胞膜Cx32及Cx43表达的影响
环巴胺可增加A549细胞Cx32及Cx43的胞膜表达。以40 μmol/L环巴胺作用A549细胞48 h后,胞膜Cx32阳性表达率(69.65%±3.56%)明显高于阴性对照组(41.58%±2.61%)(P<0.05);胞膜Cx43阳性表达率(22.12%±1.69%)明显高于阴性对照组(9.96%±1.48%)(P<0.05)。
3 讨 论
Hedgehog通路是胚胎发育过程中的一个重要调节因子,并在脊椎动物中高度保守[4]。该通路在无配体时,跨膜信号受体Ptch抑制SMO的活性,导致磷酸化的GLI的蛋白酶体降解,无法发挥相应作用;但存在Hh配体时,其通过结合Ptch受体,促使GLI从SMO复合体释放并转移至细胞核内,激活Hedgehog通路下游相关基因的转录。
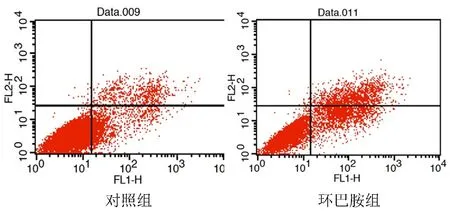
图2 40 μmol/L环巴胺对A549细胞凋亡的影响
近期研究表明,Hedgehog通路与肺腺癌密切相关。Hedgehog过表达可促进肺腺癌的增殖和转移[4-5]。Hedgehog通路激活亦与肺腺癌常规治疗药物如顺铂[6-7]以及EGFR抑制剂[6,8]等耐药有关。研究发现,siRNA阻断Hedgehog通路可逆转肺腺癌上皮-间质转化(EMT),并使肺腺癌再次对顺铂及厄洛替尼敏感[6];SMO抑制剂SANT-1亦可以提高肺腺癌对EGFR抑制剂的敏感性[9]。而且,Hedgehog通路是肺腺癌的一项独立不良预后因素,肺腺癌肿瘤组织Shh及GLI免疫组化阳性提示总生存时间缩短[10]。本研究以环巴胺阻断肺腺癌细胞系A549,发现环巴胺可抑制A549细胞增殖、促进凋亡,证实Hedgehog通路可影响A549细胞增殖,其机制可能与抑制细胞凋亡有关。Cx是细胞缝隙连接的基本组成单位,Cx可通过缝隙连接介导的细胞间通讯,维持组织中细胞群的代谢和生长的均衡性以及协调性。而肿瘤组织中Cx胞膜表达往往减少,影响肿瘤的生物学行为。多项研究证实,Cx与肺腺癌细胞的侵袭与转移密切相关。Cx43在Ⅲ~Ⅳ期、淋巴结转移、分化差的非小细胞肺癌中表达减低[11-12]。体外实验发现,Cx43可抑制肺癌的增殖及转移[12],并可通过防止EMT,逆转A549细胞对顺铂的耐药性[13]。Cx43表达水平与肺腺癌OS及PFS有关,Cx43低表达者的OS及PFS均劣于高表达者。
以往研究证实,Cx与Hedgehog通路之间存在关联,二者在胚胎发育过程中具有协同作用。为进一步探索Hedgehog通路在肺腺癌细胞的作用机制,本研究应用流式细胞术检测了阻断前后A549细胞胞膜Cx32、Cx43的变化。研究结果显示,阻断Hedgehog通路可增加Cx43及Cx32胞膜表达,表明Hedgehog通路可抑制肺腺癌细胞Cx43及Cx32的胞膜表达,减弱细胞间的制约作用。Hedgehog过表达促进肺腺癌转移可能与此有关。
综上所述,Hedgehog通路可能参与抑制肺腺癌细胞凋亡,并调节Cx43及Cx32的胞膜表达。
[参考文献]
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] CHALELA R, CURULL V, ENRIQUEZ C, et al. Lung adenocarcinoma: from molecular basis to genome-guided therapy and immunotherapy[J]. J Thorac Dis, 2017,9(7):2142-2158.
[3] KRISHNAMURTHY N, KURZROCK R. Targeting the Wnt/beta-catenin pathway in cancer: Update on effectors and inhibitors[J]. Cancer Treat Rev, 2017,62(1):50-60.
[4] PAN J, QIN Y, ZHANG M. HPIP promotes non-small cell lung cancer cell proliferation, migration and invasion through regulation of the Sonic hedgehog signaling pathway[J]. Biomed Pharmacother, 2016,77(4):176-181.
[5] LIN E H, KAO Y R, LIN C A, et al. Hedgehog pathway maintains cell survival under stress conditions, and drives drug resistance in lung adenocarcinoma[J]. Oncotarget, 2016,7(17):24179-93.
[6] AHMAD A, MAITAH M Y, GINNEBAUGH K R, et al. Inhibition of Hedgehog signalingsensitizes NSCLC cells to stan-dard therapies through modulation of EMT-regulating miRNAs[J]. J Hematol Oncol, 2013,6(1):77.
[7] GIROUX LEPRIEUR E, VIEIRA T, ANTOINE M, et al. Sonic hedgehog pathway activation is associated with resistance to platinum-based chemotherapy in advanced non-small-cell lung carcinoma[J]. Clin Lung Cancer, 2016,17(4):301-308.
[8] DELLA CORTE C M, BELLEVICINE C, VICIDOMINI G, et al. SMO Gene Amplification and Activation of the Hedgehog Pathway as Novel Mechanisms of Resistance to Anti-Epidermal Growth Factor Receptor Drugs in Human Lung Cancer[J]. Clin Cancer Res, 2015,21(20):4686-4697.
[9] BAI X Y, ZHANG X C, YANG S Q, et al. Blockade of hedgehog signaling synergistically increases sensitivity to epidermal growth factor receptor tyrosine kinase inhibitors in non-small-cell lung cancer cell lines[J]. PLoS One, 2016,11(3):e0149370.
[10] HWANG J, KANG M H, YOO Y A, et al. The effects of sonic hedgehog signaling pathway components on non-small-cell lung cancer progression and clinical outcome[J]. World J Surg Oncol, 2014,12(1):268.
[11] ZHAO J Q, SUN F J, LIU S S, et al. Expression of connexin 43 and E-cadherin protein and mRNA in non-small cell lung cancers in Chinese patients[J]. Asian Pac J cancer Prev, 2013,14(2):639-643.
[12] XU H T, LI Q C, ZHANG Y X, et al. Connexin 43 recruits E-cadherin expression and inhibits the malignant behaviour of lung cancer cells[J]. Folia Histochem Cytobiol, 2008,46(3):315-321.
[13] YU M, ZHANG C, LI L, et al. Cx43 reverses the resistanee of A549 lung adenocarcinoma cells to cisplatin by inhibiting EMT[J]. Oncol Rep, 2014,31(6):2751-2758.

