C臂CT引导下射频消融术在原发性肝癌治疗中的安全性及有效性分析
(北京大学第一医院介入血管外科,北京 100034)
原发性肝癌是世界上最常见的恶性肿瘤之一,也是我国第三大的肿瘤性致死病因[1-3]。目前手术切除及肝移植是原发性肝癌首选治疗方式,然而有80%以上的病人在确诊时已失去手术切除的机会,且术后5年复发率约40%~70%[4-6]。对于不可手术切除及术后复发的原发性肝癌,可以通过经肝动脉化疗栓塞以及物理消融等各种介入方法治疗,并已经在临床上得到了广泛的应用[7]。射频消融术(RFA)作为一种治愈性的微创治疗方法,在肿瘤介入领域中已经得到广泛开展。目前已有大量临床研究和指南指出,在直径<3 cm的小肝癌病人中,RFA后病人的总生存率和无复发生存率方面与外科手术切除没有显著性差异。而对于直径≤2 cm的肝癌病人,接受RFA治疗后的1、3和5年总生存率和无复发生存率甚至显著优于外科手术切除的病人[8-10]。作为影像引导治疗(IGT)的典型代表,目前RFA最常应用的影像引导方式主要为螺旋CT和超声。然而即使将上述两种影像引导方式联合使用,在实际操作过程中仍然存在一些难以避免的限制和缺陷,这也在一定程度上减弱了RFA的治疗效果。C臂CT作为一种比较新颖的成像设备,通常整合在血管造影机上。与传统螺旋CT引导相比较,在C臂CT引导下行RFA治疗具有独特的技术优势。通过C臂的旋转,术者能够实时获得病人的立体透视图像;与此同时,C臂CT还能够将采集到的透视图像进行后处理,从而得到病人的断层图像。近年来,C臂CT引导下的RFA得到越来越多的重视与应用,本中心亦从2016年起逐渐在C臂CT引导下开展RFA治疗。本文旨在通过回顾性分析本中心C臂CT引导下采用RFA治疗病人的临床资料与随访数据,并与同期传统螺旋CT引导下行RFA治疗病人的数据相比较,借此评价这一新型影像引导技术在治疗原发性肝癌中的安全性及有效性。
1 对象与方法
1.1 研究对象
2016年9月-2017年10月,收集我中心行C臂CT引导下RFA治疗的原发性肝癌病人21例(C-CT组),同一时期在螺旋CT引导下行RFA治疗原发性肝癌病人26例(S-CT组)。C-CT组男16例,女5例;年龄29~76岁,平均(55.7±11.8)岁;肿瘤大小(3.4±1.9)cm;Child-Pugh分级A、B级分别为20、1例;BCLC分期A、B期分别为9、12例;ECOG评分0、1分分别为16、5例;血管侵犯是、否分别为0、21例;肝外转移是、否分别为4、17例。S-CT组男20例,女6例;年龄41~86岁,平均(65.2±10.4)岁;肿瘤大小(2.7±1.2)cm;Child-Pugh分级A、B级分别为24、2例;BCLC分期A、B期分别为11、15例;ECOG评分0、1分分别为18、8例;血管侵犯是、否分别为0、26例;肝外转移是、否分别为1、25例。除C-CT组病人年龄略小外,两组一般资料比较,差异无显著性,具有可比性。原发性肝癌均通过经皮穿刺活检确诊或符合国家卫计委2017年版原发性肝癌诊疗规范中的诊断标准[11]。全部47枚病灶的RFA治疗均由同一团队使用统一血管造影机(Innova 4100-IQ,GE Medical Systems,法国)和射频消融设备(1500X射频发生器及StarBurst射频针,RITA公司,美国)完成。在临床资料及随访数据方面,所有病人在术前均完善影像学及相关实验室检查,且均按时完成术后1、3、6个月的增强CT或者MR检查随访。本研究获得我院伦理审查委员会批准,所有病人均在手术前签署了知情同意书。
1.2 射频消融技术
全部47例病人均于RFA前行经肝动脉化疗栓塞术(TACE)治疗,力求使碘油良好沉积于靶病灶内部。根据病人具体情况、碘油沉积状态及TACE术后病人反应等决定RFA时机,所有病人TACE术与RFA之间的间隔时间为5~28 d。
螺旋CT引导操作方式按传统规程进行。经C臂CT引导方式的具体操作如下。拟行RFA术前,病人取仰卧位平躺于血管造影机检查床上,连接心电监护、鼻导管及相关支持设备。首先在数字减影血管造影(DSA)透视下确定病人呼吸过程中的膈肌移动度,并反复训练病人屏气,最终确定屏气状态下的膈肌位置并在体表妥善标记,以此作为RFA治疗整个过程中病人的呼吸基线(图1)。在RFA全程中,需注意病人每次屏气后的膈肌位置均应与上述体表标记重合,借此监视病人呼吸配合程度,保证穿刺路径准确。将不透线格栅固定于肝区作为定位标志,后嘱病人屏气行C臂CT旋转扫描,通过重建图像可清晰显示碘油沉积灶及周围情况。以不透线格栅为基准,经过轴位、冠状位及矢状位图像准确定位体表进针点、进针角度及距离,最终确定穿刺路径。穿刺点局部充分浸润麻醉,后嘱病人屏气,此时务必在透视下确保病人膈肌位置与体表标记重合;在半圆仪及DSA透视的多维度引导下进针,根据病人呼吸变化实时调整进针路径。消融过程中,子针的展开及母针的调整同样需要在DSA透视下进行,并在每次调整后行C臂CT扫描明确射频针的位置(图2)。尤其对于一些膈顶部、心包旁或其他高危部位的病灶,相较于传统螺旋CT的引导方式,在透视及C臂CT引导下调整母针角度及深度、监视子针的展开更为准确、直观,尽可能地避免了穿刺相关并发症的发生(图3)。术后行三维扫描并重建图像,观察病灶消融情况及并发症。术后常规行保肝、镇痛、抗感染、营养支持及导泻治疗。初次RFA术后复查期间,如发现残存或新发病灶,则根据病人及病灶具体情况行补充RFA或TACE治疗。
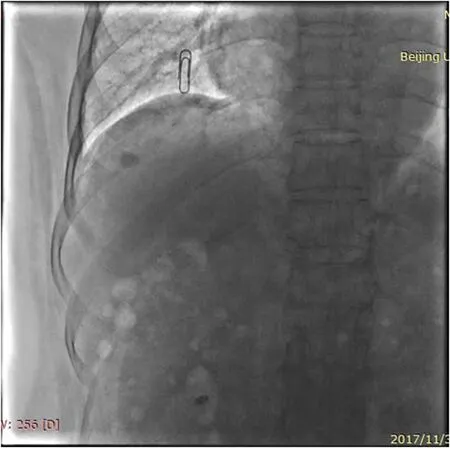
图1 经C臂CT引导RFA过程中病人呼吸基线的标记
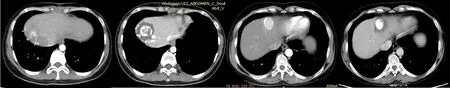
图3对于毗邻膈面、大血管或胆囊旁、其他重要脏器旁的“高危位置”病灶,C臂CT引导行射频消融术能够在透视下实时监控病人呼吸变化,同时进针路径选择也更加灵活
1.3 随访及疗效评价
围术期的观察指标包括:①记录术中及术后有无并发症发生,如气胸、出血以及肠道、胆管或胆囊损伤或其他射频消融相关并发症。②记录病人总手术时间、消融时间、接受射线剂量、术后住院时间。
全部47例病人RFA治疗后第1、3、6个月常规行增强CT或MR检查,根据mRECIST标准(2010版)对肝内消融灶进行疗效评价,其中包括:目标病灶内动脉期强化均消失为完全缓解(CR);目标病灶(动脉期增强显影)的总和缩小≥30%为部分缓解(PR);目标病灶(动脉期增强显影)增大≥20%或出现新病灶为疾病进展(PD);缩小未达PR或者增加未达PD为病情稳定(SD)。客观缓解率(ORR)=(CR+PR)率;疾病控制率(DCR)=(CR+PR+SD)率。本研究随访期限为6个月,以病人死亡或至6个月末终止随访。
2 结 果
全部47例病人手术均获得成功,两组技术成功率均为100%。C-CT组总手术时间为(90.5±33.8)min,消融时间为(29.3±18.2)min,接受射线剂量为(243.6±192.6)mGy;S-CT组总手术时间为(65.8±15.1)min,消融时间为(20.5±11.6)min,接受射线剂量为(2 317±1 292)mGy。两组总手术时间、消融时间、接受射线剂量方面比较,差异有显著性(t=-3.342~7.284,P<0.05)。S-CT组在术中出现1例气胸,余两组病人在术后7 d的观察期内均无严重并发症发生(P>0.05)。C-CT组病人术后住院时间为(4.0±1.0)d,S-CT组为(3.7±0.9)d,两组比较无统计学差异(t=-977,P>0.05)。C-CT组病人随访1、3及6个月的ORR分别为100%、100%、90.5%,DCR分别为100%、90.5%、90.5%;S-CT组ORR分别为100%、96.2%、88.5%,DCR分别为100%、100%、80.7%,上述数据两组间比较均无统计学差异(P>0.05)。S-CT组中,有7例病人消融病灶在随访过程中出现残存或者复发,而C-CT组中仅为3例病人,两组数据比较存在一定的差异。
3 讨 论
C臂CT是集DSA和CT影像技术于一体,可获得三维血管成像、三维立体旋转图像及CT重建图像的新技术。目前,C臂CT功能已经成为血管造影机必备的功能之一。
在经动脉灌注化疗术的过程中,有时会遇到肿瘤供血动脉迂曲紊乱,分支或起源复杂的情况。此时通过3D旋转能够迅速找到最适合超选的投照角度,从而大大减少手术时间及射线剂量。此外,在栓塞术后即刻,根据C臂CT重建的图像能够准确判断栓塞材料尤其是碘油在病灶内部的栓塞效果,如发现病灶局部碘油缺失,则指示未将全部肿瘤供血动脉妥善栓塞,借此也能够在一定程度上保证化疗栓塞术的疗效。
除在TACE术中的辅助作用外,C臂CT作为一种新型影像引导方式,对以经皮消融术为代表的穿刺操作具有更重要的应用价值。通过C臂CT旋转图像重建,能够获得近似CT质量的图像,从而能够全面准确地评价肿瘤的大小、位置、形态,尤其利于对碘油沉积病灶的观察。在实施射频消融时,可在透视下实时监控射频针的进针途径,并可根据肿瘤形态调整射频针位置对病灶多次实施射频消融,更有利于对病灶进行充分消融,形成安全边界,从而有效减少肿瘤复发。
在本研究中,C-CT组同S-CT组在技术成功率、术后并发症发生率及住院时间方面均无显著性差异。可见C臂CT引导在安全性方面与传统螺旋CT相近,是一种值得进一步尝试及推广的新型影像引导方式。
在总手术时间及消融时间方面,C-CT组均显著长于S-CT组,根据笔者经验,在直视下实时调整射频针角度及子针开度会显著提高操作信心,从而在射频过程中尽可能从各个角度覆盖靶病灶。也正是因为调针次数多、消融范围大,才使C-CT组的手术时间明显增加。同时本研究结果提示,C-CT组病人接受射线剂量显著低于S-CT组,这也反映出在透视下实时调整进针角度、深度并监控开针过程能够在保证准确性的基础上简化操作过程。
对于毗邻膈面、大血管或胆囊旁、其他重要脏器旁的“高危位置”病灶,或者呼吸配合不佳的病人,进针与布针过程的全程可视化就显得尤为重要。传统螺旋CT引导下的射频消融由于穿刺定位时缺乏对射频针位置的实时监控,极易损伤病灶周围的脏器,引发出血、消化道穿孔或气胸等严重并发症。在本研究S-CT组中,有1例病人因呼吸不配合,同时肿瘤邻近膈顶,导致穿刺进针时引发气胸;而C-CT组在透视下实时监控射频针位置,仅需要病人短暂的呼吸配合即可及时调整进针路径,从而既能保证穿刺灵活准确,又尽可能地避免了穿刺相关并发症的发生。
在随访期限内,两种引导方式消融病灶的ORR及DCR虽未见统计学差异,但仔细分析其中数据不难看出,随时间推移,S-CT组中不断有局部控制良好(即疗效评价CR)的病灶周围出现局部复发或新发病灶,而C-CT组则没有上述现象。纵观整个随访期,S-CT组中有7例消融病灶在随访过程中出现残存或复发,比例为26.9%;而C-CT组中这一比例仅为14.3%,这也在一定程度上说明了C臂CT引导下RFA对病灶的消融更加充分,对病灶的控制更加彻底,疗效更加稳定。针对随访期间两组中评效不为CR的病人,治疗情况如下:在C-CT组中,术后1个月随访时有2例病人肝内已出现多个新发病灶,因此并未对消融病灶进行补充消融,仅行TACE术对肝内病灶进行控制,但疗效不佳,肝内病灶持续进展。在S-CT组中,术后1个月随访时有1例病人的消融病灶评效PR,因残存病灶较小且病人肝功能情况不佳选择随访,至3个月时评效为PR。术后3个月时,除上述1枚PR病灶外,又有3枚病灶出现复发。其中评效为SD的病灶肝内出现大量新发病灶,已失去进一步治疗机会;另3枚PR病灶中有2枚进行补充消融,1枚行补充TACE治疗,但6个月评效时均未达到CR标准。
本研究的局限性在于,作为一种相对较新的影像引导方式,本中心开展C臂CT引导下射频消融术不足两年时间,因此本研究样本量相对较小。目前病人资料仍在不断收集中,更大样本量的回顾性研究结果或前瞻性研究将会在今后陆续发表。
C臂CT作为一项新型的影像引导技术,无论在经动脉腔内治疗抑或射频消融等经皮穿刺术中,均能够起到重要作用。本研究初步表明,与传统螺旋CT引导方式相比,C臂CT引导下行RFA治疗原发性肝癌具有相似的安全性及有效性;并且病人接受射线剂量方面,采用C臂CT引导优于传统螺旋CT。综上,C臂CT引导下行RFA治疗原发性肝癌安全、有效,这种新型影像引导方式有力地推动了影像引导治疗的发展,值得进一步研究与应用。
[参考文献]
[1] FERLAY J, SHIN H R, BRAY F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010,127(12):2893-2917.
[2] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[3] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[4] ROAYAIE S, OBEIDAT K, SPOSITO C, et al. Resection of hepatocellular cancer ≤2 cm: results from two Western centers[J]. Hepatology, 2013,57(4):1426-1435.
[5] KANG W H, KIM K H, JUNG D H, et al. Long-term results of laparoscopic liver resection for the primary treatment of hepatocellular carcinoma: role of the surgeon in anatomical resection[J]. Surg Endosc, 2018.
[6] FINN R S. Current and future treatment trategies for patients with advanced hepatocellular carcinoma: role of mTOR inhibsition[J]. Liver Cancer, 2012,1(3-4):247-256.
[7] SHRIMAL A, PRASANTH M, KULKARNI A V. Interventional radiological treatment of hepatocellular carcinoma: an update[J]. Indian J Surg, 2012,74(1):91-99.
[8] European association for the study of the liver. EASL clinical practice guidelines: management of hepatocellular carcinoma[J]. J Hepatol, 2018.
[9] KUTLU O C, CHAN J A, ALOIA T A, et al. Comparative effectiveness of first-line radiofrequency ablation versus surgical resection and transplantation for patients with early hepatocellular carcinoma[J]. Cancer, 2017,123(10):1817-1827.
[10] PENG Z W, LIN X J, ZHANG Y J, et al. Radiofrequency ablation versus hepatic resection for the treatment of hepatocellular carcinomas 2 cm or smaller: a retrospective comparative study[J]. Radiology, 2012,262(3):1022-1033.
[11] 中华人民共和国卫生和计划生育委员会医政医管局. 原发性肝癌诊疗规范(2017年版)[J]. 临床肝胆病杂志, 2017,33(8):1419-1431.

