维生素B2和维生素B6补充对大鼠高尿酸血症的影响
葛 冰,蔡 静,钟 凤,马爱国
(青岛大学公共卫生学院/青岛大学营养与健康研究院,山东青岛 266021)
研究表明,高尿酸血症与某些肾脏疾病[1-3]、心血管疾病[4]的发生发展亦存在联系。维生素B2在体内是以黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD)的形式与特定的蛋白形成黄素蛋白,而黄素蛋白又是机体许多酶系统的重要组成成分,参与机体许多重要的代谢反应。体内的维生素B6是以5’—磷酸吡哆醛(PLP)的形式参与多种代谢反应,与氨基酸代谢有密切关系[5]。B族维生素可以通过降低黄嘌呤氧化酶产生氧自由基及过氧化物的能力,抑制黄嘌呤氧化酶的活性,从而减少尿酸的生成[6-7];此外,维生素B2和维生素B6也可通过抑制同型半胱氨酸的水平从而达到降低尿酸的作用[6],但其降低尿酸效果及机制仍待深入研究。因此,本实验采用维生素B2、B6及B2和B6联合干预,观察维生素B2、维生素B6对大鼠高尿酸血症的影响,并初步探讨其可能的机制。
1 材料与方法
1.1 主要试剂和仪器
试剂:氧嗪酸钾,上海麦克林生化科技有限公司;酵母膏,北京奥博星生物技术有限责任公司;别嘌呤醇,世贸天阶制药有限公司;维生素B2片、维生素B6片,东北制药集团沈阳第一制药有限公司;黄嘌呤氧化酶(XOD)测试盒、腺苷脱氨酶(ADA)测试盒,南京建成生物工程研究所。
仪器设备:离心机、722分光光度计、全自动生化分析仪等。
1.2 实验动物分组及处理
采用随机数字表法将72只6w龄体质量为200±20g的雄性SD大鼠(购自山东省鲁抗制药有限公司,合格证为SCXK鲁20140007)按体重分为6组,分别为空白对照组(C组)、氧嗪酸钾模型组(HU组)、阳性对照 (AL)组、维生素B2(B2)组、维生素B6(B6)组、维生素B2+B6(BB)组,每组各12只。每6只大鼠同笼饲养,维持室温在25℃左右。C组大鼠给予普通颗粒饲料喂养,饲料主要成分包括蛋白质(20%以上)、脂肪(4%)、粗纤维(5%)、灰分(8%)、水分(10%)等。其余各组给予质量分数20%酵母饲料喂养(将大鼠普通粉状饲料中均匀加入酵母膏,最后将饲料重新制作成团状)。除空白对照组外,其余各组大鼠给予1g/(kg·d·BW)氧嗪酸钾灌胃;在此基础上,AL组大鼠给予别嘌呤醇20mg/(kg·d·BW),B2组大鼠给予1.18mg/(kg·d·BW)VitB2灌胃、B6组大鼠给予23.73mg/(kg·d·BW)VitB6灌胃、BB组大鼠给予1.18mg/(kg·d·BW)VitB2+23.73mg/(kg·d·BW)VitB6灌胃;灌胃体积均为5 mL/(kg·d·BW),所有大鼠均自由饮水(自来水)和进食。
1.3 实验方法
1.3.1 血清尿酸(SUA)、尿素(Urea)、肌酐(SCr)等指标的测定 在干预的第0、4、12周,早晨8点,大鼠禁食12h后剪尾取血1.0~1.5mL。放置于室温中,静置凝血30min以上,在4℃条件下离心,以3 000r/min的转速离心10min,再取300μL血清,使用全自动生化分析仪测定SUA水平。干预16w末,大鼠禁食12 h后,腹腔注射戊巴比妥钠麻醉处死,留取血清,检测SUA、Urea和SCr水平。
1.3.2 肝匀浆中黄嘌呤氧化酶、腺苷脱氨酶的检测 干预16w末,大鼠禁食12 h,腹腔注射戊巴比妥钠麻醉处死,摘取各组大鼠新鲜肝脏组织制成10%肝匀浆。取100 μL 10%肝匀浆测定XOD活性,取50 μL肝均浆,测定ADA活性,具体操作方法严格按照试剂盒说明书进行。
1.3.3 大鼠病理切片的制备 大鼠处死后,取出右侧肾脏,纵向剖开放于固定液(10%中性福尔马林)中固定>24 h以上用石蜡包埋。常规脱蜡后,制成3 μm厚切片,HE染色,光镜下观察细胞形态。
1.4 统计学处理

根据2×2析因设计方差分析设计实验,纳入分析的数据为HU组、B2组、B6组以及BB组的SUA、XOD及ADA等数据。对于交互作用,检验结果P<0.05,表明VitB2和VitB6之间存在交互作用。
2 结果与分析
2.1 各组大鼠SUA水平
如图1所示,干预4w后,各组大鼠SUA水平均呈明显上升趋势,但无显著差异。干预到第12w末,HU组大鼠SUA水平达到303.00 μmol/L,明显高于其他各组(P<0.05);而其余各组大鼠SUA水平与C组相比,差异并不明显。干预16w末,HU组、B2组、B6组、BB组大鼠SUA水平分别达到了369.58、281.58、290.70、294.42 μmol/L,与C组相比显著升高(P值均<0.05)。而与HU组相比,AL组、B2组、B6组、BB组大鼠血尿酸水平明显降低(P值均<0.05)。说明维生素B2和维生素B6对高尿酸血症大鼠SUA水平有明显的改善作用。
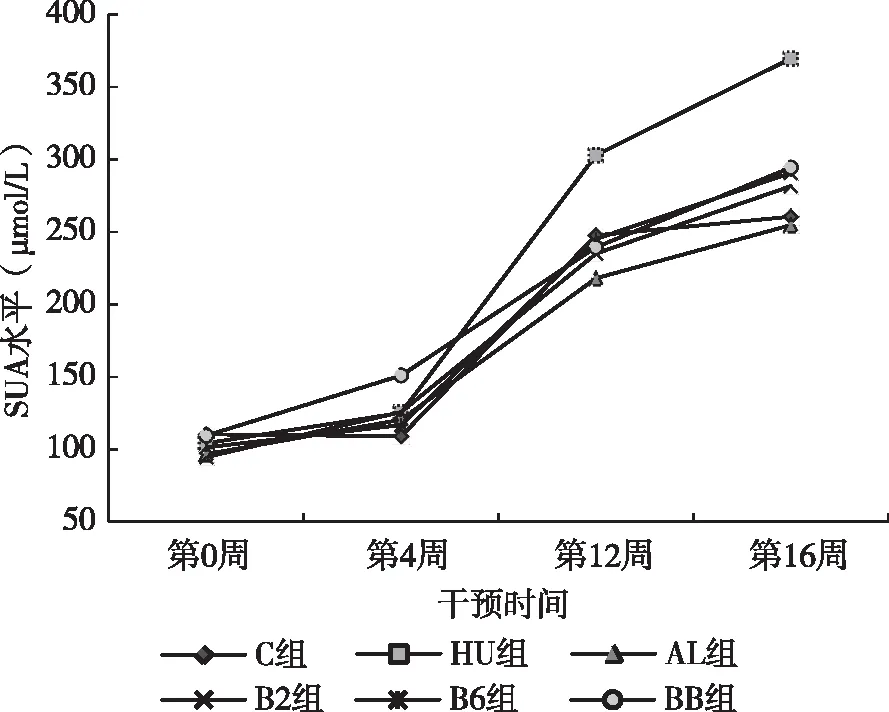
图1 各组大鼠SUA水平
2.2 各组大鼠Urea、SCr水平
如表1所示,与HU组相比,B2组、B6组、BB组大鼠Urea水平分别降低了20.14%、16.61%、16.47%(P值均<0.05)。SCr结果显示,与C组相比,HU组明显升高,而B2组、B6组、BB组降低(P值均<0.05)。与HU组相比,B2组、B6组、BB组大鼠SCr水平分别降低了23.98%、22.21%、21.56%(P值均<0.05)。

表1 各组大鼠Urea及SCr情况
注:a与C组相比,差异有统计学意义,P<0.05;b与HU组相比,差异有统计学意义,P<0.05;c与AL组相比,差异有统计学意义,P<0.05
2.3 各组大鼠肾脏病理切片结果
如图2所示,C组、AL组、B6组大鼠肾脏结构正常,肾皮质中肾小球分布均匀,大小正常,肾小管无肿胀变性,无炎性细胞浸润。而HU组、B2组、BB组大鼠的肾脏可见不同程度的炎性细胞浸润,但无明显纤维化。其中,HU组大鼠肾脏组织炎性细胞浸润的程度最高。

图2 各组大鼠肾脏病理改变(HE染色,200×)注:A:空白对照组(C组);B:模型组(HU组,箭头所指为炎性细胞);C:阳性对照组(AL组);D:维生素B2组(B2组,箭头所指为炎性细胞);E:维生素B6组(B6组);F:维生素B2+B6组(BB组,箭头所指为炎性细胞)
2.4 各组大鼠肝匀浆XOD、ADA活性
如表2所示,干预16w末,HU组、B6组、BB组大鼠肝匀浆XOD活力显著高于C组(P值均<0.05),分别达到了78.11、70.15、72.32 U/gprot。与HU组相比,其余各组大鼠肝匀浆XOD活力明显降低(P值均<0.05)。与BB组相比,AL组和B2组大鼠肝匀浆XOD活力有明显降低(P值均<0.05)。干预16w末,与C组相比,HU组大鼠肝匀浆ADA活力明显升高(P<0.05),达到了459.38 U/gprot;而其余各组与C组之间的差异并不明显。与HU组相比,AL组、B2组和B6组大鼠肝匀浆ADA的活力明显降低(P值均<0.05)。
2.5 维生素B2、维生素B6联合作用分析
交互作用分析结果显示,维生素B2与维生素B6对12w及16wSUA、XOD及ADA的影响不存在交互作用。因此,本实验分析了VitB2和VitB6的主效应(表3)。结果显示,VitB2(B2组与BB组)干预与非VitB2(B6组和HU组)干预相比,VitB2可以有效降低高尿酸血症大鼠的SUA和肝脏XOD活性(P值均<0.05),而对ADA的影响并不明显。VitB6(B6组与BB组)干预与非VitB6(B2组和HU组)干预相比,VitB6仅对16w末大鼠SUA的水平有降低的作用,而对大鼠肝脏XOD和ADA活性无明显的影响。


组别数量XODADAC1261.32±7.83338.74±77.39HU1278.10±5.69a459.38±75.42aAL1265.13±5.07bc361.48±106.70bB21265.29±4.48bc355.97±126.34bB61270.15±5.17ab385.00±90.33bBB1272.32±6.73ab405.94±63.00
注:a与C组相比,差异有统计学意义,P<0.05;b与HU组相比,差异有统计学意义,P<0.05;c与AL组相比,差异有统计学意义,P<0.05
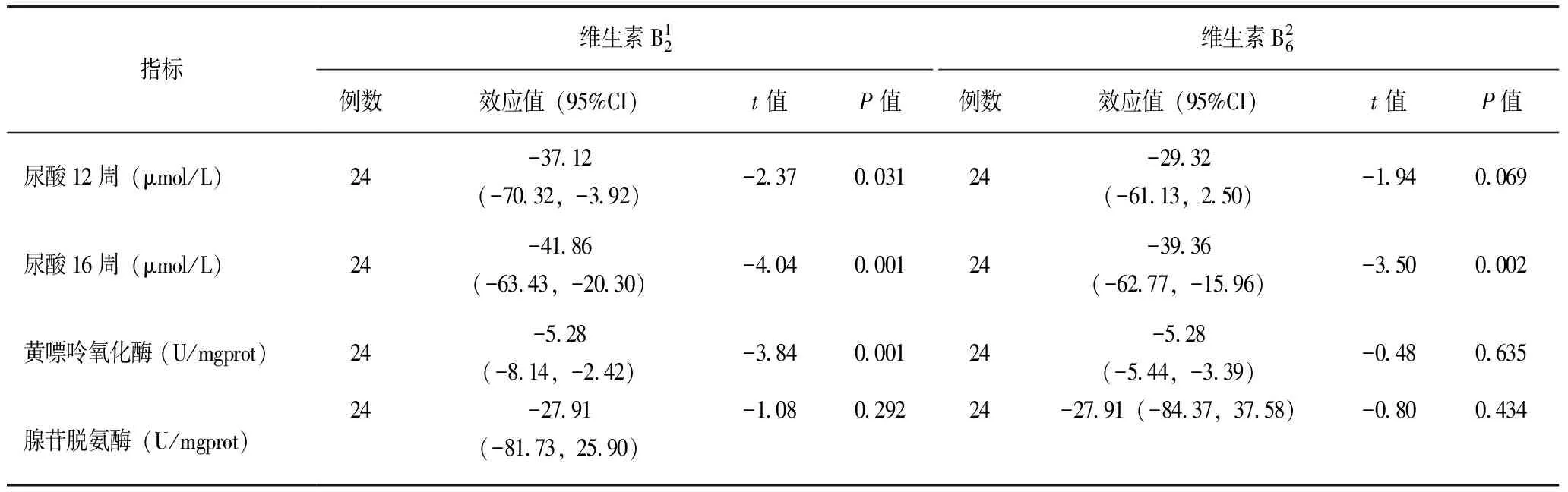
表3 维生素B2与维生素B6对高尿酸血症大鼠SUA、XOD、ADA析因设计分析结果
注:维生素B2干预包括B2组和BB组;维生素B6干预包括B6组和BB组
3 讨论
本实验采用酵母饲料喂养与氧嗪酸钾灌胃建立大鼠高尿酸血症模型[2,8-12]。摄入大剂量的酵母,可引起嘌呤代谢紊乱、黄嘌呤氧化酶活性增加,从而使尿酸的生成增加,产生高尿酸血症[6]。氧嗪酸钾是一种尿酸酶抑制剂,可以抑制尿酸酶的活性,减少尿酸分解,从而造成血尿酸升高[13-14]。由于大鼠体内存在尿酸酶,因而选择酵母与氧嗪酸钾联用来建立模型。
食物中摄入嘌呤过多、内源性嘌呤生成过多、嘌呤代谢速度增加均可引起尿酸生成过多。食物中50%的RNA、25%的DNA都最终要以尿酸的形式排泄[15]。酵母中含有大量的遗传物质嘌呤,当摄入大量酵母时,嘌呤会经核苷酶分解为次黄嘌呤,后者经过黄嘌呤氧化酶(XOD)作用代谢为黄嘌呤,经进一步代谢最终形成大量尿酸[16-19]。研究表明,叶酸等B族维生素可以通过降低黄嘌呤氧化酶产生氧自由基及过氧化物的能力,抑制黄嘌呤氧化酶的活性,从而同时减少了SUA生成[7,20-21]。维生素B2是以 FMN和FAD辅酶形式与蛋白质结合存在,参与机体许多代谢反应。FAD作为辅酶参与维生素B6转变为磷酸吡哆醛的过程,而且维生素B2缺乏可引起亚甲基四氢叶酸还原酶的活性降低,引起叶酸代谢异常。因此,缺乏维生素B2可能会影响到黄嘌呤氧化酶的活性,从而影响机体尿酸水平。而本实验显示,B2组、B6组及BB组大鼠肝匀浆中XOD的活性较HU组明显降低,证明补充维生素B2、维生素B6及两者联合应用,可以通过降低XOD活性,从而达到降低尿酸生成的效果。
腺苷脱氨酶(ADA)也是嘌呤核苷代谢中重要的酶类,其代谢终产物为尿酸[16-18]。本实验显示,B2、B6组大鼠肝匀浆中ADA的活性较HU组显著降低,证明维生素B2、维生素B6可以通过降低ADA活性,从而达到降低血尿酸生成的效果。
尿素的浓度在一定程度上可反映肾小球滤过功能的损害程度,是常用的肾功能指标之一。临床上检测血肌酐是了解肾功能的主要方法之一,是肾脏功能的重要指标,血清肌酐升高意味着肾功能的损害[22]。本实验中,HU组大鼠血清尿素及肌酐水平均升高,证明HU组大鼠的肾脏有一定程度的损伤,尿酸的排泄受到了一定的影响。而B2组、B6组及BB组大鼠Urea与SCr较HU组降低,提示维生素B2、维生素B6以及两者联合应用对高尿酸血症大鼠的肾脏有一定的保护作用,从而影响其SUA的水平。从肾脏组织病理学结果也可以看出,HU组大鼠的炎性细胞浸润程度最高,其肾脏的损伤程度较其他组严重。而B2组及BB组大鼠的浸润程度较低,提示维生素B2可以改善高尿酸血症大鼠的肾脏功能。
本实验应用维生素B2、维生素B6以及维生素B2与B6联合应用对高尿酸血症大鼠进行干预,结果显示,B2、B6组及BB组大鼠的SUA水平仍高于C组,与模型组相较,维生素B2、B6组及BB组血尿酸(SUA)水平明显降低;但析因分析结果没有显示维生素B2和维生素B6之间对高尿酸血症大鼠的SUA、XOD、ADA的交互作用;提示维生素B2、维生素B6对高尿酸血症大鼠的SUA水平有一定的改善作用。鉴于该研究为动物实验,维生素B2、B6对人群嘌呤代谢和尿酸水平影响以及对高尿酸血症或痛风的预防和改善作用尚待进一步研究。◇
[1]郑媛,王淳,李伟,等.复方痛风康对高尿酸血症模型大鼠肾功能的保护作用及影响IL-1β、TNF-α、TGF-β_1的研究[J].中国中西医结合肾病杂志,2015(7):575-578.
[2]陈瞳,崔凌凌,王希波,等.高尿酸血症大鼠模型的建立及其肾脏损伤观察[J].山东医药,2013,53(43):29-31.
[3]Hosoya T,et al.The effect of febuxostat to prevent a further reduction in renal function of patients with hyperuricemia who have never had gout and are complicated by chronic kidney disease stage 3:study protocol for a multicenter randomized controlled study[J]. Trials,2014,15(1):26.
[4]Krishnan E,Pandya B J,Chung L,et al.Hyperuricemia and the risk for subclinical coronary atherosclerosis-data from a prospective observational cohort study[J]. Arthritis Research & Therapy,2011,13(2):1-8.
[5]孙长颢.营养与食品卫生学[M]. 人民卫生出版社,2017.
[6]柳高,朱平.不同种类B族维生素和复方丹参滴丸对高尿酸血症小鼠血尿酸水平的影响[D].北京:解放军总医院,2012.
[7]董静.B族维生素在小鼠高尿酸血症中的作用[D].北京:中国人民解放军军医进修学院,2009.
[8]陈光亮,徐叔云.高尿酸血症动物模型研究进展[J]. 中国药理学通报,2004,20(4):369-373.
[9]卢忠英,郁建平,朱梦琪,等.不同组合造模剂诱导大鼠高尿酸血症模型的比较研究[J].山地农业生物学报,2014,33(5):40-42.
[10]杨桂梅,黄胜华,李江,等.腺嘌呤和氧嗪酸制作高尿酸血症大鼠模型比较[J].实验动物科学,2011,28(2):23-26.
[11]杨桂梅,黄胜华,连希艳,等.大鼠高尿酸血症模型的建立[J].实验动物科学,2011,28(3):25-28.
[12]胡庆华,张宪,王钰,等.芒果苷促进高尿酸血症小鼠尿酸排泄和肾功能改善以及调节相关肾脏转运体的作用[J]. 药学学报,2010(10):1239-1246.
[13]王凯,夏德萌,郝晓伟,等.氧嗪酸钾诱导高尿酸血症小鼠血清代谢组学研究[J]. 药学服务与研究,2015,15(6):416-421.
[14]Hall I H,Scoville J P,Reynolds D J,et al.Substituted cyclic imides as potential anti-gout agents[J]. Life Sciences,1990,46(26):1923-1927.
[15]张庆燕,刘志红.高尿酸血症与肾脏损伤[J].肾脏病与透析肾移植杂志,2009,18(3):266-271.
[16]赵莹,张启虹,冯明声,等.降尿酸药物黄嘌呤氧化酶抑制剂的研究进展[J]. 药学进展,2009,33(2):55-61.
[17]Huang J,et al.Effects of genistein,apigenin,quercetin,rutin and astilbin on serum uric acid levels and xanthine oxidase activities in normal and hyperuricemic mice[J]. Food & Chemical Toxicology,2011,49(9):1943-1947.
[18]赵永芳.叶黄素对高脂膳食SD大鼠血尿酸的影响及机制探讨[D]. 郑州:郑州大学,2014.
[19]黄敬群,朱妙章,王四旺.染料木素、芹菜素、槲皮素、芦丁和落新妇苷对高尿酸血症小鼠黄嘌呤氧化酶活性及血清尿酸水平的影响[J].中国药理学通报,2011,27(4):561-565.
[20]Wu C J,et al.Impact of adding folic acid,vitamin B(12)and probucol to standard antihypertensive medication on plasma homocysteine and asymmetric dimethylarginine levels of essential hypertension patients[J]. Zhonghua Xin Xue Guan Bing Za Zhi,2012,40(12):1003-1008.
[21]Verhaar M C,Wever R M,Kastelein J J,et al.5-methyltetrahydrofolate,the active form of folic acid,restores endothelial function in familial hypercholesterolemia[J]. Circulation,1998,97(3):237-241.
[22]牛艳芬,高丽辉,刘旭,等.芒果苷对氧嗪酸钾所致慢性高尿酸血症大鼠尿酸及肝肾功能的影响[J]. 中国药理学通报,2012,28(11):1578-1581.

