小檗碱对H2O2损伤大鼠神经干细胞增殖的影响
孙胜男,刘 欣,佟苗苗,伊舒岩,范乐萌,刘 双,李昕茹,樊乐琪,张 囡(1.中国医科大学药学院,沈阳 1101; .河北医科大学药学院,河北 石家庄 050000; .承德医学院附属医院药学部,河北 承德 067000)
神经干细胞(neural stem cells,NSCs)具有分化神经元和胶质细胞的多向分化潜能[1]。研究发现NSCs具有修复损伤组织的能力,来防治由细胞缺失或损伤引起的多种疾病,如神经系统退行性或损伤性疾病。在中风和缺氧缺血等实验性的脑损伤模型中,NSCs开始增生和迁移到损伤部位分化为神经元[2 - 3]。脑组织受损后,周围环境缺血缺氧、氧化应激等炎症因子等多种不良因素,导致具有增殖、分化功能的NSCs数量有限,难以修复损伤的神经区域[4]。寻找促进体内NSCs增殖的药物对于治疗神经系统疾病具有重要的意义。小檗碱(berberine)是一种异喹啉类生物碱,是黄连和黄柏的主要活性成分,具有抗炎、改善糖脂代谢、治疗的腹泻作用[5 - 6]。此外,小檗碱对脑缺血、阿尔茨海默病、创伤性脑损伤引起的神经损伤具有保护作用[7-9]。本实验采用细胞培养技术,观察小檗碱对NSCs增殖的影响,为开发对NSCs具有保护效能的治疗药物以及小檗碱的临床应用提供理论依据。
1 材料和方法
1.1 实验动物
SPF级24 h内新生SD大鼠,雌雄不限,购自河北医科大学实验动物中心[SCXK (冀) 2017-1-003]。无菌手术在实验动物中心进行[SYXK (冀) 2017-0012]。动物实验经由实验动物管理委员会批准(2017-0083),实验动物使用按照3R原则给予人道的关怀照顾。
1.2 主要试剂与仪器
DMEM/F12培养基,B27添加剂为美国Gibco公司产品;碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF),表皮生长因子(epidermal growth factor,EGF)为美国Peprotech公司产品;多聚赖氨酸,小鼠抗大鼠Nestin抗体,兔抗大鼠Ki67、兔抗大鼠Notch1、兔抗大鼠Hes1抗体,FITC-标记兔抗鼠二抗、Cy3-标记羊抗兔二抗,DAPT均为美国CST公司产品;CCK8试剂盒为北京庄盟有限公司产品。倒置荧光显微镜购自日本Olympus公司;DYY-12型电泳仪、DYCZ-24DN型电泳槽、DYCZ-40B型转印电泳仪购自北京六一仪器厂。
1.3 实验方法
1.3.1 NSCs的分离
将出生24 h内的新生SD大鼠脱颈处死后置于体积分数为75%乙醇消毒5 min,无菌条件下取出全脑,置于盛有冷PBS缓冲液的培养皿中去除小脑、脑干、血管和脑膜,取出大脑皮层并去除软脑膜,PBS缓冲液漂洗两次,转移至离心管加入一定量冷PBS缓冲液吹打均匀,过200目筛网,1000 r/min离心5 min弃上清,全培养基(2% B27,20 μg/L bFGF,20 μg/L EGF的DMEM/F12)重悬,以每毫升1.4 × 106个细胞的密度接种于6孔板中,每2~3 d半量换液,5~9 d传代一次。收集原代培养的神经球,离心,重悬细胞,调整细胞密度为每毫升1 × 105个,放入37℃,5% CO2孵箱中培养3~7 d后进行实验处理。本研究所用的NSCs均为传1代的细胞。
1.3.2 NSCs鉴定
将生长状况良好的第1代NSCs接种到预先经过多聚赖氨酸处理的96孔培养板中,37℃、5% CO2培养箱中培养3~4 d后取出,去掉完全培养基,PBS缓冲液清洗2次,每次2 min。4%多聚甲醛室温固定15 min,PBS缓冲液清洗2次,每次2 min。0.5% Triton X-100细胞通透5 min,PBS缓冲液清洗2次,每次2 min。正常牛血清(10%)室温封闭30 min。吸出血清,加入兔抗鼠Nestin(1∶200),4℃过夜,PBS缓冲液洗涤细胞2次,每次3 min。在黑暗中孵育荧光标记的二次抗体,37℃避光孵育1 h,PBS缓冲液漂洗3次,DAPI染核1 min;再用PBS缓冲液漂洗2次,体积分数0.5%甘油封片,倒置荧光显微镜照相。
1.3.3 实验分组及CCK8法检测NSCs活力
将培养的NSCs用胰酶消化为单个NSC,以每孔2 × 105个细胞、200 μL的体积加入96孔板中,培养至第3天。正常组,继续培养12 h;H2O2组,给予终浓度为30 μmol/L H2O2处理12 h;小檗碱组,H2O2和不同终浓度小檗碱(0.5、1、5、20 μmol/L)孵育12 h;DAPT(Notch信号通路阻断剂)组,H2O2、小檗碱(5 μmol/L)、DAPT共同孵育12 h。实验结束后,向每孔加入10 μL CCK8溶液,将培养板在培养箱内孵育2 h,用酶标仪测定在450 nm处的吸光度。细胞活力(%)=(A实验孔-A空白孔)/(A对照孔-A空白孔) × 100%。
1.3.4 测量NSCs球平均直径
NSC单细胞悬浮液铺于96孔板,密度为每孔2 × 105个细胞,体积为每孔200 μL,培养至3 d。设置正常对照组、H2O2组和小檗碱组(5、10 μmol/L),处理NSCs结束后,显微镜下任选5个视野观察神经球数量和直径大小。
1.3.5 Ki67染色检测NSCs增殖
正常对照组、H2O2组、小檗碱组(5 μmol/L)、DAPT组收集NSCs,弃去培养液,PBS缓冲液洗涤3次,每次5 min,体积分数4%多聚甲醛室温下固定15 min行免疫荧光染色。每组在显微镜下随机计数5个视野下Ki67阳性细胞数,计算阳性细胞率(%)=Ki67阳性细胞数/DAPI细胞数× 100%。
1.3.6 Western blot检测蛋白表达
蛋白裂解液处理各组样品,使用超声破碎,离心(4℃,12 000 r/min,10 min),每孔上样量50 μg,SDS-PAGE分离,转PVDF膜上,5%脱脂牛奶封闭2 h,加入Ki67(1∶1000)、Notch1(1∶1000)、Hes1(1∶1000)、β-actin(1∶1000)抗体4℃冰箱过夜,弃掉一抗,TBST缓冲液洗膜5 min,3次,室温孵育二抗(1∶10 000)2 h,弃掉二抗,TBST缓冲液洗膜5 min,3次;ECL发光显色,采用β-actin作为内参,Image J软件分析相对灰度值。实验重复3次。
1.4 统计学方法
2 结果
2.1 NSCs的鉴定
24 h后,可在普通光显微镜下看到许多小悬浮神经球。神经球的直径随时间的增加而增加,形状变圆,培养72 h后,光镜下可见细胞聚集形成的细胞团。免疫荧光化学染色检测NSCs的特征性蛋白Nestin的表达。结果显示,在神经球细胞团中有大量Nestin表达阳性,提示形成的神经球为NSCs。
2.2 小檗碱对NSCs活力影响
正常对照组和H2O2组细胞活力分别为(100.0±1.3)%和(58.6±4.5)%,差异有显著性(P< 0.05);与H2O2组相比,小檗碱0.5 μmol/L和1 μmol/L细胞活力升高,分别为(64.8±2.6)%和(65.9±4.2)%,但差异无显著性;小檗碱5、10及20 μmol/L细胞活力分别为(72.4±6.1)%、(74.8±4.5)%、(75.6±3.9)%,与H2O2组相比,差异有显著性(P< 0.05)。
2.3 小檗碱对NSCs大小影响
对照组NSCs球平均直径为(82.1±12.1) μm,H2O2组为(54.2±7.8) μm,与对照组比较,差异有显著性(P< 0.01)。小檗碱组(5 μmol/L)神经球直径为(67.1±9.6) μm,小檗碱组(10 μmol/L)神经球直径为(70.2±10.4) μm,与H2O2组相比,差异有显著性(P< 0.01)。见图1。
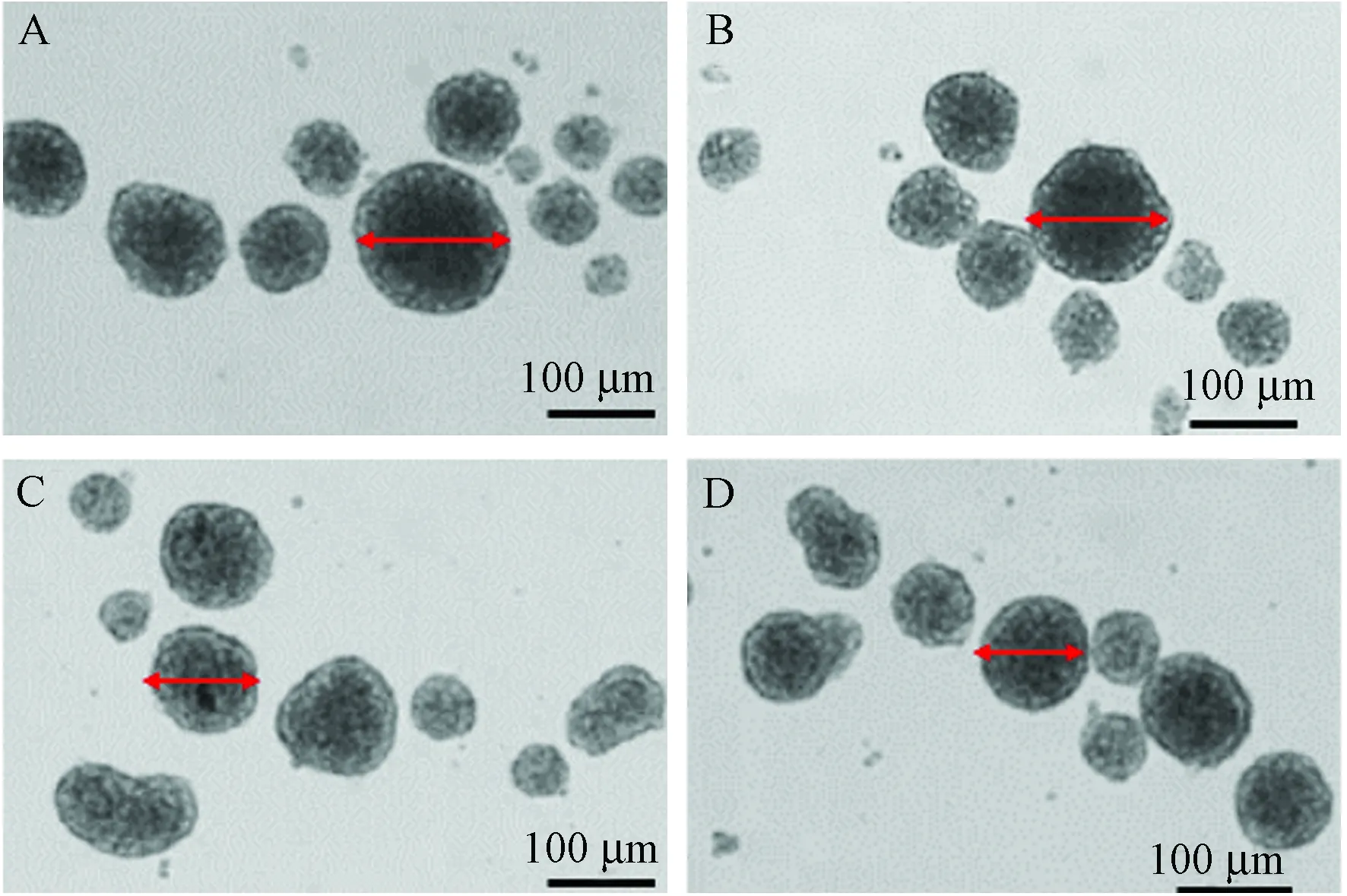
注:A:对照组;B:H2O2组;C:小檗碱5 μmol/L组;D:小檗碱10 μmol/L组。图1 小檗碱对NSCs增殖的影响Note.A: Control group; B: H2O2 group; C: Berberine group (5 μmol/L); D: Berberine group (10 μmol/L).Fig.1 Effect of berberine on neural stem cell proliferation
2.4 小檗碱对NSCs增殖率影响
与正常对照组相比,H2O2组Ki67阳性百分率明显降低(50.3%比21.3%,P< 0.01);小檗碱(5 μmol/L)处理12 h后相比H2O2组Ki67阳性细胞的比例明显增加(38.3%比21.3%,P< 0.01);DAPT组与小檗碱组相比,Ki67阳性细胞的比例下降(21.9%比38.4%,P< 0.01)。
2.5 小檗碱对NSCs中Notch通路相关蛋白的表达影响
Western blot结果显示,与对照组比较,H2O2处理后NSCs中Ki67、Notch1、Hes1蛋白表达水平明显减少(P< 0.01);与H2O2组比较,小檗碱组(5 μmol/L)细胞Ki67、Notch1、Hes1蛋白表达水平明显增加(P< 0.01)。小檗碱组加入Notch通路抑制剂DAPT后,与小檗碱组相比,Ki67、Notch1、Hes1蛋白表达水平显著降低(P< 0.01),说明DAPT拮抗小檗碱神经保护作用。
3 讨论
抗氧化系统与氧化系统的失衡,参与神经退化、缺血性脑损伤的进程。H2O2是氧化过程中具有很高活性的分子,可以引起细胞膜破坏及细胞的凋亡和坏死。成年哺乳动物脑损伤后,激活中枢神经系室管膜下层和海马的颗粒下层NSCs再生能力,通过促进神经再生替代死亡的神经元,从而促进组织重建和神经功能修复已成为临床治疗的重要方向[9]。但是内源性神经前体细胞迁移到病变区域进行增殖和分化的能力有限,不能使丧失的脑功能完全恢复,需要进行药物干预[10]。同时,外源性NSCs移植途径通过分泌高浓度的生长因子,有助于内源性神经再生,但是病灶区域长期炎症、缺乏营养、氧化攻击等损伤关系导致内源性NSCs增殖能力下降和外源性NSCs存活率低,极大的阻碍了大脑自身修复能力[10]。促进神经再生及分化和减少损伤区脑细胞的凋亡是促进脑损伤后神经功能恢复的关键[10 - 11]。
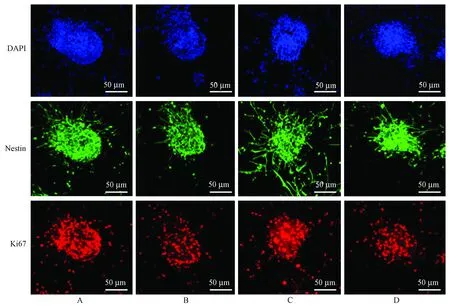
注:A:对照组;B:H2O2组;C:小檗碱5 μmol/L组;D:DAPT组。图2 小檗碱对NSCs增殖蛋白的影响Note.A: Control group; B: H2O2 group; C: Berberine group (5 μmol/L); D: DAPT group.Fig.2 Effect of berberine on the neural stem cell proliferation protein
表1 各组蛋白表达情况Tab.1 Comparison of Ki67, Notch1, and Hes1 protein expression in each group
注:与对照组相比,*P< 0.05,**P< 0.01;与H2O2组相比,#P< 0.05,##P< 0.01;与小檗碱组相比,&P< 0.05,&&P< 0.01。
Note.Compared with the control group,*P< 0.05,**P< 0.01. Compared with the H2O2group,#P< 0.05,##P< 0.01. Compared with the berberine group,&P< 0.05,&&P< 0.01.
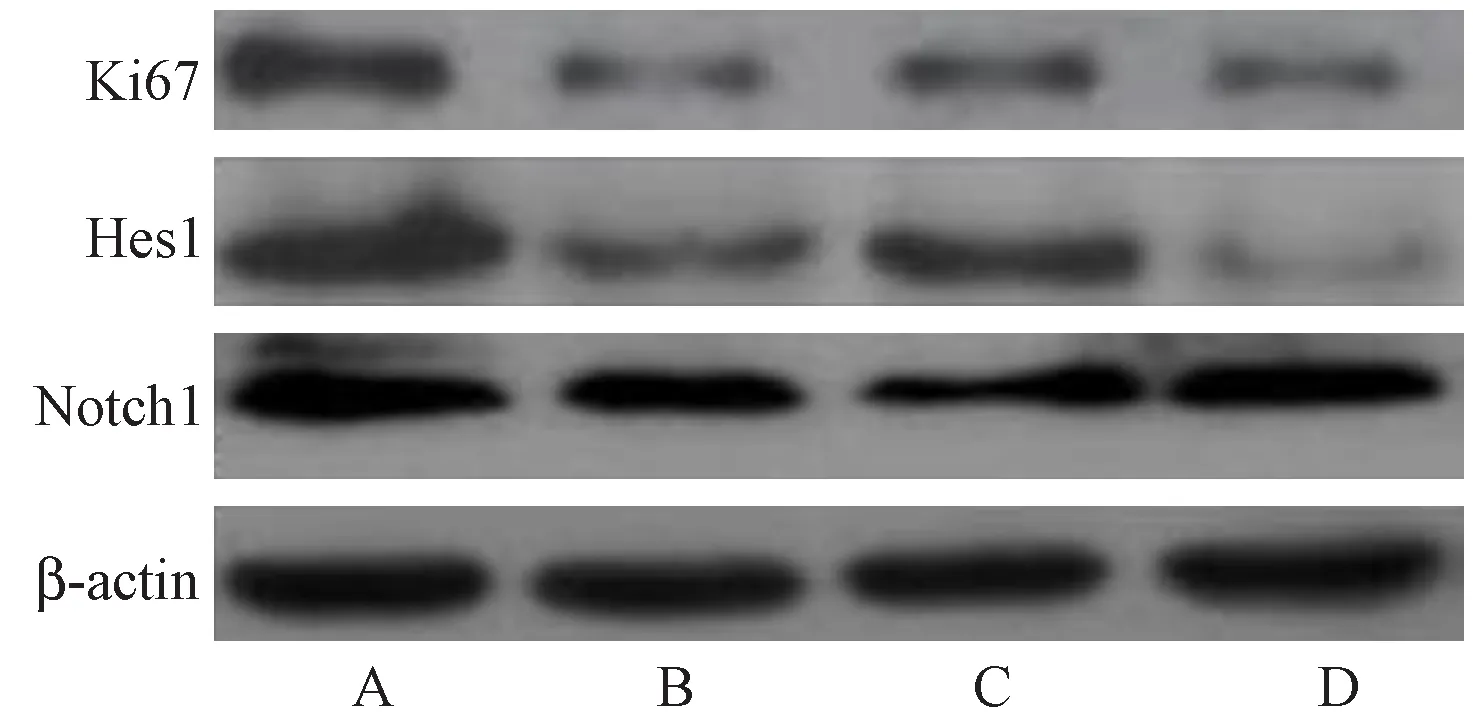
注:A:对照组;B:H2O2组;C:小檗碱5 μmol/L组;D:DAPT组。图3 小檗碱对NSCs中Notch通路相关蛋白的表达影响Note.A: Control group; B: H2O2 group; C: Berberine group (5 μmol/L); D: DAPT group.Fig.3 Effect of berberine on expression of Notch pathway-related proteins in neural stem cells
小檗碱对神经系统疾病具有潜在的治疗价值,有抗氧化、抗炎、降低神经元凋亡的作用[12]。在本研究中,采用不同浓度小檗碱(0.5、1、5、10、20 μmol/L)处理,当浓度增加到5 μmol/L时,小檗碱可以增强H2O2损伤的NSCs活力,而且随着小檗碱浓度的增加,细胞活力无显著变化。神经球被视为自由浮动的一束束NSCs,神经球的形成是NSCs不断增殖的直接体现,因此,可用神经球平均直径反映NSCs的增殖能力。本实验结果提示5 μmol/L小檗碱处理可以改善损伤细胞的形态,改善H2O2产生的增殖抑制作用。
Ki67是与细胞增殖有关的核抗原,通过Western blot方法,与正常对照组比较,H2O2组Ki67蛋白表达显著降低,小檗碱处理可以显著提高Ki67蛋白表达,说明小檗碱能显著拮抗H2O2导致的Ki67蛋白表达的下降。NSCs的自我维持和增殖功能是受Notch信号途径的调控。将Notch通路的抑制剂DAPT运用于NSCs的体外培养中,镜下可见NSCs数量明显减少,NSCs生长过程中所形成的神经球的直径也明显减小;过表达Notch1、Hes1和Hes5能够促进神经前体细胞的增殖和自我更新[13 - 14]。本实验结果显示,H2O2可以抑制Notch1和Hes1蛋白表达,小檗碱处理后可增强Notch1和Hes1蛋白表达;而在小檗碱组加入10 μmol/L Notch通路阻断剂DAPT后,Ki67表达以及Notch1和Hes1蛋白表达均下降,说明DAPT可抵消小檗碱的促增殖作用,初步确认了小檗碱发挥促增殖的作用可能是通过调节Notch信号通路。
参考文献:
[1] Gincberg G, Arien-Zakay H, Lazarovici P, et al. Neural stem cells: therapeutic potential for neurodegenerative diseases [J]. Br Med Bull, 2012, 104: 7-19.
[2] 薛金龙, 石淑先, 孙芳玲, 等. Wnt信号通路及相关神经因子对神经再生的影响 [J]. 中国比较医学杂志, 2013, 23(9): 80-86, 79.
[3] Felling RJ, Snyder MJ, Romanko MJ, et al. Neural stem/progenitor cells participate in the regenerative response to perinatal Hypoxia/Ischemia [J]. J Neurosci, 2006, 26(16): 4359-4369.
[4] Shen CC, Lin CH, Yang YC, et al. Intravenous implanted neural stem cells migrate to injury site, reduce infarct volume, and improve behavior after cerebral ischemia [J]. Curr Neurovasc Res, 2010, 7(3): 167-179.
[5] Wu YH, Chuang SY, Hong WC, et al. Berberine reduces leukocyte adhesion to LPS-stimulated endothelial cells and VCAM-1 expression bothinvivoandinvitro[J]. Int J Immunopathol Pharmacol, 2012, 25(3): 741-750.
[6] Di Pierro F, Villanova N, Agostini F, et al. Pilot study on the additive effects of berberine and oral type 2 diabetes agents for patients with suboptimal glycemic control [J]. Diabetes Metab Syndr, 2012, 10(5): 213-217.
[7] 张玲玲, 黄澜, 徐艳峰, 等. 小檗碱对2型糖尿病ICR小鼠模型的治疗作用 [J]. 中国比较医学杂志, 2010, 20(1): 23-27.
[8] Zhu F, Qian C. Berberine chloride can ameliorate the spatial memory impairment and increase the expression of interleukin-1β and inducible nitric oxide synthase in the rat model of Alzheimer’s disease [J]. BMC Neurosci, 2006, 1(7): 78.
[9] Madri JA. Modeling the neurovascular niche: implications for recovery from CNS injury [J]. J Physiol Pharmacol. 2009, 60(Suppl 4): 95-104.
[10] Miyamoto N, Maki T, Pham LD, et al. Oxidative stress interferes with white matter renewal after prolonged cerebral hypoperfusion in mice [J]. Stroke, 2013, 44(12): 3516-3521.
[11] 李峰, 蔡光先. 脑缺血后神经再生及其治疗的研究进展 [J]. 中华中医药杂志, 2016, 31(2): 578-581.
[12] Chen CC, Hung TH, Lee CY, et al. Berberine protects against neuronal damage via suppression of glia-mediated inflammation in traumatic brain injury [J]. PLoS One, 2014, 9(12): e115694.
[13] Ahmed T, Gilani AU, Abdollahi M, et al. Berberine and neurodegeneration: a review of literature [J]. Pharmacol Rep, 2015, 67(5): 970-979.
[14] Hu YY, Zheng MH, Cheng G, et al. Notch signaling contributes to the maintenance of both normal neural stem cells and patient-derived glioma stem cells [J]. BMC Cancer, 2011, 11: 82.

