SIV感染猴外周血CD14+单核细胞CD169分子表达的变化
李 想,薛 婧,陈 霆,丛 喆,魏 强(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,卫计委人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,新发再发传染病动物模型研究北京市重点实验室,北京 100021)
唾液酸黏附素(sialic acid-binding immunoglobulin-type lectins, Siglecs)是宿主最大的唾液酸结合蛋白。Siglec-1,也被称作CD169,是第一个被发现的Siglecs家族的成员,主要表达于单核巨噬细胞和树突状细胞[1 - 2]。CD169可与病毒表面的某些糖蛋白结合,增强病毒与细胞的结合,从而促进病毒感染[3]。艾滋病又称获得性免疫缺陷综合征(acquired immunodeficiency syndrome, AIDS),是由人类免疫缺陷病毒(human immunodeficiency virus,HIV)引起的,HIV主要分为两种类型,即HIV-1和HIV-2,HIV-1是目前全球流行的主要病毒株。HIV-1研究中发现,机体感染HIV-1后,组织巨噬细胞和外周血单核细胞表面高表达CD169[4]。猴免疫缺陷病毒(simian immunodeficiency virus,SIV)是从灵长类动物身上分离得到的类似于HIV的病毒,SIV恒河猴模型被认为是研究艾滋病最有效的模型,而SIVmac239是常用的SIV病毒。因此,本研究观察了SIVmac239感染前后,恒河猴外周血单核细胞的比例及其表面CD169表达量的变化,分析了引起单核细胞CD169表达量变化的主要原因,以期为HIV-1/SIV感染单核巨噬细胞的研究提供新的思路。
1 材料和方法
1.1 实验材料
实验动物:SPF级中国恒河猴40只,3~4岁,3~5 kg,雌雄各半,购自北京协尔鑫生物资源研究所[SCXK (京) 2015-0011]。动物饲养及相关的实验在生物安全三级实验室中进行[SYXK (京) 2015-0036]。实验前,经血清学间接免疫荧光抗体检查法(IFA)检查排除猴B病毒(BV)、猴免疫缺陷病毒(SIV)、猴逆转录D型病毒(SRV-1)和猴T淋巴细胞性I型病毒(STLV-1)等相关病原体的感染。本实验通过本单位实验动物管理和使用委员会的动物伦理审查,批准号为XJ16007。
病毒及动物接种:SIVmac239,由美国Aaron Diamond艾滋病研究中心Preston Marx博士惠赠。中国恒河猴PBMC扩增制备,CEMx174细胞滴定TCID50为每毫升3 × 105。病毒使用剂量为500 TCID50,静脉接种病毒。
样本的收集:攻毒前和静脉攻毒后第49天,采集恒河猴外周血2 mL,进行全血流式;采集正常恒河猴外周血,分离PBMC,流式分选CD14+单核细胞,用含10%胎牛血清的RPMI-1640完全培养液,37℃、5% CO2孵箱中培养。
1.2 主要试剂与仪器
Recombinant Human IFN-alpha A protein(货号:11100-1)购自R&D公司;流式抗体PE Mouse Anti-Human CD14(货号:557154),FITC Mouse Anti-Human CD14(货号:555397),PE Mouse Anti-Human IFN-α(货号:560097)和PerCP-CyTM5.5 Mouse Anti-Human CD16(货号:560717)购自BD公司;流式抗体APC Anti-Human CD169(货号:346008)购自BioLegend公司;Human M-CSF(货号:300-25-10UG)和Human IL-13(货号:200-13-10UG)购自Peprotech公司;Recombinant Rhesus Macaque IL-4 Protein(货号:1577-IL-010/CF)购自R&D Systems公司;流式细胞洗液(PBS Ⅱ)为含2% FBS和2 mmol/L EDTA的PBS溶液。BD AccuriTMC6流式细胞仪,BD FACSAria Ⅱ流式细胞仪,日本Hitachi CF16RXII高速离心机,Dynamica台式离心机,ESCO生物安全柜,Thermo Forma二氧化碳恒温培养箱。
1.3 实验方法
1.3.1 流式细胞术分选恒河猴外周血CD14+单核细胞[5]
(1)恒河猴外周血PBMC分离:取40 mL正常恒河猴的外周血,2500 r/min离心10 min,弃去血浆,用RPMI-1640培养液等比稀释血细胞,混匀后,每10 mL血细胞稀释液缓慢加至5 mL Ficoll液面的上方(Ficoll与稀释前血液的体积比为1∶1),2800 r/min离心30 min,用吸管将中间单个核细胞层吸出,转移至另一新的离心管中,用不少于PBMC体积三倍的RPMI-1640培养液洗涤细胞两次,2000 r/min离心10 min,适量的RPMI-1640培养液重悬后计数。
(2)流式分选单核细胞:按20 μL抗CD14抗体/1 × 106个细胞的浓度加入抗体,混匀,4℃孵育30 min后,用PBS Ⅱ洗2次,4℃、2000 r/min离心3 min,适量PBS Ⅱ重悬后,使用BD FACSAria Ⅱ流式仪进行分选,得到CD14+单核细胞。
1.3.2 SIVmac239体外感染恒河猴外周血CD14+单核细胞[6]
取1 × 106个CD14+单核细胞置于24孔板中,1 mL完全培养液培养细胞,以100 μL的病毒用量感染细胞,混匀后置于37℃、5% CO2孵箱,培养48 h后,检测细胞表面CD169的表达量。
1.3.3 细胞因子刺激恒河猴外周血CD14+单核细胞[3]
(1)细胞因子IFN-α刺激单核细胞:取1 × 106个CD14+单核细胞置于24孔板中,1 mL完全培养液培养细胞,加入细胞因子IFN-α,使得IFN-α的终浓度为500 U/mL,48 h后检测细胞表面CD169的表达量。
(2)细胞因子M-CSF、IL-4、IL-13刺激单核细胞:取1 × 106个CD14+单核细胞置于24孔板中,1 mL完全培养液培养细胞,加入细胞因子M-CSF、IL-4和IL-13,使得M-CSF、IL-4和IL-13的终浓度均为20 ng/mL,48 h后检测细胞表面CD169的表达量。
1.3.4 流式细胞术检测细胞表面CD169分子表达量[7 - 8]
(1)全血流式:取100 μL全血,依次加入抗体PE Mouse Anti-Human CD14,PerCP-CyTM5.5 Mouse Anti-Human CD16,APC Anti-Human CD169,室温下避光孵育30 min,加入1 mL终浓度为10%的红细胞裂解液,室温作用8 min,加入1 mL PBS,2500 r/min离心5 min,弃去上清,加入2 mL PBS,2000 r/min离心10 min,适量PBS重悬过滤后BD AccuriTMC6流式细胞仪进行样本检测。
(2)胞外染色:将CD14+单核细胞从培养板中取出后,用PBS Ⅱ洗2次,4℃、2000 r/min离心3 min,调整细胞浓度为每毫升1 × 107个细胞,轻轻混匀后加入流式管内,每管100 μL。各流式管中加入相应抗体,4℃避光孵育30 min,PBS Ⅱ洗1次,PBS洗1次,PBS重悬后细胞筛过滤上机检测。
(3)胞内染色:每个流式管内加入100 μL IC Fixation Buffer,4℃孵育20 min,加入2 mL 1 × Permeabilization Buffer洗2次,4℃、2000 r/min离心3 min。100 μL 1 × Permeabilization Buffer重悬细胞后加入相应抗体,混匀后4℃避光孵育30 min,1 × Permeabilization Buffer洗2次,PBS洗1次,PBS重悬后细胞筛过滤上机检测。
1.4 统计学方法

2 结果
2.1 SIVmac239感染猴CD14+单核细胞表面分子CD169表达量分析
正常恒河猴经SIVmac239感染后,采集外周血,流式细胞术检测CD14+单核细胞的比例及其表面CD169分子表达量。结果显示,正常恒河猴外周血单核细胞低表达CD169,感染后,CD14+单核细胞的比例虽出现下降(P< 0.01)(图1A),但CD14+单核细胞表面CD169的表达量却显著增加(P< 0.01)(图1B)。
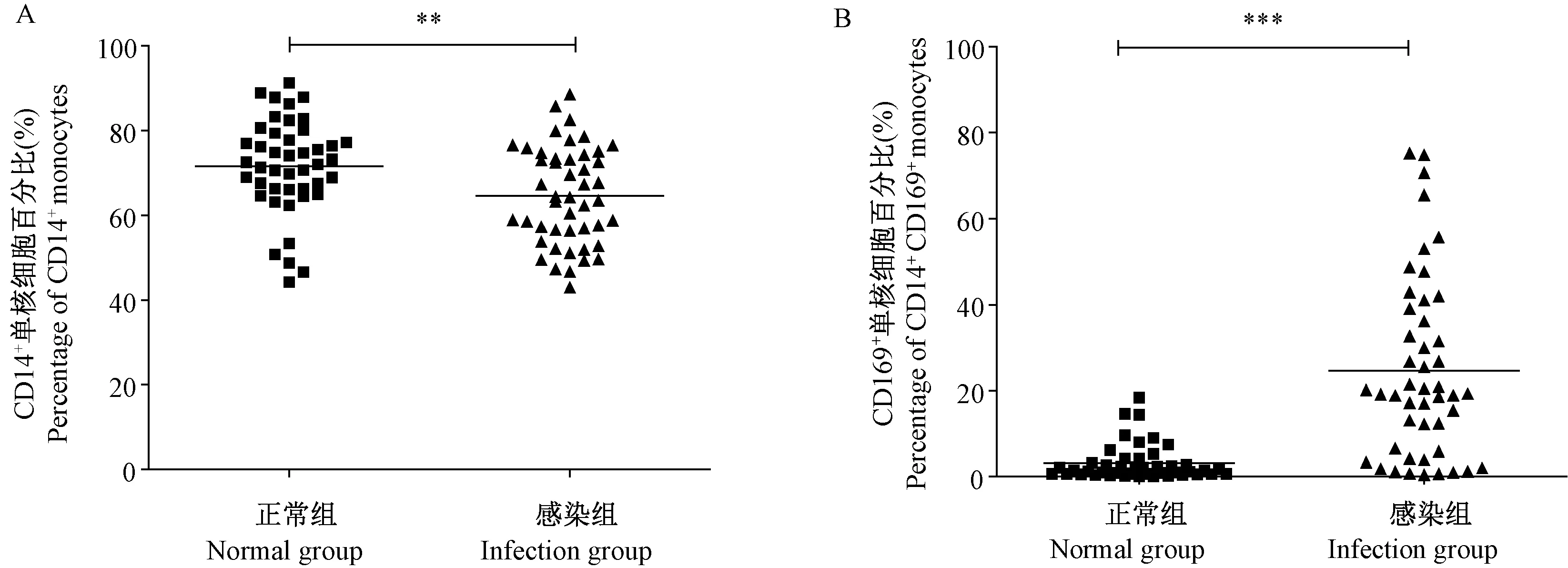
注:A:SIVmac239感染前后外周血单核细胞比例的变化;B:SIVmac239感染前后外周血单核细胞表面分子CD169表达量的变化。与正常组相比,** P< 0.01,*** P< 0.001;n=40。图1 CD14+单核细胞及其表面分子CD169在SIVmac239感染后表达量的变化Note.A: Changes in the percentage of peripheral blood CD14+ monocytes before and after SIVmac239 infection. B: Changes in the expression of CD169 on the surface of peripheral blood CD14+ monocytes before and after SIVmac239 infection. Compared with the normal group,**P< 0.01,***P< 0.001. n =40.Fig.1 Changes in the percentage of CD14+ monocytes in the peripheral blood and the expression of CD169 on their surface before and after SIVmac239 infection
2.2 SIVmac239感染前后恒河猴外周血不同单核细胞亚群CD169分子表达量分析
根据外周血单核细胞CD14和CD16表达量的差异,可将单核细胞分为三种亚型,经典型CD14++CD16-、中间过渡型CD14++CD16+和非经典型CD14+CD16++单核细胞。SIVmac239感染恒河猴前后,流式检测不同亚群单核细胞比例及其表面分子CD169表达量的变化。结果显示,感染后经典型CD14++CD16-和非经典型CD14+CD16++单核细胞的比例未发生明显的变化,中间过渡型CD14++CD16+单核细胞的比例出现下降(P< 0.01)(图2 A)。三种亚型单核细胞表面CD169的表达量均出现不同程度的增高(P< 0.01)(图2B)。其中,经典型CD14++CD16-和非经典型CD14+CD16++单核细胞表面CD169表达量升高较为明显,分别为感染前的10倍和11倍(图2C)。进一步分析可知,SIVmac239感染后,非经典型CD14+CD16++单核细胞表面分子CD169的表达量明显高于经典型CD14++CD16-单核细胞(P< 0.01)(图2D)。
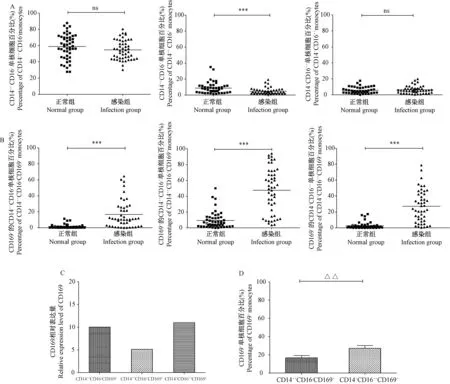
注:A:SIVmac239感染前后外周血不同亚群单核细胞比例的变化;B:SIVmac239感染前后外周血不同亚群单核细胞表面分子CD169表达量的变化;C:SIVmac239感染前后不同亚群单核细胞表面分子CD169表达量的比较;D:SIVmac239感染后经典型和非经典型单核细胞表面分子CD169表达量的比较。与正常组相比,*** P< 0.001,ns:差异无显著性;与CD14++CD16-CD169+相比,△△P< 0.01;n=40。图2 不同单核细胞亚群比例及其表面分子CD169在SIVmac239感染后表达量的变化Note.A: Changes in the percentage of different subsets of peripheral blood monocytes. B: Changes in the expression of CD169 on the surface of different subsets of peripheral blood monocytes. C: Comparison of the relative expression of CD169 on the surface of different subsets of monocytes. D: Comparison of the expression of CD169 on the surface of classical and non-classical monocytes after SIVmac239 infection. Compared with the normal group,***P< 0.001, ns: not significant. Compared with CD14++CD16-CD169+,△△P< 0.01. n=40.Fig.2 Changes in the percentage of different subsets of monocytes and the expression of CD169 on their surface after SIVmac239 infection
2.3 SIVmac239直接感染和不同细胞因子刺激CD14+单核细胞后CD169分子表达量的变化
正常恒河猴外周血流式分选CD14+单核细胞,细胞因子M-CSF、IL-4和IL-13等不能刺激CD14+单核细胞表面表达CD169(图3A),但经细胞因子IFN-α刺激48 h后,细胞表面高表达CD169,阳性率达到(98.9±0.89)%(图3B)。SIVmac239体外直接感染CD14+单核细胞,未能检测到CD169表达的变化(图3C),同时细胞内也未能检测到细胞因子IFN-α的表达(图3D)。

注:A:M-CSF、IL-4和IL-13诱导的CD14+单核细胞表面分子CD169表达量的变化;B:IFN-α诱导的CD14+单核细胞表面分子CD169表达量的变化;C:SIVmac239感染CD14+单核细胞后CD169表达量的变化;D:SIVmac239感染CD14+单核细胞后胞内细胞因子IFN-α表达量的变化。“……”:同型对照;“——”:CD169/IFN-α。图3 SIVmac239直接感染和不同细胞因子刺激的CD14+单核细胞表面分子CD169的变化Note.A: Changes in the expression of CD169 on the surface of CD14+ monocytes induced by M-CSF, IL-4 and IL-13. B: Changes in the expression of CD169 on the surface of CD14+ monocytes induced by IFN-α. C: Changes in the expression of CD169 on the surface of CD14+ monocytes after direct infection with SIVmac239. D: Changes in the expression of intracellular cytokine IFN-α of CD14+ monocytes after direct infection with SIVmac239. “……”: Isotype; “——”: CD169/IFN-α.Fig.3 Changes in the expression of CD169 on the surface of CD14+ monocytes after stimulated by different cytokines or directly infected with SIVmac239
3 讨论
单核巨噬细胞可以被HIV-1感染,成为HIV-1的潜伏感染细胞,其感染机制目前尚不完全明确。表达于单核巨噬细胞表面的CD169由于可以与病毒表面某些糖蛋白结合而促进病毒感染,从而成为HIV-1感染机制研究中的一个新的关注点。
本研究中发现,恒河猴外周血CD14+单核细胞在SIVmac239感染后比例略降低,这可能与外周血单核细胞向不同的组织迁徙分化为巨噬细胞有关[9]。同时,感染猴外周血CD14+单核细胞表面CD169的表达量显著增加,这与HIV-1感染后,组织巨噬细胞和外周血单核细胞高表达CD169的结果一致[4]。由此可见,单核巨噬细胞上表达的CD169分子确实和病毒的感染有关。
Ziegler-Heitbrock[10]根据外周血单核细胞CD14和CD16表达量的差异,将单核细胞分为三种亚型,经典型CD14++CD16-,中间过渡型CD14++CD16+和非经典型CD14+CD16++单核细胞。外周血单核细胞来源于骨髓,刚进入外周血时为经典型CD14++CD16-单核细胞,其中的一小部分分化为中间过渡型CD14++CD16+单核细胞,这类细胞最终可能分化为非经典型CD14+CD16++单核细胞,进入不同的组织,产生不同类型的终末分化巨噬细胞[11]。研究发现,非经典型CD14+CD16++单核细胞相比经典型CD14++CD16-单核细胞具有更强的吞噬能力和抗原提呈能力[9, 12],是发育更为成熟的细胞。恒河猴经SIVmac239感染后,非经典型CD14+CD16++单核细胞中CD169表达量的升高最为明显,其表达量明显高于经典型CD14++CD16-单核细胞,推测CD14+CD16++单核细胞更强的吞噬能力和抗原提呈能力可能与CD169具有吞噬和介导抗原提呈的作用[13 - 14]有关。
本研究还发现,SIVmac239体外直接感染正常恒河猴外周血CD14+单核细胞并不能引起CD169表达的增加,而使用IFN-α刺激可诱导单核细胞高表达CD169分子。但是,SIVmac239直接感染单核细胞并不能引起其本身分泌IFN-α,而使用其它细胞因子也不能引起单核细胞表达CD169。说明恒河猴外周血单核细胞CD169表达的增加不是病毒感染直接引起的,而是体内其它免疫细胞分泌的细胞因子IFN-α引起的。
综上所述,在HIV-1/SIV感染过程中,单核巨噬细胞表面CD169的表达量发生明显变化,其表达与病毒感染机体后其它细胞释放的细胞因子IFN-α相关,因此,对CD169的进一步研究可能为HIV-1感染机制的研究提供新的思路。
参考文献:
[1] Crocker PR, Paulson JC, Varki A. Siglecs and their roles in the immune system [J]. Nat Rev Immunol, 2007, 7(4): 255-266.
[2] Crocker PR, Mucklow S, Bouckson V, et al. Sialoadhesin, a macrophage sialic acid binding receptor for haemopoietic cells with 17 immunoglobulin-like domains [J]. EMBO J, 1994, 13(19): 4490-4503.
[3] Akiyama H, Ramirez NP, Gibson G, et al. Interferon-inducible CD169/Siglec1 attenuates anti-HIV-1 effects of IFN-α [J]. J Virol, 2017, 91(21): JVI.00972-17.
[4] van der Kuyl AC, van den Burg R, Zorgdrager F, et al. Sialoadhesin (CD169) expression in CD14+cells is upregulated early after HIV-1 infection and increases during disease progression [J]. PLoS One, 2007, 2(2): e257.
[5] 赵文秀, 张正奇, 许雅苹, 等. 不同流式抗体分选小鼠原位肝癌模型中髓系来源抑制性细胞的比较 [J]. 中国实验动物学报, 2013, 21(4): 42-46.
[6] Zheng Q, Hou J, Zhou Y, et al. Siglec1 suppresses antiviral innate immune response by inducing TBK1 degradation via the ubiquitin ligase TRIM27 [J]. Cell Res, 2015, 25(10): 1121-1136.
[7] 赵长城, 高锡强, 薛婧, 等. IL-21对恒河猴SHIV特异性CD8+T细胞毒性效应的影响 [J]. 中国实验动物学报, 2012, 20(5): 29-34.
[8] 彭卓颖, 丛喆, 李想, 等. 不同方法诱导THP-1细胞分化效果比较 [J]. 中国比较医学杂志, 2017, 27(9): 1-7.
[9] 王鑫, 康富标, 王桂平, 等. CD14+CD16+亚型单核细胞的研究进展 [J]. 免疫学杂志, 2012, 28(10): 910-913.
[10] Ziegler-Heitbrock L. Monocyte subsets in man and other species [J]. Cell Immunol, 2014, 289(1-2): 135-139.
[11] Moniuszko M, Liyanage NP, Doster MN, et al. Glucocorticoid treatment at moderate doses of SIVmac251-infected rhesus macaques decreases the frequency of circulating CD14+CD16++monocytes but does not alter the tissue virus reservoir [J]. AIDS Res Hum Retroviruses, 2015, 31(1): 115-126.
[12] Boudjeltia KZ, Brohee D, Piro P, et al. Monocyte-platelet complexes on CD14/CD16 monocyte subsets: relationship with ApoA-I levels. A preliminary study [J]. Cardiovasc Pathol, 2008, 17(5): 285-288.
[13] Izquierdo-Useros N, Lorizate M, McLaren PJ, et al. HIV-1 capture and transmission by dendritic cells: the role of viral glycolipids and the cellular receptor Siglec-1 [J]. PLoS Pathog, 2014, 10(7): e1004146.
[14] De Schryver M, Leemans A, Pintelon I, et al. Comparative analysis of the internalization of the macrophage receptor sialoadhesin in human and mouse primary macrophages and cell lines [J]. Immunobiology, 2017, 222(6): 797-806.

