三种胶原纤维染色法评价宫腔粘连的比较
陈 醒,毛乐乐,周应芳*,白文佩(.北京大学第一医院妇产科,北京 00034; 2.首都医科大学附属北京世纪坛医院妇产科,北京 00038)
宫腔粘连(intrauterine adhesion,IUA)又称Asherman综合征,是由于各种原因导致的子宫内膜基底层破坏,进而产生瘢痕修复,造成的宫颈管或宫腔部分或完全闭锁的一类疾病。宫腔粘连临床上主要表现为月经异常(闭经和月经稀发),继发性不孕,复发性流产等。随着人工流产和宫腔内手术数量的增加,宫腔粘连的发病率也不断上升,严重影响了育龄期女性的身心健康和生活质量[1 - 2]。宫腔粘连的发生机制目前尚未完全阐明。我们根据宫腔粘连的发生机制,使用刀片机械性刮宫的方法制作了大鼠宫腔粘连模型,并通过病理学常用的纤维组织染色方法Masson染色、van Gieson染色和天狼猩红(Sirius red)染色法来评价大鼠宫腔粘连的纤维化程度,并对三种方法进行组织学评价。
1 材料和方法
1.1 实验动物
本研究使用24只SPF级8周龄(成年)雌性SD大鼠,体重(210±10) g,购自北京维通利华实验动物有限公司[SCXK (京) 2016-0006],实验动物合格证号:11400700197806。大鼠饲养于北京大学第一医院实验动物中心屏障动物实验设施[SYXK (京) 2014-0010],大鼠自由饮水和摄食,适应环境至少1周后开始实验。无菌手术在北京大学第一医院实验动物中心屏障动物实验设施内进行。
1.2 主要试剂与仪器
HE染色液购自北京中杉金桥生物技术有限公司,Masson染色试剂盒(甲苯胺蓝)购自福州迈新生物技术开发有限公司,Masson染色试剂盒(亮绿)购自南京凯基生物科技发展有限公司,van Gieson染色试剂盒和天狼猩红染色试剂盒购自北京雷根生物技术有限公司。主要仪器为倒置显微镜(ECLIPSE TS100,Nikon,Japan)和偏振光显微镜(DM4P,Leica,Germany)。
1.3 实验方法
1.3.1 实验动物模型制作
24只大鼠根据染色方法随机分为4组,每组6只。大鼠使用10%水合氯醛麻醉后打开腹腔,找到“Y”型子宫,左侧子宫切开后暴露宫腔,用刀片对子宫内膜进行搔刮,直至宫腔表面有粗糙感为止,6-0线缝合子宫,逐层关腹。右侧子宫不做处理,作为对照。术后14 d取材,制作大鼠子宫组织石蜡切片。实验方案经过北京大学第一医院伦理委员会审批(编号:f201242)。
1.3.2 切片染色方法
(1)HE染色:①切片脱蜡至水;②苏木精染色3~5 min;③自来水返蓝15~30 min;④伊红染色2 min;⑤梯度酒精脱水、二甲苯透明、中性树胶封片。
(2)Masson染色:①切片脱蜡至水;②Masson复合染色液滴染5 min,蒸馏水冲掉染液;③磷钼酸染液滴染5 min,甩干;④滴加苯胺蓝染色液(或亮绿染色液)染色5 min,蒸馏水冲洗;⑤滴加分化液分化30~60 s;⑥梯度酒精脱水、二甲苯透明、封片。
(3)van Gieson染色:①切片脱蜡至水;②天青石蓝染色液染2~3 min;③水洗后Mayer苏木精染液染2~3 min;④水洗后酸性乙醇分化液分化1~2 s;⑤自来水冲洗10 min;⑥丽春红-苦味酸染液染1~2 min;⑦梯度酒精脱水、二甲苯透明、封片。
(4)天狼猩红染色:①切片脱蜡至水;②天狼猩红染色液滴染1 h,流水冲洗;③Mayer苏木素染色液染细胞核8~10 min,自来水冲洗10 min;④梯度酒精脱水、二甲苯透明、封片。
1.3.3 切片分析
所有切片在光学显微镜下观察。对于每种染色方法,每只大鼠子宫选取4个高倍镜(high power field,HPF)(× 100)视野,计算子宫内膜腺体数目(个数/HPF)和子宫内膜纤维化面积比(胶原纤维面积占总子宫内膜面积的面积比),使用Image Pro Plus 6.0进行分析。天狼猩红染色切片在偏振光显微镜下观察,以区分I型和III型胶原。
1.4 统计学方法
各染色方法的纤维化面积比和腺体计数采用t检验和方差分析进行分析,使用SPSS 22.0统计软件,P< 0.05为差异有显著性。
2 结果
2.1 HE染色
子宫组织HE染色结果显示,对照组大鼠子宫内膜上皮,腺上皮和宫腔结构可见。刮除子宫内膜后,子宫内膜上皮和宫腔结构消失,代之以大量红染的纤维组织(图1)。
2.2 Masson染色
子宫组织Masson染色中的甲苯胺蓝可将胶原纤维染成蓝色,肌纤维和腺体上皮染成红色。亮绿可将胶原纤维染成绿色,肌纤维和腺体上皮染成紫红色,细胞核为紫色。刮除子宫内膜后,子宫内膜上皮和宫腔结构消失,代之以大量蓝色或绿色的胶原纤维(图2)。Masson染色(甲苯胺蓝)对照组子宫内膜腺体数量(个数/HPF)为(10.04±0.50),刮宫后为(3.79±0.27),差异有显著性(P< 0.01);对照组纤维化面积比为(26.48±1.23)%,刮宫后的纤维化面积比为(52.06±1.46)%,差异有显著性(P< 0.01)。Masson染色(亮绿)对照组子宫内膜腺体数量(个数/HPF)为(10.25±0.55),刮宫后为(3.83±0.25),差异有显著性(P< 0.01);对照组纤维化面积比为(21.23±0.91)%,刮宫后的纤维化面积比为(47.50±1.56)%,差异有显著性(P< 0.01)。
注:A:对照组子宫,可见子宫内膜上皮和腺体,有宫腔结构,可见红染的胶原纤维;B:刮宫后子宫,子宫内膜上皮消失,宫腔结构消失,有较多红染的纤维组织。比例尺:50 μm。图1 刮宫前后子宫组织的HE染色(× 100)Note.A: Control uteri. Cavity stricture, and endometrial epithelia and glands were observed. B: Scraped uteri. Cavity stricture and endometrial epithelia were absent, with red stained fibers observed. Scale bars=50 μm.Fig.1 HE staining of uteri before and after scraping

注:A:对照组子宫Masson染色(甲苯胺蓝),子宫内膜上皮、腺体上皮、肌层均染为红色,胶原纤维为蓝色;B:刮宫后子宫组织Masson染色(甲苯胺蓝),可见子宫内膜上皮和宫腔结构消失;C:对照组子宫Masson染色(亮绿),子宫内膜上皮、腺体上皮、肌层为紫红色,细胞核为紫色,胶原纤维为绿色;D:刮宫后子宫组织Masson染色(亮绿),子宫内膜上皮和宫腔结构消失。比例尺:50 μm。图2 刮宫前后子宫组织的Masson染色(× 100)Note.A: Control uteri (toluidine blue). Endometrium, endometrial glands and muscular layers were stained red while fibers were stained blue. B: Scraped uteri (toluidine blue). Endometrial epithelia and cavity stricture were absent. C: Control uteri (light green). Endometrium, endometrial glands and muscular layers were stained purple-red, the nucleus was stained purple, and fibers stained green. D: Scraped uteri (light green). Endometrial epithelia and cavity structure were absent. Scale bars=50 μm.Fig.2 Masson staining of uteri before and after scraping
2.3 van Gieson染色
van Gieson染色结果显示,肌纤维、上皮胞质等非胶原纤维成分被染为黄色,细胞核为棕色或黑色,胶原纤维被染为红色。刮除子宫内膜后,子宫内膜上皮层消失。对照组子宫内膜腺体数量(个数/HPF)为(10.29±0.40),刮宫后为(3.71±0.25),差异有显著性(P< 0.01)。对照组纤维化面积比为(21.40±1.21)%,刮宫后的纤维化面积比为(47.49±1.54)%,差异有显著性(P< 0.01)。

注:A:对照组子宫的van Gieson染色,子宫内膜上皮、腺体上皮、肌纤维被染为黄色,细胞核为棕色或黑色,胶原纤维染为红色;B:刮宫后子宫的van Gieson染色,刮除子宫内膜后,子宫内膜上皮层消失。比例尺:50 μm。图3 刮宫前后的子宫van Gieson染色(× 100)Note.A: Control uteri. Endometrium, endometrial glands and muscular layers were stained yellow, the nucleus was stained brown or black, and fibers stained red. B: Scraped uteri. Endometrial epithelia and cavity structure were absent. Scale bars=50 μm.Fig.3 van Gieson staining of uteri before and after scarping
2.4 天狼猩红染色
天狼猩红染色结果显示,肌纤维、上皮胞质、细胞核等非胶原纤维成分被染为紫色,胶原纤维被染为红色。刮除子宫内膜后,子宫内膜上皮层消失,子宫内膜腺体数量(个数/HPF)为(10.08±0.44),刮宫后为(3.79±0.26),差异有显著性(P< 0.01);对照组纤维化面积比为(20.17±0.69)%,刮宫后的纤维化面积比为(46.88±0.92)%,差异有显著性(P< 0.01)。偏振光显微镜下,I型胶原呈亮红色或强橙黄色,III型胶原呈绿色。对照组I型胶原在子宫组织中所占的面积比为(11.88±0.70)%,刮宫组为(32.68±1.17)%;对照组III型胶原在子宫组织中所占的面积比为(8.65±0.37)%,刮宫组为(17.32±0.69)%。差异均有显著性(P< 0.01)(图4)。
本研究的各种染色方法中,Masson染色(亮绿)、van Gieson染色、天狼猩红染色计算出的对照组和刮宫组纤维化面积比均无明显差异(P> 0.05),但均显著低于Masson染色(甲苯胺蓝)(P< 0.01)。
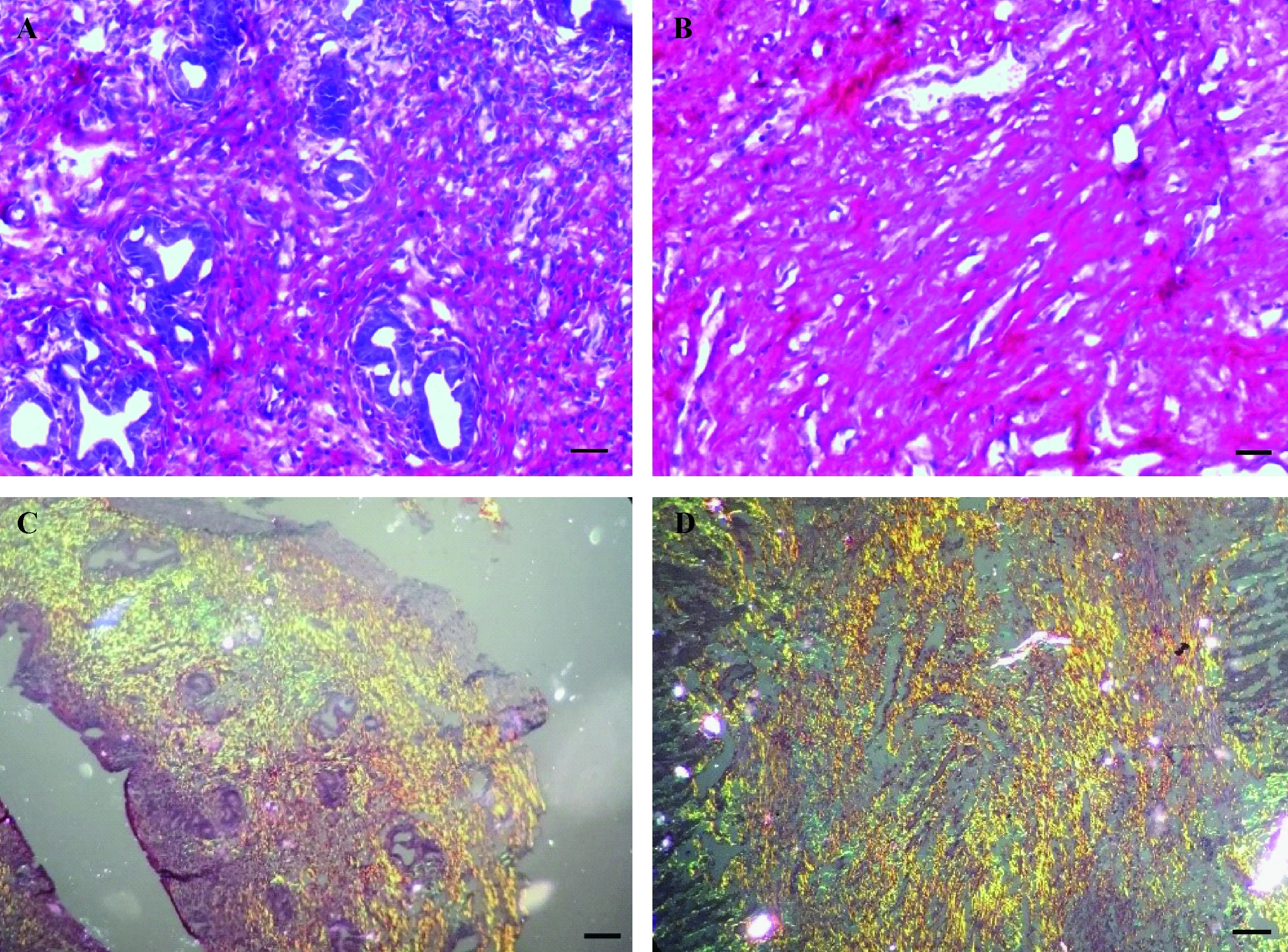
注:A:对照组子宫的天狼猩红染色,肌纤维、子宫内膜上皮、腺体上皮、肌层、细胞核被染为紫色,胶原纤维被染为红色;B:刮宫后子宫的天狼猩红染色,刮除子宫内膜后,子宫内膜上皮层消失;C,D:对照组(C)和刮宫后(D)子宫偏振光显微镜镜下图,可见亮红色或强橙黄色的I型胶原和绿色的III型胶原。比例尺:50 μm。图4 刮宫前后子宫组织的天狼猩红染色(× 100)Note: A: Control uteri. Endometrium, endometrial glands, muscular layers, and the nucleus were stained purple while fibers were stained red. B: Scraped uteri. Endometrial epithelia and cavity structure were absent. C, D: Control uteri (C) and scraped uteri (D) under polarized light microscopy. Collagen type I ranged from orange to red, while collagen type III ranged from green to yellow. Scale bars=50 μm.Fig.4 Sirius red staining of uteri before and after scarping
3 讨论
宫腔粘连的主要病理变化是子宫内膜组织的瘢痕修复及纤维化,异常增生的胶原纤维填塞宫腔。HE染色是最基本的组织学染色方法,但是其只能显示最基本的病理变化,纤维组织为红色,但是没有特异性。胶原纤维含有碱性氨基酸,能与酸性染料进行结合而着色。Masson染色、van Gieson染色以及天狼猩红染色都是利用此特点对胶原纤维着色。目前,上述染色方法主要用于各种纤维化疾病的研究中。
Masson染色法是经典的显示结缔组织的三色染色方法,光镜下胶原纤维呈蓝色(甲苯胺蓝)或绿色(亮绿),肌纤维、红细胞被丽春红染成红色。由于操作步骤较为复杂,因此实际染色过程中,染色影响因素较多。Masson染色镜下细胞核可以表现为黑色、褐色或蓝色。因此,如果用甲苯胺蓝染胶原纤维,在图像分析时,容易将细胞核所在区域计入胶原纤维中,容易产生胶原纤维“过染”的假象,造成分析误差[1],而使用亮绿染胶原纤维则不会出现此现象,因此从该角度来看,亮绿可能比甲苯胺蓝更适合染胶原纤维[2]。
van Gieson染色也是一种经典的胶原纤维染色方法。该法使用丽春红将胶原纤维染为红色,苦味酸将其他肌纤维等非胶原纤维部位染成黄色,天青石蓝和苏木精将细胞核染为紫色,因此在光镜下较容易区分胶原纤维,计算纤维化面积时与Masson(亮绿)染色和天狼猩红染色相比并无明显差异,是一种较好的胶原纤维染色方法。
天狼猩红是一种阴离子强酸性染料,每个分子内含有6个磺酸基,容易与胶原纤维中的碱性基团结合。天狼猩红又是一种长形展开的分子,与胶原分子吸附后极稳定,染色后不易褪色。在普通光镜下能使胶原纤维染成红色,而非胶原纤维部分不见红色背景。在偏振光显微镜下观察,胶原纤维有正的单轴双折射光的属性,与天狼猩红染液结合后,可增强双折射,提高分辨率。在正常的子宫组织中,主要分布I型和III型胶原。在纤维化过程中,各种胶原纤维的量和构成比会发生显著的改变,而这种改变与纤维化的程度密切相关。在纤维化过程中,I型和III型是主要参与的胶原纤维,其表达都增高[3 - 4]。在偏振光显微镜下,I型胶原显示出很强的双折光性,为亮红色或强橙黄色;III型胶原双折光性弱,为绿色,借此在镜下可区分I型和III型胶原并使用图像分析软件进行定量分析[5]。虽然I型和III型胶原也可以通过其他方法如免疫组织化学、蛋白印迹法、聚合酶链反应等方法检测,但所用抗体昂贵,操作繁琐费时。天狼猩红染色法则更为直观、快捷、经济。此外,本研究中使用的Mayer苏木素染液,可将细胞核染为紫色,使染色更为清晰,并避免将细胞核染色计入胶原纤维中计算纤维化面积比。
天狼猩红染色也有其他证据证实其比Masson染色效果更好。在一项肝纤维化研究中发现,天狼猩红能够显示肝小叶周围含量很小的胶原纤维,而Masson染色不能。该研究中同时发现天狼猩红染色计算出的纤维化面积比也小于Masson染色的纤维化面积比,提示天狼猩红染色对胶原纤维有更好的特异性[1]。在关于肾脏、心脏、肝脏纤维化的研究中,也有研究发现天狼猩红染色法和Masson染色
法虽然都能显示胶原纤维,但天狼猩红染色能进一步区分胶原类型[6 - 9]。
在天狼猩红染色过程中,也可以通过其他方法改进染色效果。如将天狼猩红溶于饱和苦味酸溶液中并用乙醇分色,以降低背景染色,提高染色效率,使胶原纤维显色更为清晰。也有报道在苦味酸-天狼猩红染色液基础上加入亮绿染色液后染色效果更强,对比更明显[10]。
综上所述,Masson染色法、van Gieson染色法在光镜下也可用于观察宫腔粘连组织中的胶原纤维及分布特征,但天狼猩红染色法较Masson和van Gieson染色法不仅能够反映宫腔粘连组织纤维化的分布,还在胶原纤维的分型中发挥重要作用。所以在实际工作中,天狼猩红染色法具有更大的优势。
参考文献:
[1] Huang Y, de Boer WB, Adams LA, et al. Image analysis of liver collagen using sirius red is more accurate and correlates better with serum fibrosis markers than trichrome [J]. Liver Int, 2013, 33(8): 1249-1256.
[2] 魏胜男, 曾翔俊, 李汇华. 小鼠肾脏纤维化Masson染色方法的改进 [J]. 解剖学报, 2013, 44(4): 576-579.
[3] Zhu Y, Hu J, Yu T, et al. High molecular weight hyaluronic acid inhibits fibrosis of endometrium [J]. Med Sci Monit, 2016, 22: 3438-3445.
[4] Li J, Cen B, Chen S, et al. MicroRNA-29b inhibits TGF-β1-induced fibrosis via regulation of the TGF-β1/Smad pathway in primary human endometrial stromal cells [J]. Mol Med Rep, 2016, 13(5): 4229-4237.
[5] Rittié L. Method for picrosirius red-polarization detection of collagen fibers in tissue sections [J]. Methods Mol Biol, 2017, 1627: 395-407.
[6] 黄波, 肖影群, 钟青梅, 等. 苦味酸-天狼猩红偏振光法在肝纤维化研究中的应用 [J]. 现代诊断与治疗, 2015, 26(20): 4569-4572.
[7] 张哲, 王伟, 商建峰, 等. 胶原纤维特殊染色法在心肌纤维化诊断中的应用比较 [J]. 诊断病理学杂志, 2016, 23(8): 578-580.
[8] 沈蔷, 陈莉, 李昊, 等. 苦味酸-天狼猩红染色和MASSON染色评价心脏纤维化的比较 [J]. 中国分子心脏病学杂志, 2012, 12(2): 118-120.
[9] 罗灿峤, 莫木琼, 钟觉民. 天狼星红苦味酸染色法和MASSON染色法在显示大鼠肾脏胶原纤维的比较应用 [J]. 临床医学工程, 2009, 16(8): 15-16.
[10] Cristina S, Chiara I, Luca A, et al. Histochemical detection of collagen fibers by Sirius Red/Fast Green is more sensitive than van Gieson or Sirius Red alone in normal and inflamed rat colon [J]. PLoS One, 2015, 10(12): e0144630.

