Sestrin2在吸烟诱导的肺泡Ⅱ型上皮细胞损伤中的作用机制
姜晓亮,刘 雪,刘云鹏,付 慧,刘 星,杨志伟(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
吸烟是严重危害公共健康的重大问题,也是导致支气管肺癌和慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)等疾病发展的重要病因之一[1]。香烟烟雾(cigarette smoke,CS)含有多种复杂的化学物质,包括大量的自由基以及高浓度的氧化剂[2]。香烟烟雾中自由基的吸入可导致氧化应激反应,直接损伤肺泡上皮细胞,是诱发肺损伤的第一步[3]。肺泡II型上皮细胞(alveolar type II epithelial cells,AT-II)是肺泡上皮的干细胞[4],它的损伤参与了多种慢性气道疾病的发展,导致不良预后的发生[5 - 6]。因此,保护AT-II细胞免受香烟烟雾的伤害,在多种与吸烟相关肺病的治疗中有重要意义。
Sestrin2是抗氧化蛋白Sestrin家族的重要成员[7],它可缓解糖尿病代谢异常、心血管疾病等导致的氧化应激损伤[8 - 9],近年来被认为是一种高效的安全生物制剂。Sestrin2通过抑制过氧化物酶(Prx-SO2/3H)的超氧化,降低细胞内活性氧(reactive oxygen species,ROS)水平[10],从而发挥抗氧化作用,可能参与吸烟诱导的AT-II细胞损伤的发生发展,然而肺泡上皮细胞受到烟雾刺激损伤时Sestrin2的作用机制仍然不是很清楚。因此,该研究以肺泡II型上皮细胞为靶细胞,从而对Sestrin2在香烟烟雾诱导的AT-II细胞损伤中的作用机制进行初步探讨。
1 材料和方法
1.1 实验材料
人A549细胞株(肺泡Ⅱ型上皮细胞来源)购自美国培养物保存中心(ATCC,编号:CRM-CCL-185)。
1.2 主要试剂与仪器
1640培养基购于Gibco公司;胎牛血清(fetal bovine serum,FBS)和双抗以及Lipofectamine TM2000购自Invitrogen公司;Sestrin2抗体、GAPDH抗体购自Cell Signaling Technology公司;peroxiredoxin-Cys和peroxiredoxin-SO3抗体购自Abcam公司;Sestrin2 siRNA和non-silencing siRNA购自Thermo Scientific公司;2’, 7’-二氯荧光素二乙酸酯(2’, 7’-dichlorodihydrofluorescein diacetate,DCFDA)购自Molecular Probes公司;羰酰氰基对氯苯脘购自Sigma公司;山羊抗兔/鼠二抗购自北京中山金桥公司;TNF-α和IL-8检测ELISA试剂盒购自上海信帆生物有限公司。电泳仪(北京六一仪器厂,DYY-C);电泳槽(上海天能,VE-180);电转槽(上海天能,VE-186);多功能酶标仪(Multiskan GO);化学发光凝胶成像仪(Tanon-5500);正向显微镜(Leica DM6000 B);低温高速离心机(Beckman)。
1.3 实验方法
1.3.1 细胞培养和实验分组
将A549细胞用含10% FBS的1640培养基,置于37℃、5% CO2的培养箱中培养。取指数生长期细胞接种于相应的培养皿中长至约70%~80%,实验前需换无血清的培养基培养2~4 h然后用于实验。然后将A549细胞分为八组:对照组、香烟烟雾提取物(cigarette smoke extract,CSE)处理组(10%,24 h)、阿奇霉素(azithromycin,AZM)处理组(5 μg/mL,24 h)、CSE +阿奇霉素处理组、转染non-silencing siRNA组(10 nmol/L,48 h)、转染Sestrin2 siRNA组(10 nmol/L,48 h)、转染non-silencing siRNA +阿奇霉素处理组和转染Sestrin2 siRNA +阿奇霉素处理组。
1.3.2 香烟烟雾提取物(CSE)的制备
参照Carp等[11]的方法,将两支香烟去掉滤嘴后燃烧,由50 mL注射器负压吸引装置(改造)连续匀速抽吸(50 mL/min),该装置将烟雾吸入10 mL的1640培养基中,香烟在15 min内需要燃烧完毕,然后充分摇动使其溶解制成悬液,并用1 mol/L氢氧化钠(NaOH)将pH调至7.2~7.4,最后用0.22 μm孔径的滤器(Millipore,Watford,UK)过滤,除去细菌和杂质。制备好的CSE原液用不含血清的1640培养基稀释10倍[12],浓度用百分数表示(10%),在30 min内用于实验。
1.3.3 A549细胞Sestrin2基因沉默
A549细胞在6孔培养皿中培养24 h,细胞密度达到每孔2 × 105个。按照说明书的步骤,使用Lipofectamine TM2000将Sestrin2 siRNA(10 nmol/L)转入到A549细胞中,non-silencing siRNA作为阴性对照。转染48 h后更换新鲜的培养基(含10% FBS),用免疫印迹法检测细胞中Sestrin2的表达。
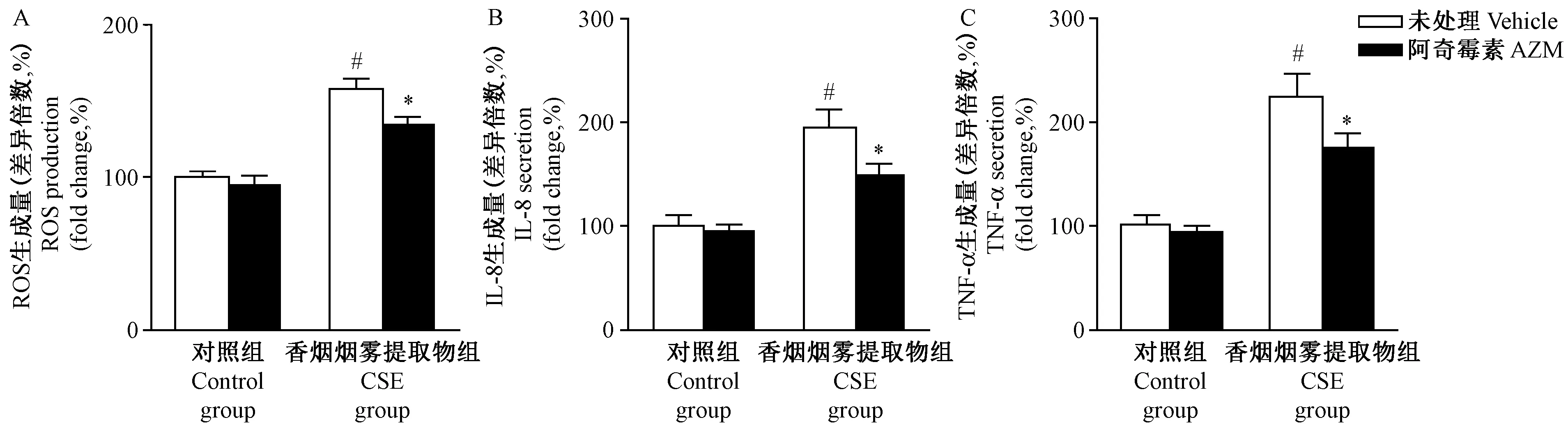
注:与对照组相比,# P< 0.05;与未进行阿奇霉素处理的香烟烟雾提取物组相比,* P< 0.05。图1 香烟烟雾提取物对肺泡上皮细胞ROS和细胞因子的影响Note.Compared with the control group,#P< 0.05. Compared with the CSE group without AZM treatment, *P< 0.05.Fig.1 Effects of cigarette smoke extract on ROS production and the secretion of cytokines in the pulmonary alveolar epithelial A549 cells
1.3.4 Western blot检测蛋白表达
用细胞刮收集各组处理后的细胞,放置到蛋白裂解液中制备总蛋白样本,BCA法测蛋白浓度并调整一致。每个样本取30 μg上样进行SDS-PAGE电泳,转膜,脱脂奶粉常温封闭1 h,抗体稀释液将不同抗体按比例稀释:抗Sestrin2(1∶500)、peroxiredoxin-Cys(1∶1000)、peroxiredoxin-SO3(1∶200)和GAPDH一抗,放置于4℃冰箱孵育过夜,再次洗膜,室温下孵育二抗(1∶5000,1 h),洗膜后使用化学发光试剂显色,NC膜扫描保存并定量分析。
1.3.5 炎症因子水平检测
取实验各组细胞上清液,ELISA方法检测细胞上清液TNF-α和IL-8的水平,所有实验操作均严格按照ELISA试剂盒使用说明书进行,并设定实验平行组,最终使用酶标仪读数并分析。
1.3.6 细胞内ROS水平检测
细胞内ROS水平采用DCFDA荧光探针进行检测。药物处理的细胞使用无血清的1640培养基洗1次后,加入10 μmol/L DCFDA于37℃孵育30 min,羰酰氰基对氯苯脘作阳性对照。使用微板阅读器在485 nm的激发波长和530 nm的发射波长上测量DCFDA荧光并计算ROS的阳性率。
1.4 统计学方法

2 结果
2.1 香烟烟雾提取物诱导肺泡上皮细胞发生氧化应激
已有研究证实氧化应激是香烟烟雾的主要致病因子[12],本研究采用香烟烟雾提取物(CSE,10%)处理肺泡上皮细胞24 h。研究发现CSE组细胞ROS产量较对照组显著升高(P< 0.05,图1A),细胞分泌的TNF-α和IL-8显著增多(P< 0.05,图1B和1C)。研究证实在A549细胞中,阿奇霉素能够抑制CSE诱导的氧化应激损伤[13],因此本研究在CSE处理的基础上同时给予阿奇霉素(AZM,5 μg/mL)。如图1所示,AZM能够显著缓解CSE诱导的ROS产生,细胞分泌的TNF-α和IL-8等炎症因子较未进行阿奇霉素处理的CSE组亦显著减少。
2.2 Sestrin2在肺泡上皮细胞氧化应激中的作用
图2A显示,CSE处理A549细胞后抗氧化蛋白Sestrin2的表达较对照组显著降低[(71±7.2)%比(100±8.7)%,P< 0.05],该结果显示Sestrin2可能通过其抗氧化作用参与了吸烟诱导的COPD。为证实Sestrin2在COPD中的重要作用,本研究给予肺泡上皮细胞Sestrin2 siRNA(10 nmol/L)处理。48 h后检测Sestrin2蛋白表达显著降低[(50±8.9)%比(100±10)%,图2B]。Sestrin2 siRNA沉默组细胞的ROS的产量较对照组显著升高(P< 0.05,图3 A),炎症因子TNF-α和IL-8的水平显著增加(P< 0.05,图3B和3C)。但给予Sestrin2 siRNA组阿奇霉素,发现升高的ROS并没有显著降低,Sestrin2 siRNA沉默后使得阿奇霉素的抗氧化作用效果减弱。该结果证实了Sestrin2在肺泡上皮细胞中重要的抗氧化作用,同时显示阿奇霉素能够直接或者间接通过Sestrin2发挥其抗氧化功能。
2.3 Sestrin2通过抑制Prx-SO2/3的超氧化参与肺泡上皮细胞氧化应激的机制
Sestrin2能够抑制过氧化物酶的超氧化从而抑制ROS的产生[10]。过氧化物酶是一种以硫为基础的抗氧化酶,它通过两对半胱氨酸的氧化(Prx-SO2/3),导致过氧化物酶活性的失活[14]。为探索肺泡上皮细胞中Sestrin2对过氧化物酶的调节作用,本研究检测了peroxiredoxin-SO3(Prx-SO2/3)和总peroxiredoxin-Cys(Prx-2Cys)蛋白的表达,计算二者的比率。如图4 A所示,CSE处理A549细胞后Prx-SO2/3表达较对照组显著增加[(232±8.1)%比(100±4.6)%,P< 0.05]而总Prx-2Cys不变,加入AZM能够显著减少CSE诱导的Prx-SO2/3超氧化[(171±13)%比(232±8.1)%,P< 0.05]。Sestrin2 siRNA同样能够诱导Prx-SO2/3超氧化[(156±9.1)%比(100±5.1)%,P< 0.05],但Sestrin2 siRNA沉默后再给予AZM并不能减少Prx-SO2/3的超氧化[(148±7.9)%比(156±9.1)%,图4B]。证实A549细胞中Sestrin2通过抑制Prx-SO2/3的超氧化,从而抑制过氧化物酶的失活以及ROS产生,可能成为COPD抗氧化治疗的重要机制。

注:与对照组相比,# P< 0.05;与未进行阿奇霉素处理的香烟烟雾提取物组相比,* P< 0.05;与未沉默组相比,& P< 0.05。图2 Sestrin2在肺泡上皮细胞中的表达Note.Compared with the control group,#P< 0.05. Compared with the CSE group without AZM treatment, *P< 0.05. Compared with the non-silencing siRNA group, &P< 0.05.Fig.2 Expression of Sestrin2 in the pulmonary alveolar epithelial A549 cells

注:与未沉默组相比,& P< 0.05。图3 Sestrin2 siRNA对肺泡上皮细胞ROS和细胞因子的影响Note.Compared with the non-silencing siRNA group, &P< 0.05.Fig.3 Effects of Sestrin2 siRNA on ROS production and secretion of cytokines in the pulmonary alveolar epithelial A549 cells

注:与对照组相比,# P< 0.05;与未进行阿奇霉素处理的香烟烟雾提取物组相比,* P< 0.05;与未进行阿奇霉素处理的未沉默组相比,& P< 0.05。图4 Prx-SO2/3和Prx-Cys在肺泡上皮细胞中的表达Note.Compared with the control group,#P< 0.05. Compare with the CSE group without AZM treatment, *P< 0.05. Compared with the non-silencing siRNA group without AZM treatment,&P< 0.05.Fig.4 Expression of Prx-SO2/3 and Prx-Cys in the pulmonary alveolar epithelial A549 cells
3 讨论
吸烟是导致肺内呼吸障碍的主要病因,包括慢性阻塞性肺疾病和特发性肺纤维化[15],其特征是肺泡上皮细胞的不可逆损伤。香烟烟雾(CS)是活性氧的丰富来源,氧化应激损伤是香烟烟雾的主要致病因子[12]。香烟烟雾的化学成分复杂,在本研究中,香烟烟雾提取物(CSE)被用于模拟香烟烟雾。在肺的各种细胞类型中,肺泡上皮细胞是氧化损伤的主要部位之一。与I型肺泡细胞(ATI)相比,肺泡Ⅱ型上皮细胞(ATII)在肺内的免疫反应中发挥着重要作用,它可以分泌多种细胞因子和趋化因子对呼吸刺激引起的慢性阻塞性肺疾病等慢性肺病的发展起重要作用[16]。本实验选用的人A549细胞系来源于肺泡Ⅱ型上皮细胞,其脂质转运体和补体系统与原代培养的ATII细胞具有显著相似性,作为ATII细胞生理模型广泛应用[17]。通过给予A549细胞香烟烟雾提取物(CSE)干预,本研究发现抗氧化蛋白Sestrin2能够抑制过氧化物酶Prx-SO2/3超氧化,从而阻断肺泡细胞内活性氧(ROS)的过度生成并抑制炎症因子分泌增多,可能成为吸烟诱导肺泡II型上皮细胞损伤及吸烟相关肺病治疗的新靶点。
Sestrins蛋白是一类保守的应激诱导型抗氧化蛋白,在氧化应激和DNA损伤时表达上调[9]。哺乳动物的Sestrins家族成员主要包括:Sestrin1、Sestrin2和Sestrin3。Sestrin2是Sestrins家族中的重要成员,它是p53的转录调控底物分子[18]。Sestrin2能通过抑制细胞内ROS生成而发挥抗氧化作用,对抗糖尿病代谢异常、心血管疾病等导致的氧化应激损伤,近年来被广泛研究[8 - 9]。本研究证明在A549细胞中CSE可诱导Sestrin2表达抑制和ROS的大量生成,而同时给予阿奇霉素能够有效缓解ROS的增多,并且使得Sestrin2表达增加。Barnes[19]在2013年提出了香烟烟雾通过氧化应激诱导慢性阻塞性肺疾病的过程。文章指出ROS通过激活NF-κB和p38 MAPK,从而导致促炎、炎性细胞因子和趋化因子基因的激活,进而加速肺损伤和慢性阻塞性肺疾病的发展[20]。TNF-α、IL-8是参与慢性气道性疾病炎症反应的重要促炎因子[21],通过诱发气道、肺实质以及肺部血管的慢性炎症反应最终导致肺结构的破坏。因此本研究也检测了Sestrin2对于炎症因子TNF-α和IL-8水平的影响。发现给予A549细胞Sestrin2 siRNA之后ROS的生成增多,TNF-α和IL-8的水平显著升高,但同时给予阿奇霉素无法降低ROS的生成,也不能缓解TNF-α和IL-8的升高,证实了抗氧化蛋白Sestrin2在肺泡II型上皮细胞氧化应激损伤以及炎症反应中的重要作用。
研究表明Sestrin2可抑制过氧化物酶(Prx-SO2/3)的超氧化,清除细胞内的H2O2从而维持细胞内的氧化还原稳态[22]。为探索Sestrin2的作用机制,本研究用Sestrin2 siRNA沉默处理A549细胞,发现Sestrin2 siRNA组细胞中超氧化的Prx-SO2/3增多而总蛋白Prx-2Cys表达不变。Yang等[10]发现在肾脏中Sestrin2能够抑制过氧化物酶(Prx-SO2/3)的超氧化,并且激活PON2信号通路参与了多巴胺D2受体诱导的ROS生成的阻断。Woo等[23]也指出抑制Prx-2Cys的超氧化和Sestrin2对氧化应激的调节作用相似。本研究则证实在肺泡上皮细胞中Sestrin2通过抑制下游Prx-SO2/3的超氧化从而参与ROS的生成以及减少氧化应激。另外本研究额外给予Sestrin2 siRNA组的细胞阿奇霉素处理,发现氧化应激损伤并不能够缓解。该结果再次证实了Sestrin2以及下游过氧化物酶在肺泡上皮细胞中的重要作用。Sestrin2也可通过多种机制参与ROS生成的调控,它通过下游信号通路在多种病理生理现象中发挥重要作用。研究发现Sestrin2能够激活AMPK/mTORC1信号通路从而抑制ROS的生成并诱导细胞凋亡,被认为结肠直肠癌的新靶点[24]。在肾小球系膜细胞中Sestrin2能够激活AMPK通路参与阻断NOX4依赖的ROS生成[25]。另一项研究发现,选择性降低Sestrin2的表达可激活下游mTORC1-S6K信号通路,从而导致胰岛素抵抗、葡萄糖耐受不良并出现肥胖等一系列代谢病症[26]。
综上所述,Sestrin2能够抑制过氧化物酶(Prx-SO2/3)的超氧化阻断ROS的多度产生,在香烟烟雾诱导的肺泡II型上皮细胞损伤中起到重要的保护作用,可能为吸烟相关肺病的防治提供新思路。然而Sestrin2还能够通过哪些信号途径和相关机制来抑制香烟诱导的肺泡II型上皮细胞损伤目前尚不得知。此外是否有其他抗氧化或抗炎分子在这一过程中协同作用也不明确,还需要进一步探索研究。
参考文献:
[1] Hartman TE, Tazelaar HD, Swensen SJ, et al. Cigarette smoking: CT and pathologic findings of associated pulmonary diseases [J]. RadioGraphics, 1997, 2(17): 377-390.
[2] Perfetti TA, Rodgman A. The complexity of tobacco and tobacco smoke [J]. Contrib Tob Res, 2011, 24(11): 215-232.
[3] Van Driessche W, Kreindler JL, Malik AB, et al. Interrelations/cross talk between transcellular transport function and paracellular tight junctional properties in lung epithelial and endothelial barriers [J]. Am J Physiol Lung Cell Mol Physiol, 2007, 293(3): L520-L524.
[4] 朱召浩, 朱嘉羚, 戚薇岩, 等. 肺泡上皮细胞的研究进展 [J]. 药物生物技术, 2017, 24(2): 159-162.
[5] 何志义, 冉丕鑫, 钟南山. 氧化/抗氧化失衡与慢性阻塞性肺疾病 [J]. 国外医学呼吸系统分册, 2003, 23(1): 5-7.
[6] 张莉, 许建英. 香烟烟雾暴露对大鼠支气管肺泡灌洗液及外周血4-HNE和γ-GCS表达的影响 [J]. 中国比较医学杂志, 2012, 22(2): 43-46.
[7] Liu SY, Lee YJ, Lee TC. Association of platelet-derived growth factor receptor β accumulation with increased oxidative stress and cellular injury in sestrin 2 silenced human glioblastoma cells [J]. FEBS Lett, 2011, 585(12): 1853-1858.
[8] Morrison A, Chen L, Wang J, et al. Sestrin2 promotes LKB1-mediated AMPK activation in the ischemic heart [J]. FASEB J, 2015, 29(2): 408-417.
[9] 胡永亮, 谭启杏, 王红丽, 等. Sestrin2通过抑制砷化物诱导的氧化应激反应发挥拮抗细胞凋亡的保护性作用 [J]. 生物技术通讯, 2016, 27(3): 314-317.
[10] Yang Y, Cuevas S, Yang S, et al. Sestrin2 decreases renal oxidative stress, lowers blood pressure, and mediates dopamine D2 receptor-induced inhibition of reactive oxygen species production [J]. Hypertension, 2014, 64(4): 825-832.
[11] Carp H, Janoff A. Possible mechanisms of emphysema in smokers.Invitrosuppression of serum elastase-inhibitory capacity by fresh cigarette smoke and its prevention by antioxidants [J]. Am Rev Respir Dis, 1978, 118(3): 617-621.
[12] Faux SP, Tai T, Thorne D, et al. The role of oxidative stress in the biological responses of lung epithelial cells to cigarette smoke [J]. Biomarkers, 2009, 14(Suppl 1): 90-96.
[13] Chen M, Yang T, Meng X, et al. Azithromycin attenuates cigarette smoke extract-induced oxidative stress injury in human alveolar epithelial cells [J]. Mol Med Rep, 2015, 11(5): 3414-3422.
[14] Thamsen M, Kumsta C, Li F, et al. Is overoxidation of peroxiredoxin physiologically significant? [J]. Antioxid Redox Signal, 2011, 14(4): 725-730.
[15] Chen ZH, Kim HP, Sciurba FC, et al. Egr-1 regulates autophagy in cigarette smoke-induced chronic obstructive pulmonary disease [J]. PLoS One, 2008, 3(10): e3316.
[16] Olivera D, Knall C, Boggs S, et al. Cytoskeletal modulation and tyrosine phosphorylation of tight junction proteins are associated with mainstream cigarette smoke-induced permeability of airway epithelium [J]. Exp Toxicol Pathol, 2010, 62(5): 133-143.
[17] Cooper JR, Abdullatif MB, Burnett EC, et al. Long term culture of the A549 cancer cell line promotes multilamellar body formation and differentiation towards an alveolar type II pneumocyte phenotype [J]. PLoS One, 2016, 11(10): e0164438.
[18] Deng W, Cha J, Yuan J, et al. p53 coordinates decidual sestrin 2/AMPK/mTORC1 signaling to govern parturition timing [J]. J Clin Invest, 2016, 126(8): 2941-2954.
[19] Barnes PJ. New anti-inflammatory targets for chronic obstructive pulmonary disease [J]. Nat Rev Drug Discov, 2013, 12(7): 543-559.
[20] 孙得胜, 欧阳瑶, 顾延会, 等. 慢阻肺大鼠肺组织中树突状细胞表面因子的表达变化及CCL20抗体的干预作用 [J]. 中国比较医学杂志, 2016, 26(3): 11-15.
[21] 王立婧, 闫亮. 吸烟对COPD患者肺功能及IL-8和TNF-α的影响 [J]. 医学综述, 2014, 20(24): 4606-4607.
[22] Shin BY, Jin SH, Cho IJ, et al. Nrf2-ARE pathway regulates induction of Sestrin-2 expression [J]. Free Radic Biol Med, 2012, 53(4): 834-841.
[23] Woo HA, Bae SH, Park S, et al. Sestrin 2 is not a reductase for cysteine sulfinic acid of peroxiredoxins [J]. Antioxid Redox Signal, 2009, 11(4): 739-745.
[24] Wei JL, Fang M, Fu ZX, et al. Sestrin 2 suppresses cells proliferation through AMPK/mTORC1 pathway activation in colorectal cancer [J]. Oncotarget, 2017, 8(30): 49318-49328.
[25] Eid AA, Lee DY, Roman LJ, et al. Sestrin 2 and AMPK connect hyperglycemia to Nox4-dependent endothelial nitric oxide synthase uncoupling and matrix protein expression [J]. Mol Cell Biol, 2013, 33(17): 3439-3460.
[26] Lee JH, Budanov AV, Talukdar S, et al. Maintenance of metabolic homeostasis by Sestrin2 and Sestrin3 [J]. Cell Metab, 2012, 16(3): 311-321.

