白蛋白结合型紫杉醇一线治疗40例晚期肺鳞癌的观察
肺鳞癌又称肺鳞状上皮细胞癌,是肺癌最常见的类型之一,占原发性肺癌的40%~51%。肺鳞癌多见于老年吸烟男性,大多数患者就诊时已属晚期(Ⅲb~Ⅳ期),且40%的患者确诊时年龄超过70岁,是一种病死率非常高的肿瘤[1]。目前,90%的肺鳞癌对酪氨酸激酶抑制剂(TKI)不敏感,故老年晚期肺鳞癌的标准治疗仍是以第3代化疗药物多西他赛、紫杉醇、吉西他滨、长春瑞滨单药或者联合铂类双药治疗,但其无论是在提高有效率还是延长生存期方面,均未显示出明显的优势,且不良反应大,患者耐受差[2,3]。因此,如何安全而有效地治疗老年晚期肺鳞癌是目前临床医生所面临的棘手问题。
Socinski等[4]报道的白蛋白结合型紫杉醇(NABP)联合卡铂治疗一线晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的Ⅲ期临床试验显示,与传统的紫杉醇联合卡铂相比,NAB-P联合卡铂治疗的客观缓解率(objective response rate,ORR)更高;且亚组显示,肺鳞癌患者中NAB-P联合卡铂方案的ORR较紫杉醇联合卡铂方案提高了67%(41%vs.24%,P<0.001),同时研究发现年龄≥70岁的NSCLC患者中NAB-P联合卡铂方案的总生存期(overall survival,OS)明显高于紫杉醇联合卡铂组(19.9个月vs.10.4个月,P=0.009)。根据上述研究,福建医科大学附属第二医院肿瘤内科开展了单药NAB-P一线治疗老年晚期肺鳞癌观察研究,现将结果报告如下。
1 材料与方法
1.1 临床资料
收集2012年12月至2015年12月福建医科大学附属第二医院肿瘤内科40例老年男性肺鳞癌患者(Ⅲb~Ⅳ期)入组,所有患者均有完整的临床和随访资料。入组病例均经病理诊断为肺鳞癌,治疗前血常规、心肝肾功能无明显化疗禁忌证,体力状况评分(performance status,ECOG)均≤2分,有可测量的临床观察病灶,经患者及患者家属同意并签署知情同意书及化疗同意书。具体资料见表1。
1.2 方法
1.2.1 治疗方案 40例老年晚期肺鳞癌患者,给予注射用NAB-P方案一线化疗,具体化疗方案为:NAB-P(美国阿博利斯生物科学公司)单药260 mg/m2,静脉滴注(无需特殊预处理),第1天,21天为1个周期;2个周期后评价疗效。如果出现美国国立癌症研究所常见毒性分级标准评价(NCI CTC3.0)规定的Ⅲ~Ⅳ度化疗不良反应,则下次化疗药物剂量调整至上一个周期剂量的75%。
1.2.2 评价标准 按照RECIST 1.1实体瘤疗效评价标准进行疗效评价,分为完全缓解(complete remission,CR),部分缓解(partial remission,PR),稳定(stable disease,SD)和进展(progression disease,PD);ORR为(CR+PR)/可评价病例数,疾病控制率(disease control rate,DCR)为(CR+PR+SD)/可评价病例数。无进展生存期(progression-free survival,PFS)为CR、PR、SD、PD患者从治疗之日至肿瘤进展的时间或死亡的时间。OS为CR、PR、SD、PD患者从治疗之日至死亡的时间。化疗的不良反应按NCI CTC3.0评价。入组患者均以住院、门诊加电话形式随访,随访到患者死亡。
1.3 统计学分析
采用SPSS 19.0统计软件包进行数据分析与处理,利用Cox比例风险模型进行多因素分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 化疗近期疗效
40例患者均可评价疗效,平均每例接受4.3个周期化疗;其中CR 2例,部分缓解PR 13例,稳定SD 13例,进展PD 12例,客观缓解率(objective response rate,ORR)为37.5%,DCR为70.0%。
2.2 生存情况
40例患者均获得随访,随访时间为5~28个月。入组患者PFS为6.3个月、OS为12.6个月、1年生存率为62.5%。
2.3 不良反应
40例患者均可评价化疗不良反应,血液不良反应方面表现为白细胞细胞减少、贫血及血小板减少,大多为Ⅰ~Ⅱ级不良反应;发生Ⅲ级不良反应的患者比例为白细胞减少(2.5%),贫血(5%),血小板减少(0);无Ⅳ级不良反应。主要非血液不良反应为乏力、便秘、恶心、呕吐、肌肉酸痛、脱发,大多为Ⅰ~Ⅱ级不良反应;只有1例发生Ⅲ级乏力,4个周期化疗后未继续接受化疗;无Ⅳ级不良反应。以上大部分不良反应均在可控制范围。具体资料见表2。
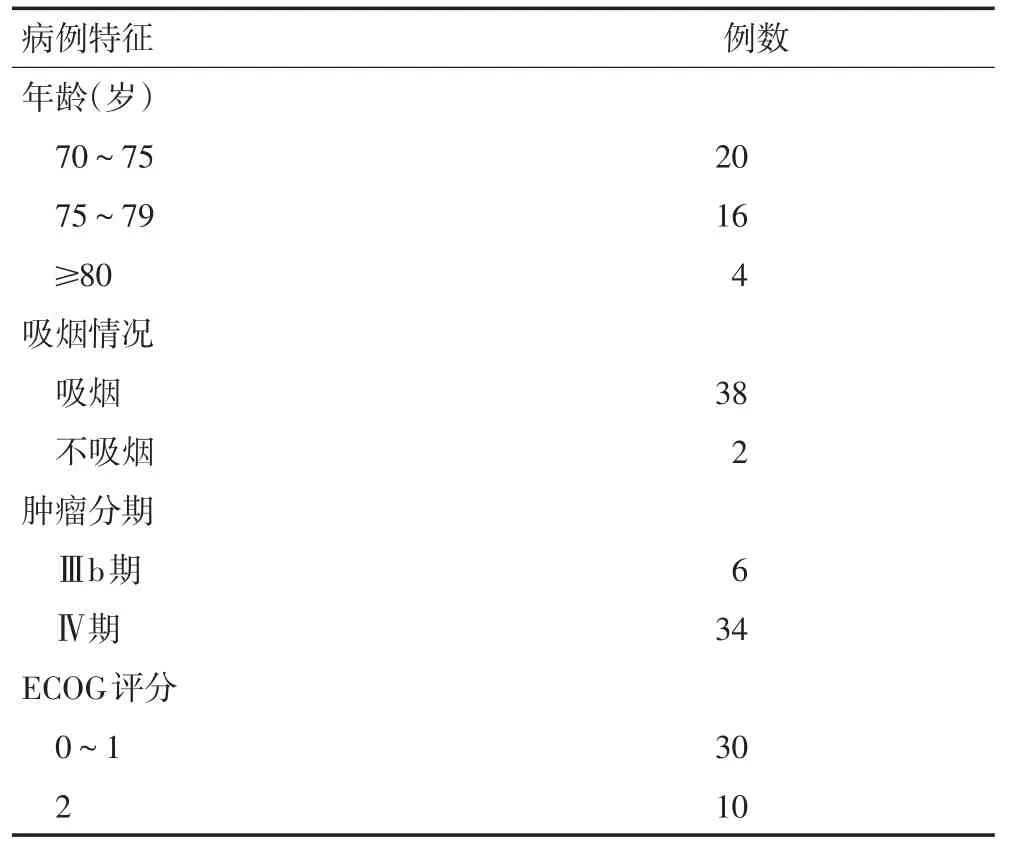
表1 患者临床资料 例
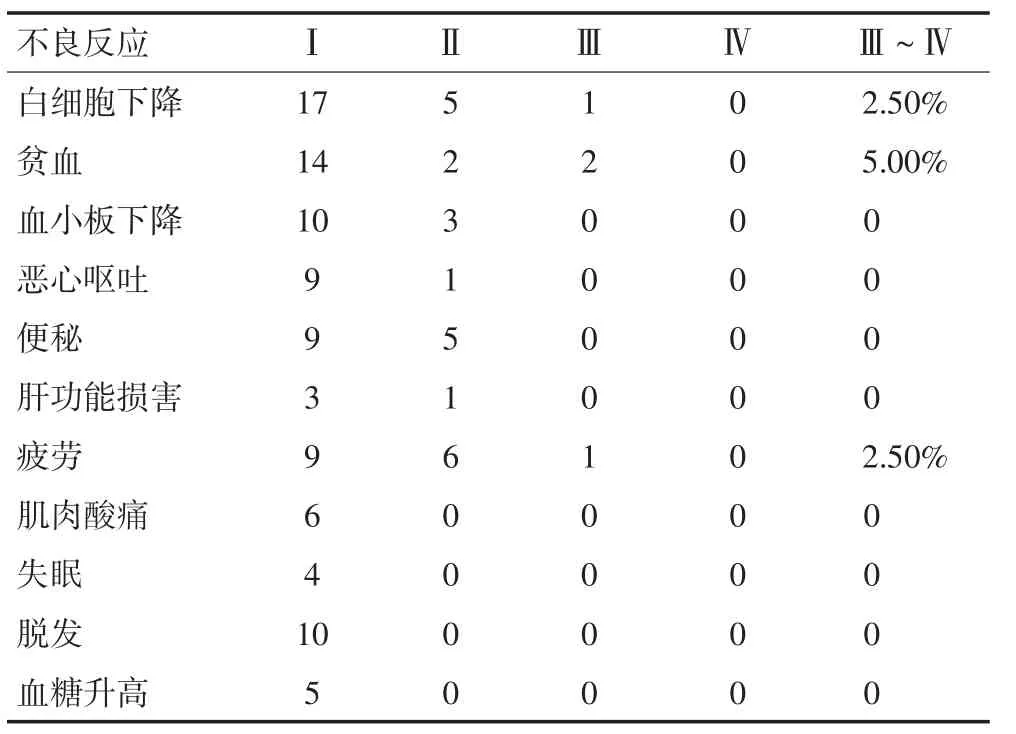
表2 评价化疗不良反应分级 例
2.4 影响预后的多因素分析
利用Cox比例风险模型进行患者预后的多因素分析结果显示,患者的分期情况、ECOG评分、有效率及PFS(是否>6个月)是影响老年患者生存的独立预后因素(P<0.05),而年龄与患者的预后无关(P>0.05,表3)。

表3 影响患者预后的多因素分析
3 讨论
老年晚期肺鳞癌患者作为一个特殊群体,基础疾病多,各项生理功能减退明显,并发症高,化疗耐受差,因此老年肺鳞癌是否化疗一直存在争议。ELVISⅢ期临床研究[5]证明了老年晚期肺鳞癌行化疗优于最佳支持治疗。对于老年晚期肺鳞癌患者采取单药还是两药化疗的问题,Gridelli等[6]进行了一项Ⅲ期临床试验,707例老年患者随机分为单药吉西他滨、单药长春瑞滨及两药联合化疗3个组,结果显示3个组患者RR、PFS、OS无明显差异,而联合用药组不良反应明显高于两单药治疗组。根据上述研究ASCO指南推荐老年晚期肺鳞癌以单药化疗为宜。
NAB-P是半合成紫杉醇类抗肿瘤化合物,其中紫杉醇是活性成分,人血白蛋白为载体,利用肿瘤组织对白蛋白代谢性摄取的高主动性,通过gp60穿胞途径,以及富含半胱氨酸的酸性分泌蛋白(SPARC)结合于肿瘤细胞外间质来增加肿瘤内外的药物浓度,提高了抗肿瘤效果[7-9];同时也避免了传统紫杉醇含有蓖麻油等有毒溶剂给患者带来的过敏等不良反应。Socinski等[4]报告了一项大型随机的Ⅲ期临床试验,1 052例初治的Ⅲb~Ⅳ期的NSCLC患者,随机接受NAB-P联合卡铂(100 mg/m2,每周1次,521例)或紫杉醇(200 mg/m2,每3周1次,531例)。结果显示,NAB-P联合卡铂组ORR显著高于紫杉醇联合卡铂组(33%vs.25%,P<0.005)。进一步的组织学亚组分析显示,对于鳞癌患者,NAB-P联合卡铂组(228例)的ORR相对于紫杉醇联合卡铂组(221例)提高了67%(41%vs.24%,P<0.001);同时研究发现年龄≥70岁的NSCLS患者中NAB-P联合卡铂方案的OS明显高于紫杉醇联合卡铂组(19.9个月vs.10.4个月,P=0.009)。根据上述临床试验,本研究选择NAB-P单药用于老年晚期肺鳞癌患者,结果NAB-P单药组ORR为37.5%,DCR为70.0%,PFS为6.3个月,OS为12.6个月,1年生存率为62.5%,Ⅲ~Ⅳ级不良反应发生率7.5%,大部分患者能够耐受不良反应。而既往Hainsworth等[10]开展多西他赛单药一线治疗老年(≥70岁)晚期NSCLC患者的Ⅱ期临床研究,其ORR为18%,DCR为62%,OS为5个月,1年生存率27%。本研究结果ORR、DCR、OS、1年生存率均好于上述多西他赛研究结果。故初步证明了NAB-P单药可一线用于老年晚期肺鳞癌患者,且安全性高,大部分患者能够耐受不良反应。有研究者认为,NAB-P在老年鳞癌患者中疗效更好,可能与其CAV1异常过表达从而导致NAB-P通过gp60-CAV1通路高浓度聚集于肿瘤内有关[7]。
本研究中还发现患者的分期情况、ECOG评分、有效率及PFS(是否≥6个月)是影响老年晚期肺鳞癌患者生存的独立预后因素,而年龄与患者的预后无明显相关性。Lilenbaum等[11]进行的一项随机对照Ⅲ期临床研究显示,70岁以上晚期肺癌患者化疗后生存率、生存质量与70岁以下的患者无明显差异。因此,对于老年晚期肺鳞癌患者,应尽早选择有效的化疗方案,在患者能够耐受不良反应的情况下,给予积极化疗,有助于延长患者的生存期,改善预后。
综上所述,单药NAB-P一线治疗老年晚期肺鳞癌的疗效较好,且具有较好的安全性。故对于体力状况差或者不耐受化疗不良反应的老年晚期肺鳞癌患者,如经济条件尚好,可优先考虑选择NAB-P一线治疗。下一步将扩大临床试验样本量,筛选有效的疗效指标,进一步对比NAB-P 3周方案与单周方案对老年晚期肺鳞癌患者疗效的差别。
[1]Gould MK.Lung cancer screening and elderly adults:do we have sufficient evidence[J]?Ann Intern Med,2014,161(9):672-673.
[2]Wang Z,Shen Z,Li Z,et al.Activation of the BMP-BMPR pathway conferred resistance to EGFR-TKIs in lung squamous cell carcinoma patients with EGFR mutations[J].Proc Natl Acad Sci U S A,2015,112(32):9990-9995.
[3]Gao Y,Gao F,Ma JL,et al.Analysis of the characteristics and prognosis of advanced non-small-cell lung cancer in older patients[J].Patient Prefer Adherence,2015,9:1189-1194.
[4]Socinski MA,Bondarenko I,Karaseva NA,et al.Weekly nab-paclitaxel in combination with carboplatin versus solvent-based paclitaxel plus carboplatin as first-line therapy in patients with advanced non-small-cell lung cancer:final results of a phaseⅢtrial[J].J Clin Oncol,2012,30(17):2055-2062.
[5]Fossella FV,Lee JS,Shin DM,et al.Phase II study of docetaxel for advanced or metastatic platinum-refractory non-small-cell lung cancer[J].J Clin Oncol,1995,13(3):645-651.
[6]Gridelli C,Perrone F,Gallo C,et al.Chemotherapy for elderly patients with advanced non-small-cell lung cancer:the Multicenter Italian Lung Cancer in the Elderly Study(MILES)phase III randomized trial[J].J Natl Cancer Inst,2003,95(5):362-372.
[7]Untch M,Jackisch C,Schneeweiss A,et al.Nab-paclitaxel versus solvent-based paclitaxel in neoadjuvant chemotherapy for early breast cancer(GeparSepto-GBG 69):a randomised,phase 3 trial[J].Lancet Oncol,2016,17(3):345-356.
[8]Lilenbaum RC,Herndon JN,List MA,et al.Single-agent versus combination chemotherapy in advanced non-small-cell lung cancer:the cancer and leukemia group B(study 9730)[J].J Clin Oncol,2005,23(1):190-196.
[9]Kim H,Samuel SL,Lopez-Casas PP,et al.SPARC independent delivery of nab-paclitaxel without depleting tumor stroma in patient-derived pancreatic cancer xenografts[J].Mol Cancer Ther,2016,15(4):680-698.
[10]Hainsworth JD,Burris HR,Litchy S,et al.Weekly docetaxel in the treatment of elderly patients with advanced nonsmall cell lung carcinoma.A Minnie Pearl Cancer Research Network PhaseⅡTrial[J].Cancer,2000,89(2):328-333.
[11]Lilenbaum RC,Herndon JN,List MA,et al.Single-agent versus combination chemotherapy in advanced non-small-cell lung cancer:the cancer and leukemia group B(study 9730)[J].J Clin Oncol,2005,23(1):190-196.

