凝血因子Ⅲ在非小细胞肺癌高凝状态患者外周血中的表达及其临床意义
肺癌是中国目前发病率和致死率最高的恶性肿瘤,根据不同肺癌生物学特性的差异,可以分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC),其中约80%的肺癌患者为NSCLC。流行病学研究显示[1-2],中国每年死于NSCLC的患者超过35万例,且发病率和死亡率依然呈现逐年上升趋势。虽然目前NSCLC发病的具体分子机制尚不明确,但研究发现中晚期NSCLC患者普遍存在高凝状态态[3-4],且静脉血栓的发生率为普通人群的4~6倍[5]。同时,近年来越来越多的研究发现[6-8],凝血功能紊乱是恶性肿瘤发病的首发临床特征之一。
凝血因子Ⅲ俗称组织因子,是人体凝血因子家族蛋白的重要成员,在人体内通过与凝血因子Ⅶ/Ⅶa结合而启动血液凝固级联反应。已有研究证实,组织因子不仅参与肺癌患者高凝状态的发生发展[9],还与癌细胞的浸润转移等有关[10],并且研究发现多个与凝血功能相关的生物标志物与癌症患者预后密切相关[11-12]。本研究通过检测74例NSCLC高凝状态患者和42例NSCLC无高凝状态患者血清凝血因子Ⅲ表达水平,探讨血清凝血因子Ⅲ与NSCLC高凝状态的关系。
1 材料与方法
1.1 研究对象
收集2013年1月至2014年10月云南省肿瘤医院院经病理确诊为NSCLC的患者116例,其中74例患者经生化检查(PLT、FIB、PT和APTT指标均异常)提示存在血液高凝状态为G-NSCLC组,另外42例NSCLC经生化检查提示不存在高凝状态为N-NSCLC组。两组患者年龄、性别、癌症类型以及分期等一般资料见表1。
纳入标准:1)病理确诊为NSCLC;2)入组前未行任何放化疗、手术、免疫或分子靶向治疗;3)临床分期、病理分型、年龄、性别、用药史以及合并症等临床资料完整;4)年龄>18岁,且预计生存期超过6个月;5)对本次研究知情且签署知情同意书,并经云南省肿瘤医院伦理委员会审查通过。
排除标准:1)既往有血液肿瘤或其他恶性肿瘤病史;2)合并其他血液系统疾病、急性感染或入组前两周内有血液感染病史;3)入组4周内有抗凝、抗血小板聚积、避孕、激素类或其他对血液凝血有影响药物服用史;4)合并心、肾及他脏器组织损伤或功能障碍;5)入组1年内因其他疾病有手术治疗或其他侵入性治疗史;6)随访时间<3年。
1.2 方法
1.2.1 外周血凝血因子Ⅲ检测 患者入组未接受任何治疗前或接受2个周期化疗后,空腹状态下,无菌真空采血管(BD公司,美国)抽取静脉血10 mL,1 000 rpm离心10 min(艾本德公司英国5810R型),收集上层血清立即检测或冻存于-80℃冰箱待检测凝血因子Ⅲ。通过人组织因子(TF)检测试剂盒(免疫克隆公司,美国)检测血清凝血因子Ⅲ(俗称组织因子),具体参照试剂盒说明书进行操作,酶标仪(基因有限公司,中国香港)测定OD450。
1.2.2 化疗方案 根据NSCLC高凝状态患者肿瘤分期及病情,本次研究纳入患者均选用紫杉醇(批准文号:国药准字H20058719;扬子江药业集团有限公司)联合顺铂(批准文号:国药准字H20073652;齐鲁制药有限公司),或吉西他滨(批准文号:国药准字H20030104;江苏豪森药业集团有限公司)联合顺铂,或长春瑞滨(批准文号:国药准字H19990278;江苏豪森药业集团有限公司)联合顺铂上述3种一线化疗方案行化疗,所有患者均至少行2个周期的化疗,并于2个周期的化疗后采集清晨空腹静脉血检测凝血因子Ⅲ。
1.2.3 随访 患者从确诊入组第一天开始计算生存时间,患者出院后,通过电话、门诊或走访等形式进行随访,随访频次为1~2次/月,以最后1次随访时间或随访期间患者死亡为随访终点,本研究随访时间为3年。此外,对于随访期间失访且后续未再进行随访的患者应剔除,但对于随访期间丢失一段时间而后续仍可联系上继续随访的患者不做剔除处理。
1.3 统计学分析
采用SPSS 20.0软件进行统计学分析。以±s表示计量资料,独立样本t检验比较组间差异;以百分比表示计数资料,χ2检验比较组间差异;配对样本t检验比较化疗前后凝血因子Ⅲ表达水平差异;Spearman法分析凝血因子Ⅲ表达水平与凝血指标的相关性;GraphPad Prism 5软件用于绘制NSCLC患者生存图。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料
对比NSCLC高凝状态患者和无高凝状态患者年龄、性别、临床分型以及TNM分期等临床资料,结果显示:NSCLC高凝状态患者凝血指标PT和APTT均显著低于无高凝状态患者(P<0.05),而FIB和PLT水平均显著高于无高凝状态患者(P<0.05);两组患者在淋巴结转移、远端转移和TNM分期上存在显著性差异(P<0.05),但在年龄、性别、肿瘤分化程度以及肿瘤临床分型上无显著性差异(P>0.05,表1)。
2.2 凝血因子Ⅲ表达水平
NSCLC高凝状态患者凝血因子Ⅲ表达水平平均为(560.32+200.34)ng/L,显著高于无高凝状态患者(463.29+159.22)ng/L的表达水平(P=0.008,图1)。
2.3 凝血因子Ⅲ与NSCLC高凝状态患者临床病理资料的关系
74例NSCLC高凝状态患者凝血因子Ⅲ表达水平为(126~10 003)ng/L,平均表达水平为(560.32+200.34)ng/L,本研究以凝血因子Ⅲ表达水平高于平均值为高水平表达,低于平均值为低水平表达。结果显示:74例NSCLC高凝状态患者凝血因子Ⅲ低表达水平34例,高表达水平40例;凝血因子Ⅲ与NSCLC高凝状态患者淋巴结转移、远端转移和TNM分期显著相关(P<0.05),与肿瘤分化程度无关(P>0.05,表2)。
2.4 NSCLC高凝状态患者凝血因子Ⅲ与凝血指标的相关性
采用Spearman法分析NSCLC高凝状态凝血因子Ⅲ的血清表达水平与PT、APTT、FIB以及PLT等凝血指标的相关性。结果显示:血清凝血因子Ⅲ水平与PT、APTT呈负相关,与FIB、PLT呈正相关(表3)。
2.5 化疗降低NSCLC高凝状态患者凝血因子Ⅲ表达水平
74例NSCLC高凝状态患者中,经紫杉醇联合顺铂化疗治疗26例,经吉西他滨联合顺铂化疗治疗19例,经长春瑞滨联合顺铂化疗治疗29例,分别于化疗2个周期后采集清晨空腹静脉血检测凝血因子Ⅲ,并于化疗前进行比较。结果显示:化疗后NSCLC高凝状态患者血清凝血因子Ⅲ表达水平为(471.39±160.31)ng/L,与化疗前相比呈显著性差异(P<0.05,图2)。
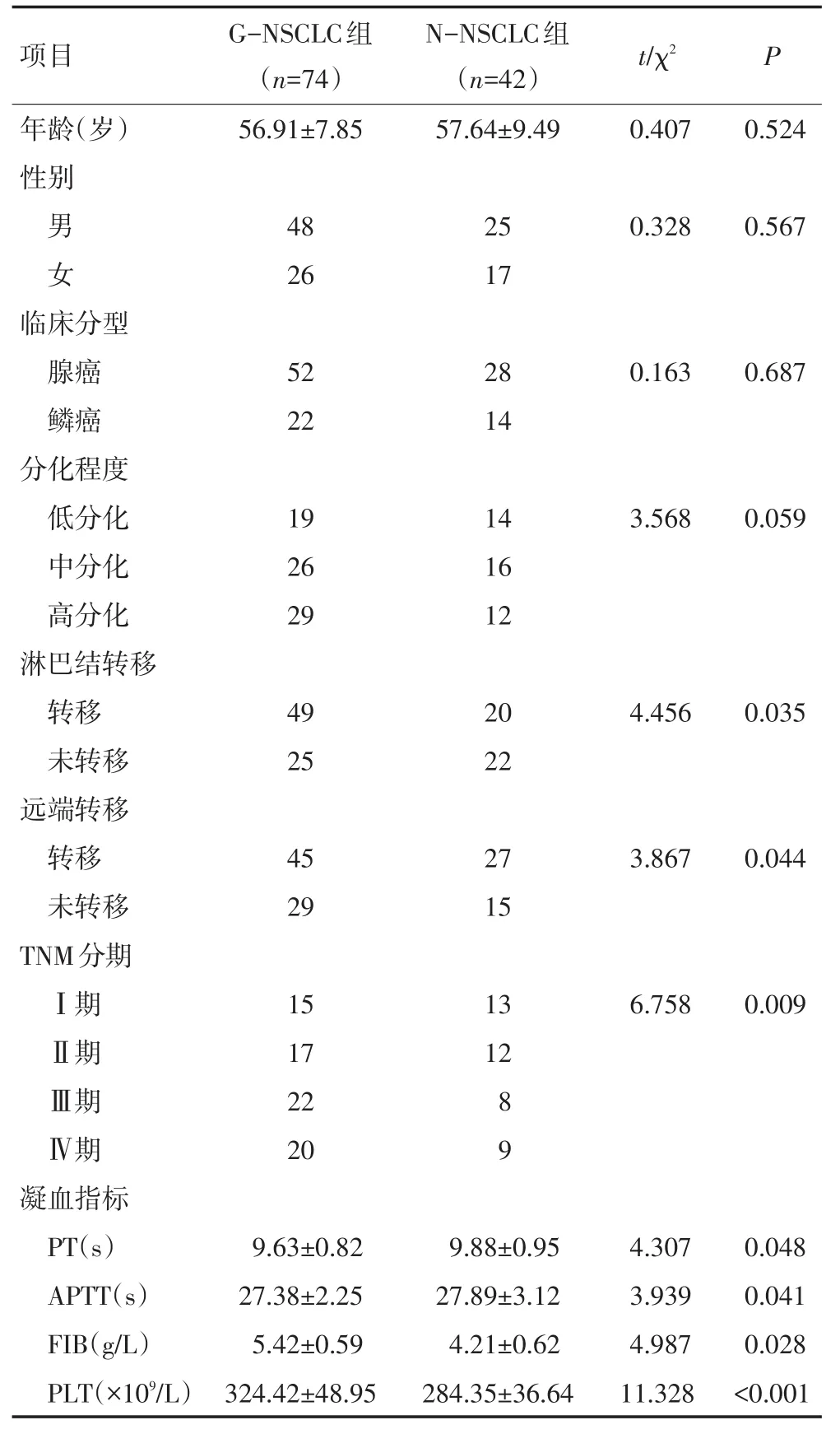
表1 两组患者一般资料比较
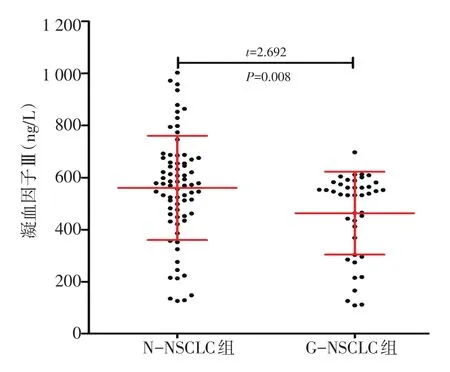
图1 凝血因子Ⅲ在不同研究对象血清中的水平表达
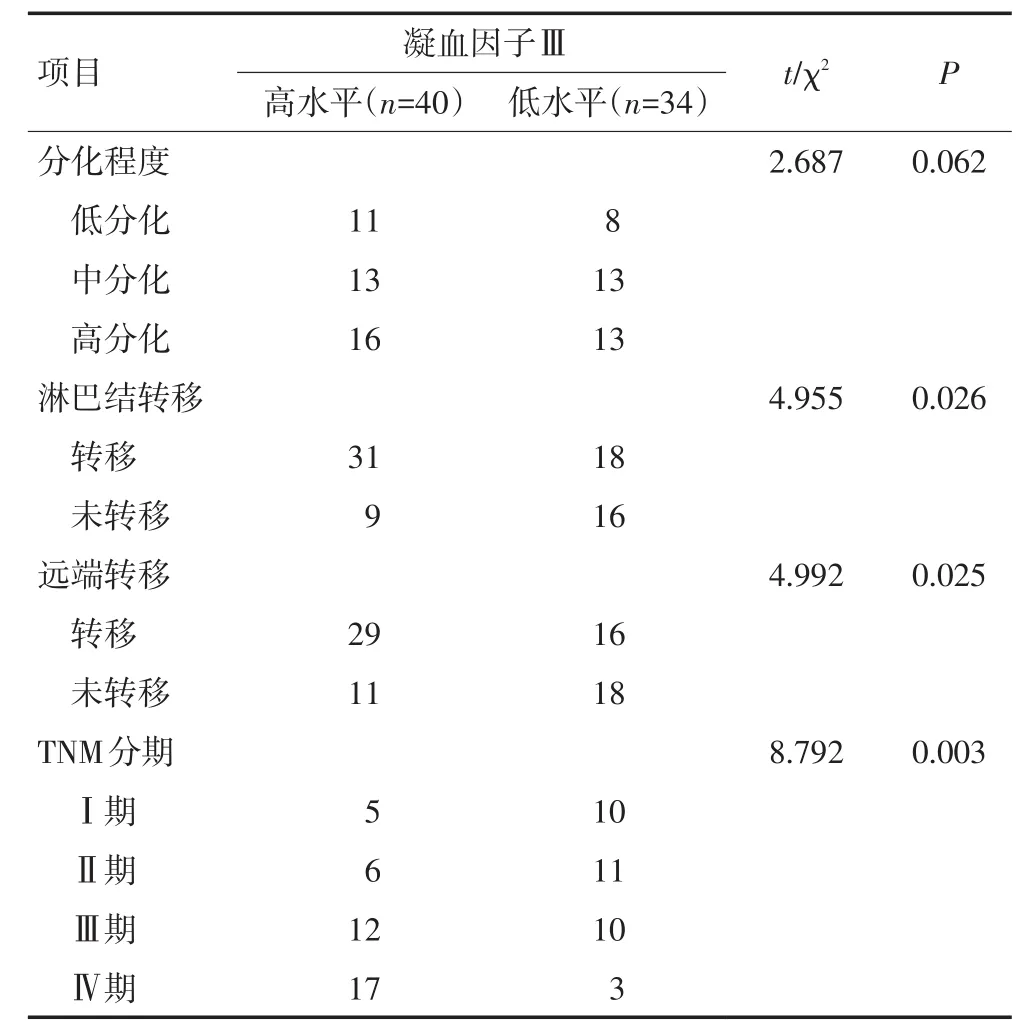
表2 凝血因子Ⅲ与NSCLC高凝状态患者临床病理资料的关系
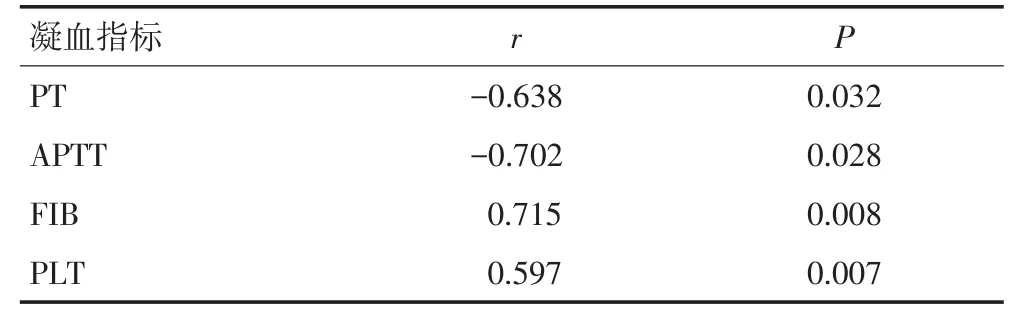
表3 凝血因子Ⅲ与凝血指标的相关性
2.6 凝血因子Ⅲ对NSCLC高凝状态患者生存期的影响
对74例NSCLC高凝状态患者进行为期3年的随访。结果显示:凝血因子Ⅲ高水平表达的NSCLC高凝状态患者1、2、3年总生存期分别为75.0%、47.5%和15.0%,均低于凝血因子低水平表达的患者(88.2%、58.8%和26.5%)(图3)。

图2 化疗降低NSCLC高凝状态患者凝血因子Ⅲ表达水平
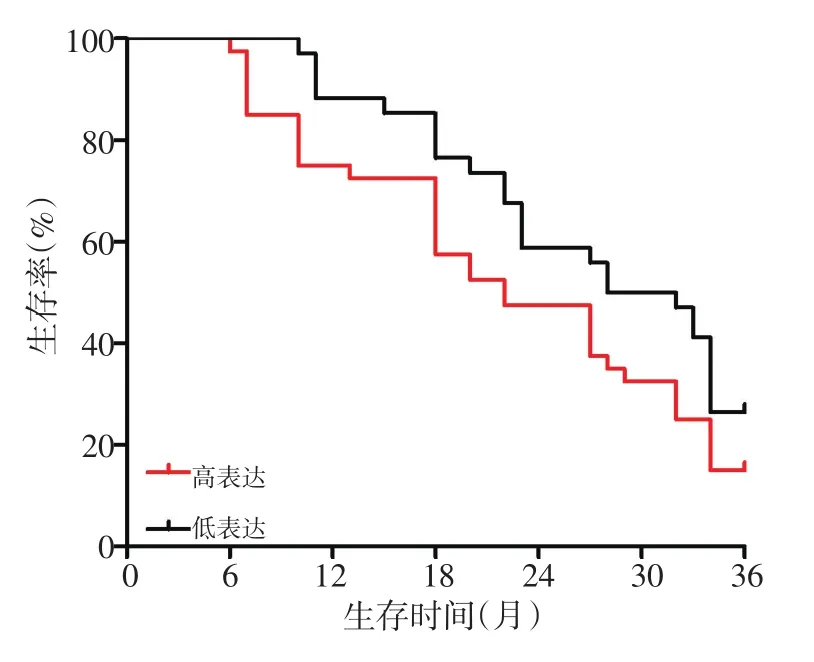
图3 血清凝血因子Ⅲ水平对NSCLC高凝状态患者生存期的影响
3 讨论
凝血因子Ⅲ是人体内促进血液凝固最强的物质,在正常生理状态下,血液单核细胞和血管内皮细胞不表达凝血因子Ⅲ,当机体出现组织损伤、细胞因子刺激或炎症反应时就会大量表达凝血因子Ⅲ。同时,凝血因子Ⅲ也是人体凝血系统唯一表达在细胞表面的受体型跨膜蛋白,其在发挥凝血功能的同时也发挥着作为受体蛋白的非凝血功能。研究发现,恶性肿瘤患者血液中的组织因子可能来自于癌细胞[10],虽然目前并不清楚其参与恶性肿瘤发生发展的具体分子机制,但可以确定组织因子与恶性肿瘤的浸润转移、临床分期以及预后密切相关[10,13-14]。
本研究发现,NSCLC高凝状态患者血清组织因子的表达水平显著高于无高凝状态患者,并且与NSCLC患者淋巴结转移、远端转移和TNM分期显著相关。高凝状态在恶性肿瘤患者中普遍存在,尤其是中晚期恶性肿瘤患者,同时已有研究发现肺癌患者中多个与凝血功能相关的亚临床指标改变明显,均说明凝血功能与恶性肿瘤疾病进展密切相关[11-12,15]。李艳华等[16]研究指出,TNM分期Ⅲ、Ⅳ期和存在淋巴结转移的NSCLC患者更易出现高凝状态,并且出现高凝状态的NSCLC患者预后更差。但黄琬玲等[17]却指出,不同TNM分期、有无淋巴结转移和有无远端转移的NSCLC患者血清组织因子的表达水平差异无统计学意义,提示单纯的血清组织因子表达水平的改变并不能影响NSCLC疾病进展,仅在特定的“环境”下组织因子才能发挥影响NSCLC疾病进展的作用,充分地认识到组织因子的凝血功能以及高凝状态与恶性肿瘤疾病进展的关系[11-12,15],提示高凝状态有可能是组织因子参与NSCLC疾病进展的特定“环境”。
进一步研究发现,凝血因子Ⅲ表达水平不仅与NSCLC高凝状态患者淋巴结转移、远端转移和TNM分期显著相关,而且与PT、APTT呈负相关,与FIB、PLT呈正相关。肿瘤细胞可以激活患者体内的凝血系统[18],而持续激活的凝血系统又会进一步增强癌细胞的侵袭和转移能力[19-20],进而参与恶性肿瘤的发展,所以在一些恶性肿瘤患者体内凝血系统被激活程度与肿瘤临床分期和预后密切相关[9-12]。处于高凝状态的NSCLC患者,增高血液黏度和减缓血液流速将减少因微血管挤压,而引起的肿瘤细胞机械性损伤,更加有利于癌栓的形成和癌细胞的侵袭与转移。
综上所述,NSCLC高凝状态患者凝血因子Ⅲ表达水平与淋巴结转移和TNM分期有关,对患者生存期预测具有一定的指导意义。但是本研究尚存一些不足:1)纳入病例数有限,且具有地域限制性;2)凝血因子Ⅲ对NSCLC高凝状态患者疾病进展的具体分子机制仍不明确。
[1]Li Z.SC17.02 lung cancer in china:challenges and perspectives[J].J Thora Oncol,2017,12(1):S113-S114.
[2]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].Ca A Cancer J Clin,2016,66(2):115-132.
[3]李艳华,魏素菊,王俊艳,等.非小细胞肺癌患者凝血功能异常的相关因素与预后分析[J].中国肺癌杂志,2014,17(11):789-796.
[4]Voulgaris E,Pentheroudakis G,Vassou A,et al.Disseminated intravascular coagulation(DIC)and non-small cell lung cancer(NSCLC):report of a case and review of the literature[J].Lung Cancer,2009,64(2):247-249.
[5]牛倩,江虹.肿瘤相关静脉血栓的监测进展[J].中华检验医学杂志,2016,39(10):739-742.
[6]Tinholt M,Sandset PM,Iversen N.Polymorphisms of the coagulation system and risk of cancer[J].Thrombo Res,2016,(140):S49.
[7]Lindahl AK,Odegaard OR,Sandset PM,et al.Coagulation inhibition and activation in pancreatic cancer.Changes during progress of disease[J].Cancer,2015,70(8):2067-2072.
[8]Gastineau DA.Disseminated intravascular coagulation:a bigger problem as cancer therapy improves[J].Oncol,2015,29(2):102-103.
[9]黄琬玲,周燕斌.肺癌高凝状态的发生机制及治疗对策的新认识[J].国际呼吸杂志,2010,30(4):237-242.
[10]Kasthuri RS,Taubman MB,Mackman N.Role of tissue factor in cancer[J].J Clin Oncol,2009,27(29):4834-4838.
[11]Gran OV,Braekkan SK,Paulsen B,et al.D-dimer measured at first venous thromboembolism is associated with future risk of cancer[J].Haemat,2016,101(12):e473.
[12]Alizadeh H,Szólics M,Al-Tajer S,et al.A haemostatic state in lung cancer patients:pilot study[J].Int J Cancer Prev,2008,2(4):257-264.
[13]Unruh D,Sagin F,Adam M,et al.Levels of alternatively spliced tissue factor in the plasma of patients with pancreatic cancer may help predict aggressive tumor phenotype[J].Ann Surg Oncol,2015,22 Suppl 3(3):1-6.
[14]张剑权,万远廉.组织因子促进肿瘤侵袭及转移的研究进展[J].中华实验外科杂志,2007,24(3):382-384.
[15]Lyman GH,Khorana AA.Cancer,clots and consensus:new understanding of an old problem[J].J Clin Oncol,2009,27(29):4821.
[16]李艳华,魏素菊,王俊艳,等.非小细胞肺癌患者凝血功能异常的相关因素与预后分析[J].中国肺癌杂志,2014,17(11):789-796.
[17]黄琬玲,周燕斌,黎银焕,等.血浆组织因子在非小细胞肺癌患者中的表达及意义[J].中国综合临床,2013,29(3):246-249.
[18]Yokota N,Koizume S,Miyagi E,et al.Self-production of tissue factorcoagulation factorⅦcomplex by ovarian cancer cells[J].Bri J Cancer,2009,101(12):2023-2029.
[19]Koizume S,Jin MS,Miyagi E,et al.Activation of cancer cell migration and invasion by ectopic synthesis of coagulation factorⅦ[J].Cancer Res,2006,66(19):9453.
[20]Ma YY,He XJ,Wang HJ,et al.Interaction of coagulation factors and tumor-associated macrophages mediates migration and invasion of gastric cancer[J].Cancer Sci,2011,102(2):336.

