侵袭性B细胞淋巴瘤中PIK3CA扩增和PTEN缺失及其临床病理学意义*
马明福 余丽 马志萍 张巍 崔文丽
侵袭性B细胞淋巴瘤是非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)中常见的类型,其恶性程度较高,预后较差,容易复发;主要包括弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)、伯基特淋巴瘤(Burkitt lymphoma,BL)和一些形态介于DLBCL和BL之间不能分类的B细胞淋巴瘤。由于侵袭性B细胞淋巴瘤具有较大的生物学异质性及耐药特征等,其治疗依然面临巨大的挑战。
PI3K/Akt/mTOR信号通路在许多常见恶性肿瘤的疾病进展中发挥重要作用,包括侵袭性B细胞淋巴瘤。PI3K/Akt/mTOR信号传导通路的激活与侵袭性B细胞淋巴瘤患者预后呈负相关。侵袭性B细胞淋巴瘤中PIK3CA存在基因拷贝数变异(copy number variation,CNV),且CNV与预后的比较差异具有统计学意义(P<0.05),提示PIK3CA的CNV在侵袭性B细胞淋巴瘤治疗中具有重要作用,但其作用及机制未知。PI3K/Akt/mTOR信号通路受磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)的正性调节,也受10号染色体上缺失的磷酸酶和张力蛋白同源物(phosphate and tension homology deleted on chromsome ten,PTEN)的负性抑制。本研究通过荧光原位杂交技术检测侵袭性B细胞淋巴瘤中PIK3CA和PTEN基因表达情况及其与各临床病理指标间的相关性,旨在为侵袭性B细胞淋巴瘤的治疗提供理论依据。
1 材料与方法
1.1 病例资料
回顾性分析新疆医科大学第一附属医院2008年1月至2012年12月术前未经任何治疗的侵袭性B细胞淋巴瘤标本235例,其中DLBCL为205例,BL为27例,其他灰区淋巴瘤(介于DLBCL和BL之间,不能分类的B细胞淋巴瘤)3例。所选标本均具有完整的临床病理资料,并由2位高年资病理专家根据形态学和免疫表型重新阅片。发病年龄范围为23~78岁,平均发病年龄为53岁,中位发病年龄为54岁;<60岁为147例,≥60岁为88例。其中男性139例,女性96例。通过电话随访患者,以确诊日期为起点,死亡日期为终点,随访的截止日期为2016年12月31日,共有42例失访,随访率为82.1%,失访患者自失访当月起按截尾数据计算。
1.2 方法
荧光原位杂交:选择美国Gene Technology公司提供的检测试剂盒,探针包括PIK3CA(货号:06N10-020)和PTEN(货号:04N62-020),应用LEICA原位杂交仪对所有病例进行PIK3CA和PTEN基因状态检测。结果判读:PIK3CA在胞核中2个绿色信号为阴性,>2个绿色荧光信号为拷贝数扩增,随机计数100个肿瘤细胞,15%以上肿瘤细胞出现扩增视为阳性。PTEN在胞核中2个橙色2个绿色信号为阴性,<2个橙色信号为拷贝数缺失,随机计数100个肿瘤细胞,15%以上肿瘤细胞出现缺失视为阳性。
1.3 统计学分析
采用SPSS 17.0软件对数据进行统计学分析。计数资料的组间比较采用χ2检验和Fisher确切概率法,生存资料单因素分析采用Kaplan-Meier法,相关性分析采用Spearman法。以P<0.05为差异具有统计学意义。
2 结果
2.1 基本临床病理特征
本研究共纳入侵袭性B细胞淋巴瘤患者235例,其中男性139例,女性96例;病变直径≤10 cm为199例,>10 cm为36例;原发部位在淋巴结内为158例,在淋巴结外为77例;国际预后指数(IPI)0~1分为124例,2分为54例,3分为35例,4~5分为22例;体能状态(PS)评分≤2分为197例,>2分为38例;出现B症状(体质量减轻>10%、发热、夜间盗汗)为121例,未出现B症状为114例;临床病理分期Ⅰ、Ⅱ期为139例,Ⅲ、Ⅳ期为96例;累及淋巴结个数(exln2)≤2个为189例,>2个为46例;乳酸脱氢酶(LDH)水平≤240IU/L为129例,>240IU/L为106例(表1)。侵袭性B细胞淋巴瘤H&E染色显示体积中等到较大的淋巴细胞,核呈圆形或卵圆形,染色质细腻,可见1个大核仁,核分裂像易见(图1A),免疫组织化学CD20肿瘤细胞显示弥漫膜强阳性(图1B)。
2.2 侵袭性B细胞淋巴瘤中PIK3CA的相关研究
2.2.1 侵袭性B细胞淋巴瘤中PIK3CA的扩增情况 侵袭性B细胞淋巴瘤中PIK3CA正常表达,显示2个绿色信号(图2A);侵袭性B细胞淋巴瘤中PIK3CA扩增,显示>2个绿色信号(图2B)。
2.2.2 PIK3CA扩增与侵袭性B细胞淋巴瘤各临床病理特征的关系 按照纳入、排除标准收集的235例侵袭性B细胞淋巴瘤标本中,PIK3CA基因的扩增率为12.3%(29/235),临床分期Ⅰ~Ⅱ期和Ⅲ~Ⅳ期的阳性率分别为8.6%(12/139)和17.7%(17/96),差异具有统计学意义(P=0.038)。PIK3CA与年龄、性别、肿瘤直径、原发部位、IPI、PS评分、B症状、exln2和LDH水平等组间比较差异均无统计学意义(均P>0.05),PIK3CA扩增与PTEN缺失之间的比较差异具有统计学意义(P=0.046,表1)。
2.2.3 PIK3CA扩增与侵袭性B细胞淋巴瘤患者生存期的关系 PIK3CA扩增与生存期无显著相关性(P=0.135,图3)。
2.3 侵袭性B细胞淋巴瘤中PTEN的相关研究
2.3.1 侵袭性B细胞淋巴瘤中PTEN的缺失情况 侵袭性B细胞淋巴瘤中PTEN正常表达,显示2个红色、2个绿色信号(图4A);侵袭性B细胞淋巴瘤中PTEN缺失,显示绿色信号2个,而红色信号仅1个或无红色信号(图4B)。
2.3.2 PTEN缺失与侵袭性B细胞淋巴瘤各临床病理特征的关系 PTEN基因在235例侵袭性B细胞淋巴瘤中总阳性率为13.6%(32/235),临床分期Ⅰ~Ⅱ期和Ⅲ~Ⅳ期的阳性率分别为12.9%(18/139)和14.6%(14/96),两者间的差异无统计学意义(P=0.720)。PTEN与其他临床病理指标,如年龄、性别、肿瘤直径、原发部位、IPI、PS评分、B症状、exln2和LDH水平等组间比较差异均无统计学意义(均P>0.05),PTEN缺失与PIK3CA扩增之间的比较差异具有统计学意义(P=0.046,表2)。
2.4 PTEN缺失与侵袭性B细胞淋巴瘤患者生存期的关系
PTEN缺失与生存期无显著相关性(P=0.932,图5)。

表1 PIK3CA与患者临床病理特征的关系

图1 侵袭性B细胞淋巴瘤
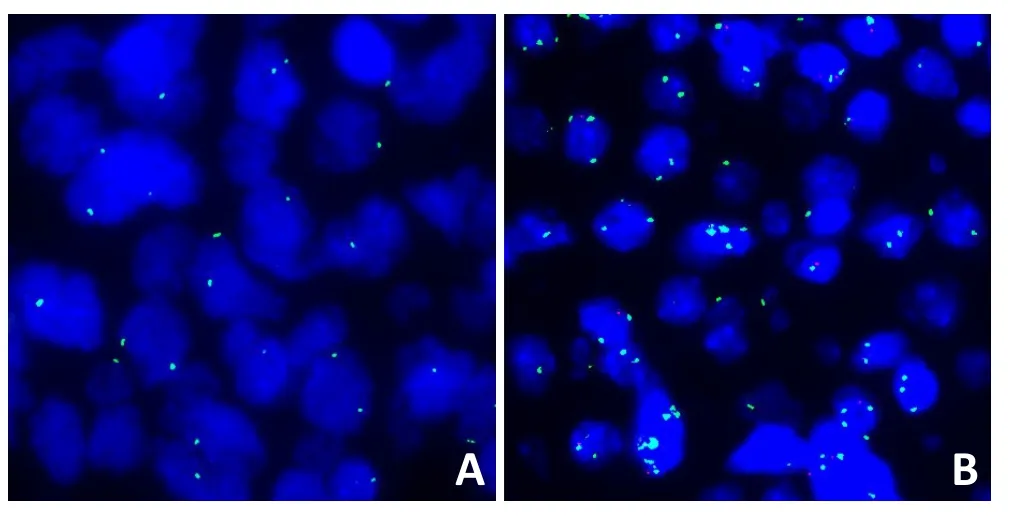
图2 侵袭性B细胞淋巴瘤中PIK3CA表达情况
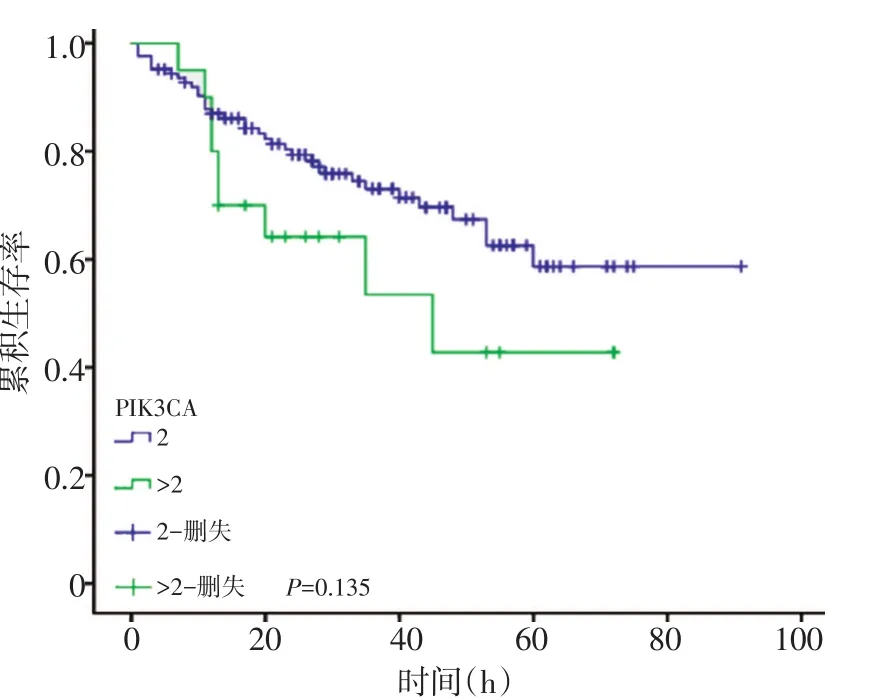
图3 PIK3CA扩增与生存期无显著相关性
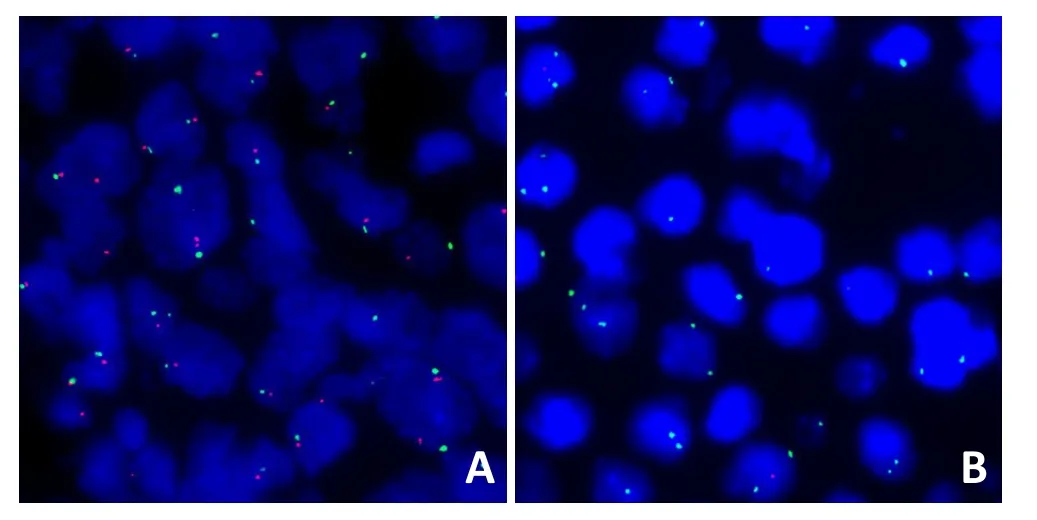
图4 侵袭性B细胞淋巴瘤中PTEN的缺失情况
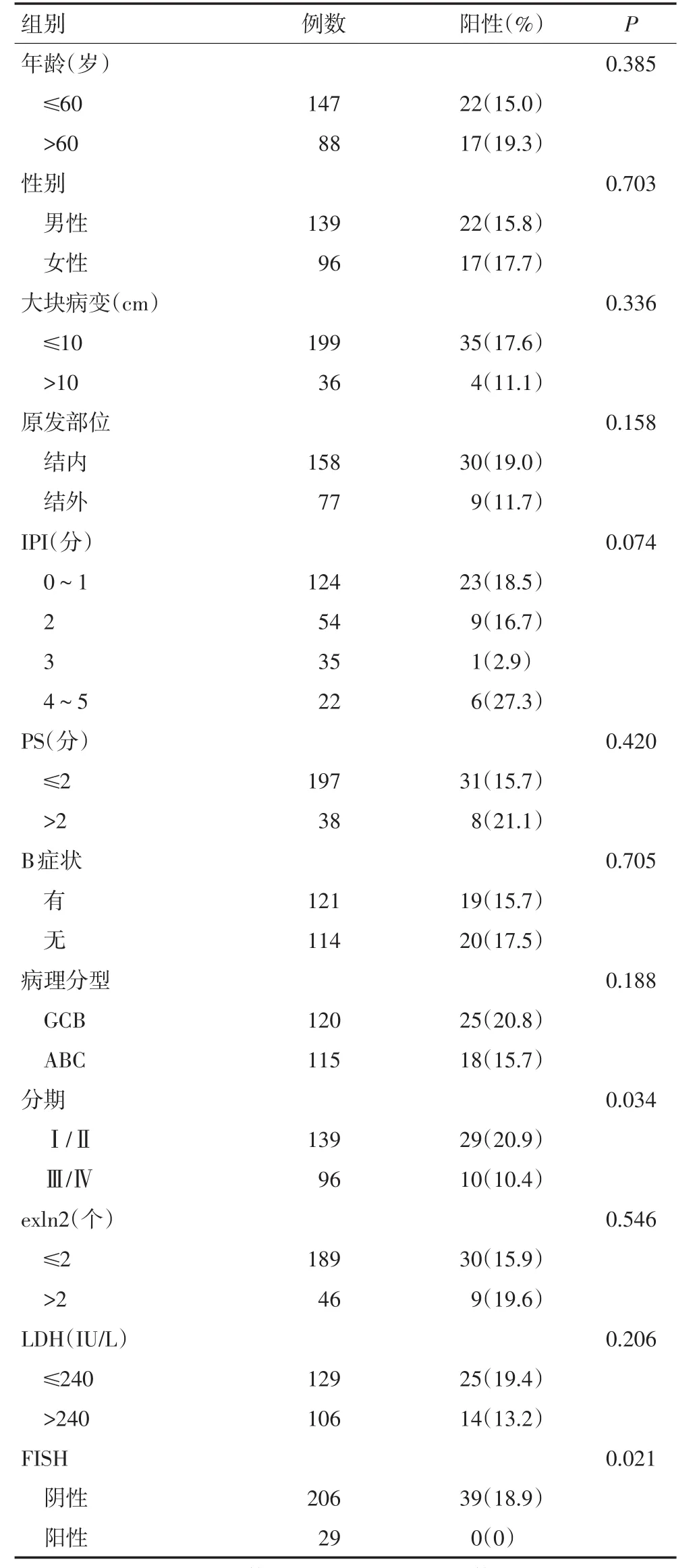
表2 PTEN与患者临床病理特征的关系
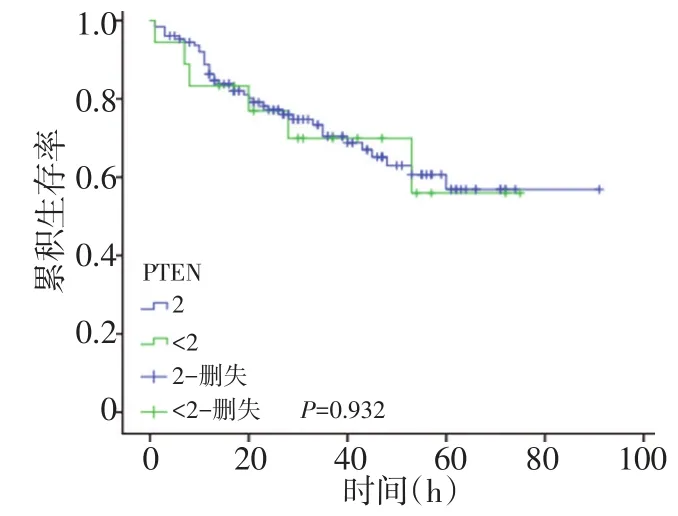
▶图5 PTEN缺失与生存期无显著相关性
3 讨论
侵袭性B细胞淋巴瘤为最常见的一类NHL,其恶性程度较高,虽然对常规放化疗较为敏感,但易复发或耐药,主要包括DLBCL、BL和一些灰区淋巴瘤[1]。
DLBCL是一组常见的侵袭性B细胞淋巴瘤,占所有恶性淋巴瘤的30%~40%[2]。BL最常见于儿童和青少年,分为地方型、散发型和免疫缺陷相关型。地方型与EBV感染相关。灰区淋巴瘤为形态介于DLBCL和BL之间不能分类的B细胞淋巴瘤,同时具有上述两种淋巴瘤的形态,但是又不能归为其中的任何一类[3]。
PI3K/Akt/mTOR信号通路在恶性细胞发生发展中发挥重要作用,包括细胞生长、存活和增殖[4]。目前,已经发现该通路在多种恶性肿瘤中特异表达,包括侵袭性B细胞淋巴瘤[5]。PI3K/Akt/mTOR信号通路受PI3K基因的正向调节和PTEN基因的负性抑制。PI3K为一种胞内磷脂酰脂质激酶,称作磷脂酰肌醇3激酶,根据其结构特点和底物特异性可以分为3类(Ⅰ~Ⅲ类)[6]。Ⅰ类PI3K研究最为广泛,包括催化亚基PIK3CA、PIK3CB、PIK3CD、PIK3CG和调节亚基PIK3R1、PIK3R2、PIK3R3。其中催化亚基在肿瘤的发生发展中起主要作用[7]。
PIK3CA基因在许多恶性肿瘤中扩增,包括肺癌[8]、子宫颈癌[9]、大肠癌[10],头颈部癌[11]、乳腺癌[12]及淋巴瘤[13]等。Xu等[14]对73例确诊的DLBCL患者进行随访,其中男性45例和女性28例,年龄为18~78岁,中位年龄为50岁,检测指标包括:患者年龄、性别、PS评分、LDH水平、肿瘤分期、免疫表型、淋巴结外侵犯的数量、5年生存率、磷酸化的蛋白激酶(phosphorylated protein kinase B,p-AKT)表达等进行统计学分析,结果显示p-AKT阳性患者预后较差,提示PI3K/Akt/mTOR信号通路与DLBCL患者预后呈负相关。在侵袭性B细胞淋巴瘤中,PI3K的CNV与肿瘤的发生有关,Cui等[15]研究发现,在DLBCL 中存在PI3K的CNV。PIK3CA的CNV与p110α异常表达和PI3K/Akt/mTOR信号通路激活相关。PIK3CA的CNV对于DLBCL患者的预后具有重要意义。PIK3CA扩增导致Akt的磷酸化,PI3K/Akt/mTOR信号通路被激活,提示PIK3CA扩增可能具有致癌性[16-17]。在本研究中,患者PIK3CA基因总扩增率为12.3%(29/235),临床分期Ⅰ~Ⅱ期和Ⅲ~Ⅳ期的扩增率分别为8.6%(12/139)和17.7%(17/96),后者显著高于前者,差异具有统计学意义(P=0.038),提示PIK3CA扩增与疾病晚期相关。而PIK3CA与年龄、性别、肿瘤直径、原发部位、IPI、PS评分、B症状、exln2和LDH水平等组间比较差异均无统计学意义(均P>0.05),因为样本量较小,亟需扩大样本量进行检验。PIK3CA扩增与PTEN缺失之间的比较差异具有统计学意义(P=0.046)。Ma等[18]研究显示,48例DLBCL中12例存在p-AKT活化,其中15例PTEN的表达缺失,P-AKT和PTEN表达呈显著负相关(r=-0.450,P<0.05),提示PI3K/Akt/mTOR信号通路的调节参与DLBCL的进展,并且可能参与部分DLBCL患者对利妥昔单抗的耐药。
PTEN为PI3K/Akt/mTOR信号通路的负调控因子,其在控制细胞生长、存活和增殖中发挥重要作用,具有磷酸酶活性。3、4、5三磷酸磷脂酰肌醇(phosphatidylinositol trisphosphate,PIP3)为PI3K的产物,PTEN可以将PIP3脱磷酸成3、4二磷酸磷脂酰肌醇(phosphatidylinositol diphosphate,PIP2),从而抑制PI3K/Akt/mTOR信号通路的下游,包括Akt和mTOR,最终抑制该信号通路的激活[19]。Pfeifer等[20]研究发现PTEN抑癌基因通常差异性表达,在大部分GCB型DLBCL患者中发现PTEN缺失,然而在ABC型DLBCL患者中却较少缺失,在11个GCB-DLBCL细胞系中7个PTEN缺失,几乎全部ABCDLBCL细胞系均有PTEN表达,提示GCB-DLBCL可能与PTEN缺失有关[21],而在本研究中120例GCB-DLBCL样本仅25例缺失,115例ABC-DLBCL样本仅18例缺失,与Pfeifer等[20]的试验结果不同,可能因本研究样本量较大,更能接近真实情况。Lenz等[22]在原发DLBCL中开展了基因表达谱分析,发现PTEN缺失为GCB-DLBCL所特有。在本研究中,PTEN与IPI之间虽然差异无统计学意义(P=0.081),但是4~5组PTEN缺失率为27.6%明显优于0~1组PTEN缺失率为11.3%。PTEN与年龄、性别、肿瘤直径、原发部位、IPI、PS评分、B症状、临床分期、exln2和LDH水平等组间比较差异均无统计学意义(均P>0.05)。以上与Jensen等[23]研究结果相同,提示PTEN或为非侵袭性B细胞淋巴瘤中PI3K/AKT/mTOR活化的主要因素。
综上所述,PIK3CA扩增在临床分期Ⅲ~Ⅳ期DLBCL中的阳性率较高,说明PIK3CA扩增与临床分期相关,PIK3CA扩增可能促进了DLBCL的发生发展。而PTEN也已被确定为肿瘤抑制基因,虽然本研究未发现PTEN与DLBCL各临床病理指标有显著相关性,但不能断定其与DLBCL发生发展无关。目前,已知PI3K/Akt/mTOR信号通路的活化促进了DLBCL的发展,而本研究证明PIK3CA扩增与临床分期相关,有可能通过抑制PIK3CA扩增治疗相关DLBCL患者,为临床选择新的靶向药物提供了理论依据。
[1]Choi SY,Kim SJ,Kim WS,et al.Aggressive B cell lymphomas of the gastrointestinal tract:clinicopathologic and genetic analysis[J].Virchows Arch,2011,459(5):495-502.
[2]Sehn LH,Gascoyne RD.Diffuse large B-cell lymphoma:optimizing outcome in the context of clinical and biologic heterogeneity[J].Blood,2015,125(1):22-32.
[3]Rimsza L,Pittaluga S,Dirnhofer S,et al.The clinicopathologic spectrum of mature aggressive B cell lymphomas[J].Virchows Arch,2017,471(4):1-14
[4]de Melo AC,Paulino E,Garces ÁH,et al.A review of mTOR pathway inhibitors in gynecologic cancer[J].Oxid Med Cell Longev,2017,2017(1):4809751.
[5]Ocana A,Vera-Badillo F,Al-Mubarak M,et al.Activation of the PI3K/mTOR/AKT pathway and survival in solid tumors:systematic review and meta-analysis[J].PLoS One,2014,9(4):e95219.
[6]Akinleye A,Avvaru P,Furqan M,et al.Phosphatidylinositol 3-kinase(PI3K)inhibitors as cancer therapeutics[J].J Hematol Oncol,2013,6(1):88.
[7]Cui W,Cai Y,Zhou X.Advances in subunits of PI3K classⅠin cancer[J].Pathology,2014,46(3):169-176.
[8]Walls M,Baxi SM,Mehta PP,et al.Retraction:Targeting small cell lung cancer harboring PIK3CA mutation with a selective oral PI3K inhibitor PF-4989216[J].Clin Cancer Res,2017,23(15):4523.
[9]TKH C,Cheung TH,Yim SF,et al.Liquid biopsy of PIK3CA mutations in cervical cancer in Hong Kong Chinese women[J].Gynecol Oncol,2017,146(2):334-339.
[10]Zumwalt TJ,Wodarz D,Komarova NL,et al.Aspirin-induced chemoprevention and response kinetics are enhanced by PIK3CA mutations in colorectal cancer cells[J].Cancer Prev Res(Phila),2017,10(3):208-218.
[11]Baba Y,Maeda T,Suzuki A,et al.Deguelin potentiates apoptotic activity of an EGFR tyrosine kinase inhibitor(AG1478)in PIK3CA-mutated head and neck squamous cell carcinoma[J].Int J Mol Sci,2017,18(2):262.
[12]Filipenko ML,Os'kina NA,Oskorbin IA,et al.Association between the prevalence of somatic mutations in PIK3CA gene in tumors and clinical and morphological characteristics of breast cancer patients[J].Bull Exp Biol Med,2017,163(2):250-254.
[13]Cui W,Zheng S,Liu Z,et al.PIK3CA expression in diffuse large B cell lymphoma tissue and the effect of its knockdown in vitro[J].Onco Targets Ther,2017,(10):2239-2247.
[14]Xu ZZ,Xia ZG,Wang AH,et al.Activation of the PI3K/AKT/mTOR pathway in diffuse large B cell lymphoma:clinical significance and inhibitory effect of rituximab[J].Ann Hematol,2013,92(10):1351-1358.
[15]Cui W,Cai Y,Wang W,et al.Frequent copy number variations of PI3K/AKT pathway and aberrant protein expressions of PI3K subunits are associated with inferior survival in diffuse large B cell lymphoma[J].J Transl Med,2014,(12):10.
[16]Zeng S,Zhu Y,Ma AH,et al.The Phosphatidylinositol 3-kinase pathway as a potential therapeutic target in bladder cancer[J].Clin Cancer Res,2017,23(21):6580.
[17]Parsons BL,McKim KL,Myers MB.Variation in organ-specific PIK3CA and KRAS mutant levels in normal human tissues correlates with mutation prevalence in corresponding carcinomas[J].Environ Mol Mutagen,2017,58(7):466-476.
[18]Ma Y,Zhang P,Gao Y,et al.Evaluation of AKT phosphorylation and PTEN loss and their correlation with the resistance of rituximab in DLBCL[J].Int J Clin Exp Pathol,2015,8(11):14875-14884.
[19]Kim DH,Suh J,Surh YJ,et al.Regulation of the tumor suppressor PTEN by natural anticancer compounds[J].Ann N Y Acad Sci,2017,1401(1):136-149.
[20]Pfeifer M,Grau M,Lenze D,et al.PTEN loss defines a PI3K/AKT pathway-dependent germinal center subtype of diffuse large B-cell lymphoma[J].Proc Natl Acad Sci U S A,2013,110(30):12420-12425.
[21]Pfeifer M,Lenz G.PI3K/AKT addiction in subsets of diffuse large B-cell lymphoma[J].Cell Cycle,2013,12(21):3347-3348.
[22]Lenz G,Wright GW,Emre NC,et al.Molecular subtypes of diffuse large B-cell lymphoma arise by distinct genetic pathways[J].Proc Natl Acad Sci U S A,2008,105(36):13520-13525.
[23]Jensen JD,Knoop A,Laenkholm AV,et al.PIK3CA mutations,PTEN,and pHER2 expression and impact on outcome in HER2-positive early-stage breast cancer patients treated with adjuvant chemotherapy and trastuzumab[J].Ann Oncol,2012,23(8):2034-2042.

