p38δ对宫颈癌HeLa细胞顺铂敏感性的影响
沈祥丽张勇柳怡 张勇武
(1.成都市锦江区妇幼保健院妇产科,四川 成都 610016; 2.西南医科大学临床医学院,四川 泸州 646000; 3.绵阳市中心医院妇产科,四川 绵阳 621000)
细胞分裂素活化蛋白激酶(mitogen activated protein kinase,MAPK)p38是细胞生理及病理条件下重要的细胞信号转导调控激酶。该家族蛋白主要包括四个亚型,即p38α(MAPK14)、p38β(MAPK11)、p38γ(MAPK12)和p38δ(MAPK13)[1]。其中,p38α是研究最广泛的一个亚型,其在细胞胞增殖、细胞分裂、细胞凋亡及肿瘤发生发展过程中具有重要的调控作用[2]。虽然人们现在已发现p38δ也参与多种细胞行为活动的调控,但是对p38δ具体调控功能还知之甚少。p38δ在肿瘤发生、发展中的调控功能是目前研究较为深入的领域。人们发现,不同的肿瘤组织细胞中,p38δ的调控功能不同。在人类原发性皮肤鳞状细胞癌细胞、胆管癌细胞及肝癌细胞中,p38δ的表达量上升,并且促进肿瘤的增殖、迁移与侵袭[3-5];而在食管鳞状细胞癌细胞、恶性胸膜间皮瘤和原发性皮肤黑色素瘤中,p38δ表达水平特异性降低。并且在这些肿瘤细胞中过表达p38δ将会促进肿瘤细胞凋亡或抑制肿瘤细胞的侵袭和迁移[6-8]。在宫颈癌细胞系HeLa细胞中,研究者发现p38δ表达水平降低[9]。但是目前还没有报道指出p38δ对宫颈癌发生发展的调控作用。顺铂是一种被广泛用于各种肿瘤治疗的化疗药物,其通过与细胞内亲核大分子相互作用来抑制细胞循环、促进细胞凋亡,具有抗癌谱广、作用强的特点。在宫颈癌治疗过程中,顺铂常被作为基础化疗药物。但是,患者接受顺铂治疗的过程中,容易产生耐药性,该过程与胞内蓄积药物流出、DNA修复过程中顺铂物过度消除及细胞凋亡调节蛋白表达异常等病理变化相关。增强癌细胞对顺铂的敏感度将会有效提高治疗效果。目前,促进细胞凋亡是降低顺铂耐药性的主要手段。本实验通过细胞转染的方法在HeLa细胞中过表达p38δ,探讨在顺铂处理条件下p38δ对HeLa细胞凋亡的影响,从而为降低宫颈癌治疗过程中顺铂耐药性提供新的思路和方法。
1 材料与方法
1.1 材料和主要试剂 HeLa细胞购自中国科学院上海生命科学研究院细胞库;DMEM培养基、0.25%胰蛋白酶和胎牛血清购自美国Gibco公司;细胞蛋白提取试剂盒购自上海碧云天生物技术有限公司;p38δ野生型表达质粒pcDNA3.1(+)-p38δ(WT)、p38δ激酶失活突变体(第54位赖氨酸突变为精氨酸)表达质粒pcDNA3.1(+)-p38δ(K54R)[10]及对照质粒pcDNA3.1(+)-Vector购自上海吉凯基因化学技术有限公司;PVDF膜、Protein A/G磁珠及蛋白酶抑制剂Cocktail购自美国Millipore公司; p38δ兔单克隆抗体、Bax兔多克隆抗体、p53兔单克隆抗体、Bcl-2兔多克隆抗体及β-actin鼠单克隆抗体皆购自美国Abcam公司;p38磷酸化(phospho p38(T180/Y182))兔单克隆抗体购自美国cell signal 公司;细胞转染试剂lipofectamine 3000、羊抗兔荧光二抗、羊抗鼠荧光二抗、BCA法蛋白浓度测定试剂盒、预染蛋白Maker皆购自美国Thermo 公司;Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate, FITC)/碘化丙啶 (Propidium Iodide,PI)双染色细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司;顺铂购自美国Sigma公司;5810R 型离心机购自德国Eppendorf 公司;ChemiDoc MP全能型凝胶成像分析系统购自美国Bio-Rad 公司;Nikon 50i正置显微镜(带高清CCD DP72摄像头)购自日本尼康公司。
1.2 实验方法
1.2.1 细胞培养 液氮中取出细胞后迅速置于37℃水浴锅中解冻,然后与5 ml细胞培养液(10%胎牛血清 DMEM培养液)混匀,500 ×g离心5 min,将细胞重悬于8 ml细胞培养液后移至10cm细胞培养皿中,细胞培养箱进行培养(37℃, 5% CO2)。每天更换一次培养液。
1.2.2 细胞转染 将HeLa细胞接种至24孔板(1×105细胞/孔)或6孔板(4×105细胞/孔)中,培养过夜。细胞接种12-16 h后,进行质粒转染;按照lipofectamine 3000说明书配制质粒-转染试剂混合液,24孔板细胞每孔转染质粒1μg,6孔板细胞每孔转染质粒4 μg。质粒-转染试剂混合液室温放置20 min后加入培养板内(细胞培养液提前更换为DMEM培养液);细胞继续培养4 h后,将DMEM培养液更换为细胞完全培养液,正常培养。
1.2.3 顺铂处理 HeLa细胞按细胞转染过后正常培养24 h,将细胞培养液更换为含有对照药物溶剂二甲亚砜(Dimethyl Sulphoxide,DMSO)或含有DMSO-顺铂的新鲜完全培养液,其中顺铂终浓度为10 μg/ml,继续培养24 h;取出顺铂处理后的细胞,进行蛋白提取或细胞凋亡检测。
1.2.4 蛋白质印迹法检测蛋白表达水平 按照蛋白提取试剂盒说明书提取细胞蛋白后,采用BCA法测定蛋白浓度。依照蛋白质印迹法电泳系统进行SDS-PAGE分离蛋白,每孔上样50 μg。蛋白转印至PVDF膜后5% 脱脂奶粉 TBST溶液室温封闭1 h,一抗(1:500)4℃孵育过夜,TBST漂洗3次,每次15 min。二抗(1:1000)避光室温孵育1 h,TBST漂洗3次,每次15 min。采用百乐ChemiDoc MP全能型凝胶成像分析系统扫摸拍照。利用image J软件分析目的条带灰度值,目的蛋白表达水平以目的蛋白与β-actin的比值表示。
1.2.5 p38δ蛋白磷酸化水平检测 HeLa细胞接种于6孔板后,按照细胞转染所述转染p38δ表达质粒,然后按照1.2.3所述进行顺铂处理。顺铂处理后,除去培养液,冷PBS洗3次, 每孔加入200 μl NP-40 细胞裂解液(1% NP-40,150 mM NaCl,50 mM Tris,1 mM EDTA, pH 8.0,用前加入蛋白酶抑制剂Cocktail),冰浴裂解30 min。收集裂解液, 4℃,14000 ×g,离心15 min。收集上清,取10 μl上清液加入10 μl 2×SDS 上样缓冲液,作为全细胞裂解液(Lysate);其余上清液移入另一EP管中,加入p38δ兔单克隆抗体2 μg,4℃ 旋转结合2 h。加入10 μl protein A/G 磁珠,4℃ 旋转结合1 h。NP-40细胞裂解液洗珠子3次后,加入10 μl 2×SDS 上样缓冲液,振荡混匀,作为免疫沉淀(immuoprecipitation,IP)产物。蛋白质印迹法检测IP产物中p38δ磷酸化蛋白量(p-p38δ)和总p38δ(p38δ)蛋白表达量。p38δ蛋白磷酸化水平以p-p38δ与p38δ比值表示。
1.2.6 Annexin V-FITC/PI 双染荧光显微镜检测细胞凋亡 将HeLa细胞接种于24孔板(105细胞/孔),进行质粒转染及顺铂处理。按照Annexin V-FITC/PI染色细胞凋亡检测试剂盒收集细胞。细胞经PBS清洗后重悬于400 μl Binding buffer(试剂盒提供),然后加入5 μl Annexin V-FITC和10 μl PI染色液,室温染色15 min。按照试剂盒说明书将染色后的细胞重悬于50 μl Binding buffer,取5 μl重悬液滴于干净载玻片并扣盖盖玻片,荧光显微镜下观察并拍照,其中Annexin V-FITC采用波长488 nm激发光,PI采用波长568 nm激发光。Anneixn V阳性细胞代表凋亡发生细胞。采用image J软件对细胞进行计数。本实验细胞凋亡水平以Anneixn V阳性细胞百分数表示。
1.3 统计学分析 数据处理用SPSS17.0统计软件,计量资料以均数±标准差((x ±s)表示,比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 HeLa细胞转染后其p38δ蛋白表达水平升高 蛋白质印迹法结果显示,转染对照质粒pcDNA3.1(+)-Vector HeLa细胞中,p38δ表达水平极低;转染p38δ表达质粒pcDNA3.1(+)-p38δ HeLa细胞中,p38δ成功高表达,见图1。
2.2 p38δ过表达促进HeLa细胞凋亡 Annexin V-FITC/PI双染色荧光显微镜细胞凋亡检测实验结果显示:在对照处理条件下(DMSO组),转染pcDNA3.1(+)-Vector 质粒 的HeLa细胞和转染pcDNA3.1(+)-p38δ质粒的HeLa细胞凋亡水平分别是(7.95±2.33)%和(37.19±4.71)%,经t检验,差异有统计学意义(t=18.043,p =0.003),后者细胞凋亡水平显著上升。在顺铂处理条件下(Cisplatin组),转染pcDNA3.1(+)-Vector质粒的 HeLa细胞和转染pcDNA3.1(+)-p38δ质粒的HeLa细胞凋亡水平分别是(23.14±2.71)%和(53.02±4.69)%,经t检验,差异有统计学意义(t=7.095,p =0.019),后者细胞凋亡水平也显著上升,见图2。
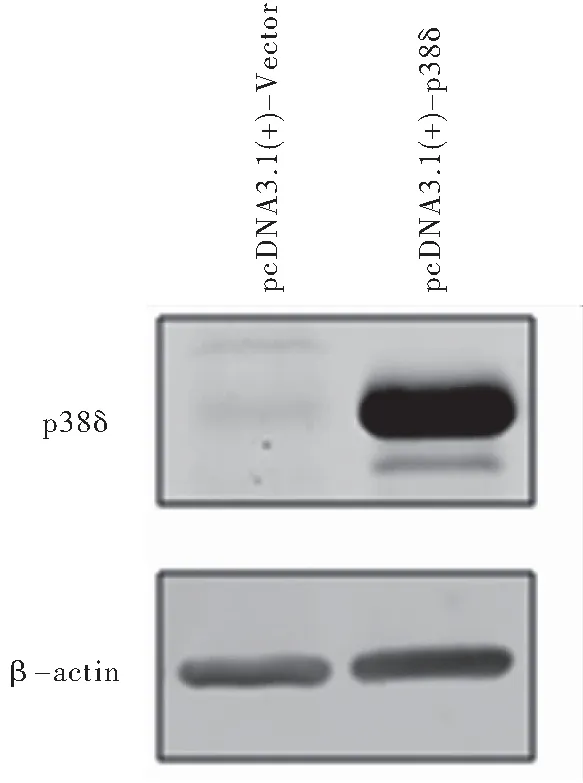
图1蛋白印迹法检测HeLa细胞转染后p38δ表达水平
Figure1Theexpressionofp38δinHeLacellsaftertransfectedindicatedplasmids
注:pcDNA3.1(+)-Vector: 对照质粒; pcDNA3.1(+)-p38δ: p38δ表达质粒
2.3 HeLa细胞中p38δ过表达上调顺铂处理条件下Bax和p53蛋白表达水平,同时下调Bcl-2蛋白表达水平 蛋白质印迹法结果显示:在对照处理条件下(DMSO组),与转染pcDNA3.1(+)-Vector HeLa细胞相比,转染pcDNA3.1(+)-p38δ HeLa细胞中Bcl-2和Bax蛋白表达水平变化不大,差异无统计学意义(P>0.05),而p53蛋白表达水平增加,差异有统计学意义(t=9.123,P=0.012);在顺铂处理条件下(Cisplatin组),与转染pcDNA3.1(+)-Vector HeLa细胞相比,转染pcDNA3.1(+)-p38δ HeLa细胞中: Bcl-2蛋白表达水平显著降低,差异有统计学意义(t=100.736,P<0.001); Bax蛋白表达水平显著上升,差异有统计学意义(t=17.761,P=0.003)(图3A、表1); p53蛋白表达水平显著上升,差异有统计学意义(t=13.524,p =0.005)(见图3A、表1)。此外,不同浓度顺铂处理结果显示,随着顺铂作用浓度增高,转染pcDNA3.1(+)-p38δ HeLa细胞中Bax、p53蛋白表达水平随之增加,而Bcl-2蛋白表达水平变化不大,见图3B。

图2 p38δ过表达对HeLa细胞凋亡的影响Figure 2 The effect of p38δ overexpression on apoptosis of HeLa cells
注: pcDNA3.1(+)-Vector. 转染对照质粒; pcDNA3.1(+)-p38δ.转染p38δ表达质粒 ;DMSO.对照处理;Cisplatin.顺铂处理(10 ug/ml,24h);标尺长度代表300 uM

图3 p38δ过表达对HeLa 细胞凋亡相关基因蛋白表达水平的影响Figure 3 The effect of p38δ overexpression on the protein expression of apoptosis related genes in HeLa cells
注:A. 转染不同质粒的HeLa细胞经对照处理或顺铂处理(10 ug/ml,24 h)后,蛋白印迹法检测Bcl-2、Bax和p53蛋白表达水平;B.转染不同质粒的HeLa细胞经不同浓度顺铂处理24 h后,蛋白印迹法检测Bcl-2、Bax和p53蛋白表达水平; pcDNA3.1(+)-Vector: 转染对照质粒; pcDNA3.1(+)-p38δ: 转染p38δ表达质粒 ;DMSO:对照处理;Cisplatin:顺铂处理
2.4 顺铂处理上调p38δ磷酸化水平 对照处理HeLa细胞中(DMSO组),p38δ第180位苏氨酸/ 182位酪氨酸(T180/Y182)磷酸化水平(p-p38δ(T180/Y182)/ p38δ)为0.28±0.02;顺铂处理HeLa细胞中(Cisplatin 组),p38δ T180/Y182磷酸化水平为0.83±0.01。经t检验,差异有统计学意义(t=34.676, p =0.001),Cisplatin 处理后p38δ T180/Y182磷酸化水平显著上升,见图4。

图4 顺铂处理对 p38δ磷酸化水平的影响Figure 4 the effect of cisplatin on p38δphosphorylation
注:IP.免疫沉淀组分;Lysate.全细胞裂解液组分; DMSO.对照处理;Cisplatin.顺铂处理(10 ug/ml,24h)
2.5 p38δ调控HeLa细胞凋亡依赖于其蛋白激酶活性 蛋白质印迹法结果显示,HeLa细胞转染p38δ野生型表达质粒pcDNA3.1(+)-p38δ(WT)和p38δ激酶失活突变体表达质粒pcDNA3.1(+)-p38δ(K54R)后, p38δ(WT/K54R)在HeLa细胞中成功高表达(见图5A)。Annexin V-FITC/PI双染色荧光显微镜细胞凋亡检测实验结果显示:在正常培养条件下,HeLa细胞转染p38δ野生型表达质粒pcDNA3.1(+)-p38δ(WT)和p38δ激酶失活突变体表达质粒pcDNA3.1(+)-p38δ(K54R)后细胞凋亡水平分别是(36.88±2.69)%和(9.32±2.03)%,经t检验,差异有统计学意义(t=43.899,p =0.001),激酶失活突变体p38δ(K54R)能够显著降低HeLa细胞凋亡水平(见图5B);在顺铂处理条件下,转染p38δ野生型表达质粒pcDNA3.1(+)-p38δ(WT)的HeLa细胞凋亡水平和转染p38δ激酶失活突变体表达质粒pcDNA3.1(+)-p38δ(K54R)的HeLa细胞凋亡水平分别是(54.88±4.21)%和(25.71±3.23)%,经t检验,差异有统计学意义(t=15.932, p =0.004),激酶失活突变体p38δ(K54R)同样能够显著降低HeLa细胞凋亡水平(见图5C)。
3 讨论
3.1 p38δ促进HeLa细胞凋亡并增强其对顺铂的敏感性 Yong 等[9]克隆鉴定p38δ时指出,在宫颈癌HeLa细胞中p38δ低表达。本实验采用脂质体转染表达质粒的方法,在HeLa细胞中成功高表达p38δ;同时发现在HeLa细胞中内源性p38δ表达水平极低,这与Yong 等[9]研究结果一致。p38家族蛋白激酶参与众多细胞行为的调控,如细胞增殖、细胞凋亡等等。最近研究表明p38δ在细胞凋亡方面也有重要的调控作用。在角质细胞中,软海绵酸可以激活p38δ,并且诱导角质细胞凋亡[11]。另外,在食管鳞状细胞癌中过表达p38δ将会提高细胞在顺铂处理条件下的凋亡水平,从而提高细胞对顺铂的敏感度[7]。本研究结果显示,当HeLa细胞中过表达p38δ蛋白时,细胞的凋亡水平明显上升,这与p38δ在角质细胞中调控细胞凋亡的功能一致。在肿瘤治疗方面,癌细胞对化疗药物诱导细胞凋亡的耐受,一直是困扰癌症治疗的临床问题[12]。本研究中检测了p38δ对顺铂诱导HeLa细胞凋亡的影响,实验结果表明,HeLa细胞中过表达p38δ能够显著提高细胞对顺铂的敏感度,促进细胞凋亡。该结果与p38δ对食管鳞状细胞癌细胞凋亡的调控一致。在肿瘤治疗过程中,增强癌细胞对治疗药物的敏感度,提高癌细胞凋亡水平,是获得良好治疗效果的关键。p38δ有望成为宫颈癌辅助治疗的新靶点。
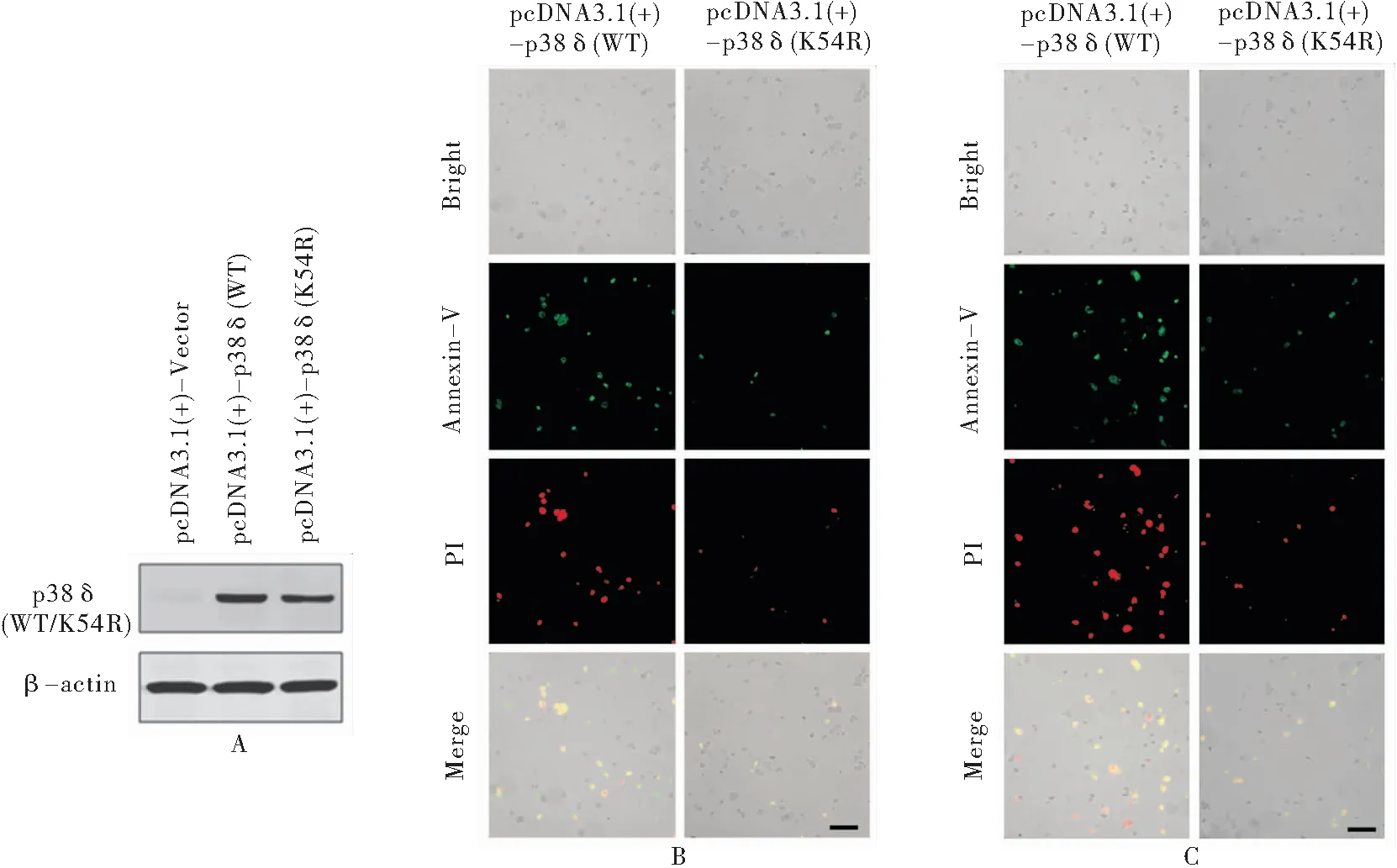
图5 p38δ激酶失活突变体对HeLa细胞凋亡的影响Figure 5 The effect of Kinase-dead mutant of p38δ on HeLa cell apoptosis
注:A.蛋白印迹法检测转染不同质粒的HeLa细胞中p38δ表达水平;B.HeLa细胞转染不同质粒后,Annexin V-FITC/PI双染色和荧光显微镜检测细胞凋亡(标尺长度代表300 uM);C.转染不同质粒的HeLa细胞经顺铂处理(10 ug/ml 24 h)后,Annexin V-FITC/PI双染色和荧光显微镜检测细胞凋亡(标尺长度代表300 uM); pcDNA3.1(+)-Vector. 转染对照质粒; pcDNA3.1(+)-p38δ(WT). 转染野生型p38δ表达质粒 ; pcDNA3.1(+)-p38δ(K54R).转染激酶失活突变体p38δ表达质粒
3.2 p38δ通过上调促凋亡因子蛋白表达水平和下调抗凋亡因子蛋白表达水平调控HeLa细胞凋亡 调控细胞凋亡是众多细胞信号通路相互作用的结果。Bcl-2是一个重要的抗凋亡因子,其表达量下调促进细胞凋亡的发生。与Bcl-2功能相反的Bax蛋白,也可以作为凋亡水平指示因子,其在凋亡信号刺激下,进入线粒体,最终介导线粒体膜间隙的凋亡信使——细胞色素c进入细胞质,激活细胞凋亡进程[13]。宫颈癌细胞经放射治疗后,Bax蛋白表达量升高和Bcl-2表达量降低将会显著提高宫颈癌细胞的凋亡水平[14]。HeLa细胞中,顺铂对细胞凋亡的诱导依赖于Bcl-2基因表达水平的降低和Bax表达水平的上升[15]。毛蕊异黄酮-7--β--葡萄糖苷可以促进HeLa细胞凋亡,同时诱导HeLa细胞中Bcl-2表达量下调和Bax表达量上调[16]。那么,在HeLa细胞中,p38δ调控细胞凋亡是否也与Bcl-2/Bax相关?本实验结果表明,在顺铂处理条件下,p38δ可以显著降低Bcl-2蛋白表达水平,同时提高Bax蛋白表达水平。该结果与前述研究结论一致。该结果提示我们,在HeLa细胞中,p38δ可能通过调控Bcl-2/Bax信号通路来调控细胞的凋亡。线粒体膜间隙细胞色素c的释放是Bcl-2/Bax调控细胞凋亡的关键。有报道指出,在抗癌药物去甲斑蝥素(norcantharidin)诱导HeLa细胞凋亡的过程中,p38介导Bcl-2蛋白表达水平下调、Bax蛋白向线粒体转运及细胞色素c的释放[17]。至于p38δ介导的HeLa细胞凋亡,是否与Bax蛋白向线粒体转运及细胞色素c的释放有关,还需进一步的研究来证明。除了Bcl-2、Bax外,p53蛋白也是一个重要的细胞凋亡调控因子。最近报道指出非编码RNA VTRNA2-1-5p可以通过作用于p53 mRNA的非编码区,而降低p53的表达水平,最终降低宫颈癌细胞的凋亡水平,促进宫颈癌细胞的增殖与侵袭[18]。雷公藤甲素可以诱导HeLa细胞的凋亡,而这一过程依赖于p53和Bax蛋白的表达量上调[19]。另外,在宫颈癌组织中过表达p53蛋白,可以诱导宫颈癌细胞的凋亡,从而提高肿瘤的治疗效果[20]。本实验结果表明,HeLa细胞中过表达p38δ可以诱导p53蛋白表达水平的上升,提示我们在正常培养条件下,p38δ对HeLa细胞的调控可能与p53蛋白表达量的上调有关。另外,本实验发现,在顺铂处理条件下,p38δ可以显著上调HeLa细胞中p53蛋白水平。在紫外照射诱导的细胞凋亡过程中,p38可以磷酸化p53蛋白第33位丝氨酸和46位丝氨酸,促进p53蛋白的稳定,从而促进p53依赖的细胞凋亡发生[21]。在HeLa细胞中,p53也可能是p38δ调控细胞凋亡过程中的直接作用底物。有报道指出,人乳头瘤病毒HPV18基因序列中的癌基因E6可以抑制宫颈癌细胞中p53基因的表达和诱导p53蛋白水平的降低[22-24]。人乳头瘤病毒是诱发宫颈癌的主要因素之一,p38δ表达水平的下调以及p38δ对p53表达水平的调控是否与人乳头瘤病毒有关,还需进一步的研究证明。p53既可以进入细胞核,作为转录因子调控靶基因的表达,又可以游离于细胞质或进入其他细胞器调控其它效应分子的活性或功能。定位于核中的p53蛋白可以诱导凋亡相关基因的表达(如Bax、Noxa);细胞质中的p53可以与抗凋亡因子(如Bcl-2蛋白家族成员)相互作用来减弱后者的抗凋亡功能[25]。这就提示我们,顺铂处理条件下,过表达p38δ的HeLa细胞中,Bcl-2、Bax表达水平的改变,可能是由于p53蛋白直接调控Bcl-2、Bax基因转录水平所致。
3.3 p38δ通过蛋白激酶活性调控HeLa细胞凋亡 蛋白激酶活性是p38家族蛋白行使其调控功能的关键。对于p38家族蛋白而言,位于激酶结构域中苏氨酸-甘氨酸-酪氨酸(TGY)模序的双位点磷酸化(对应于p38δ中第180位的苏氨酸和182位的酪氨酸磷酸化)是其蛋白激酶活性获得的关键[26]。被磷酸化的p38δ获得激酶活性后,通过与底物相互作用,并将后者丝氨酸或苏氨酸磷酸化,从而改变底物的活性或功能,完成对细胞信号的传递。所以,检测p38δ蛋白第180位酪氨酸和182位丝氨酸的磷酸化水平,可以评估p38δ是否被激活。本实验结果表明,顺铂处理可以诱导p38δ磷酸化水平的上调,提示p38δ对HeLa细胞凋亡可能与其蛋白激酶活性相关。另外,本研究进一步发现,激酶失活突变可以显著降低p38δ对HeLa细胞凋亡的促进作用。蛋白激酶对细胞信号的传递往往通过对底物的磷酸化来完成。综上所述,p38δ对宫颈癌HeLa细胞顺铂敏感性的调控可能通过磷酸化Bcl-2、Bax及p53蛋白本身或其上游调控因子来完成,该调控通路的具体分子机制还需进一步的研究来揭示。
4 结论
本研究通过细胞转染和药物处理实验,发现宫颈癌细胞系HeLa细胞中过表达p38δ可以提高HeLa细胞对顺铂的敏感度,促进细胞凋亡,从而为宫颈癌的治疗提供新的方法和思路。
【参考文献】
[1]Igea A, Nebreda A R. The Stress Kinase p38α as a Target for Cancer Therapy[J]. Cancer Res, 2015, 75(19):3997-4002.
[2]Zur R, Garciaibanez L, Nunezbuiza A,etal. Combined deletion of p38γ and p38δ reduces skin inflammation and protects from carcinogenesis[J]. Oncotarget, 2015, 6(15):12920-12935.
[3]Carol O, Fanning L J, Barry O P. Hypermethylation of p38δ Promoter in Oesophageal Squamous Cell Carcinoma Is Associated with Loss of p38δ MAPK Expression[J]. Cancers, 2015, 7(4):2124-2133.
[4]Tan F L, Ooi A, Huang D,etal. p38δ as a diagnostic marker for cholangiocarcinoma and its involvement in cell motility and invasion[J]. Int J Cancer, 2010, 126(10):2353-2361.
[5]Yasuda K, Hirohashi Y, Kuroda T,etal. MAPK13 is preferentially expressed in gynecological cancer stem cells and has a role in the tumor-initiation[J]. Biochem Biophys Res Commun, 2016, 472(4):643-647.
[6]O'Callaghan C, Fanning L J, Houston A,etal. Loss of p38δ mitogen-activated protein kinase expression promotes oesophageal squamous cell carcinoma proliferation, migration and anchorage-independent growth[J]. Int J Oncol, 2013, 43(2):405.
[7]O’Callaghan C, Fanning L J, Barry O P. p38δ MAPK phenotype: an indicator of chemotherapeutic response in oesophageal squamous cell carcinoma[J]. Anticancer Drugs, 2015, 26(1):46-55.
[8]Gao L, Smit M A, Oord J J V D,etal. Genome-wide promoter methylation analysis identifies epigenetic silencing of MAPK 13, in primary cutaneous melanoma[J]. Pigment Cell Melanoma Res, 2013, 26(4):542-554.
[9]Yong J, Gram H, Ming Z,etal. Characterization of the Structure and Function of the Fourth Member of p38 Group Mitogen-activated Protein Kinases, p38δ[J]. J Biol Chem, 1997, 272(48):30122-30128.
[10] Alonso G, Ambrosino C, Jones M,etal. Differential activation of p38 mitogen-activated protein kinase isoforms depending on signal strength[J]. J Biol Chem, 2000, 275(51): 40641-40648.
[11] Kraft C A, Efimova T, Eckert R L. Activation of PKCdelta and p38δ MAPK during okadaic acid dependent keratinocyte apoptosis[J]. Arch Dermatol Res, 2007, 299(2):71-83.
[12] Dasgupta A, Nomura M, Shuck R,etal. Cancer’s Achilles’ Heel: Apoptosis and Necroptosis to the Rescue[J]. Int J Mol Sci, 2016, 18(1): 23.
[13] Czabotar P E, Lessene G, Strasser A,etal. Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy.[J]. Nat Rev Mol Cell Biol, 2014, 15(1):49..
[14] Harima Y, Harima K, Shikata N,etal. Bax and Bcl-2 expressions predict response to radiotherapy in human cervical cancer[J]. J Cancer Res Clin Oncol, 1998, 124(9):503-510.
[15] Liu J, Yang L, Zhang J,etal. Knock-down of NDRG2 sensitizes cervical cancer HeLa cells to cisplatin through suppressing Bcl-2 expression[J]. BMC Cancer, 2012, 12(1):1-8.
[16] 张冬梅. 毛蕊异黄酮-7-O-β-D-葡萄糖苷对人宫颈癌HeLa细胞凋亡及Bcl-2/Bax表达的影响[J]. 中草药, 2015, 46(10):1498-1502.
[17] Dong X, Li JC, Jiang YY,etal. p38-NF-κB-promoted mitochondria-associated apoptosis and G2/M cell cycle arrest in norcantharidin-treated HeLa cells[J]. J Asian Nat Prod Res, 2012, 14(11):1008-1019.
[18] Kong L, Hao Q, Wang Y,etal. Regulation of p53 expression and apoptosis by vault RNA2-1-5p in cervical cancer cells[J]. Oncotarget, 2015, 6(29):28371-28388.
[19] 张斌, 王蕴非, 赵飞,等. 雷公藤甲素诱导HeLa细胞p53依赖的自噬和凋亡[J]. 生物化学与生物物理进展, 2016(6):599-606.
[20] Hamada K, Alemany R, Zhang W W,etal. Adenovirus-mediated transfer of a wild-type p53 gene and induction of apoptosis in cervical cancer[J]. Cancer Res,, 1996, 56(13):3047-3054.
[21] Bulavin D V, Saito S, Hollander M C,etal. Phosphorylation of human p53 by p38 kinase coordinates N‐terminal phosphorylation and apoptosis in response to UV radiation[J]. EMBO J, 1999, 18(23):6845-6854.
[22] Benatti P, Basile V, Dolfini D,etal. NF-Y loss triggers p53 stabilization and apoptosis in HPV18-positive cells by affecting E6 transcription[J]. Oncotarget, 2016, 7(29):45901-45915
[23] Li Y, Qi H, Li X,etal. A novel dithiocarbamate derivative induces cell apoptosis through p53-dependent intrinsic pathway and suppresses the expression of the E6 oncogene of human papillomavirus 18 in HeLa cells[J]. Apoptosis, 2015, 20(6):787-795.
[24] Dang YP, Yuan X, Tian R,etal. Curcumin improves the paclitaxel-induced apoptosis of HPV-positive human cervical cancer cells via the NF-κB-p53-caspase-3 pathway[J]. Exp Ther Med, 2015, 9(4):1470-1476.
[25] Haupt S, Berger M, Goldberg Z,etal. Apoptosis-the p53 network[J]. J Cell Sci, 2003, 116(20):4077-4085.
[26] Goedert M, Cuenda A, Craxton M,etal. Activation of the novel stress‐activated protein kinase SAPK4 by cytokines and cellular stresses is mediated by SKK3 (MKK6); comparison of its substrate specificity with that of other SAP kinases[J]. EMBO J, 1997, 16(12):3563-3571.

