降钙素基因相关肽和腺苷2A受体在偏头痛模型大鼠中的表达及作用机制*
母发光 邹撰 周超然 欧阳颖
(四川省医学科学院·四川省人民医院,四川 成都 610072)
偏头痛是一种慢性中枢神经血管性疾病,由于生活环境逐渐改变及精神压力增大等因素,偏头痛的发病率逐年增长,并可能严重影响患者工作和生活质量。但目前该病发病机制尚未完全研究清楚[1]。三叉神经血管学说在当今学术界对偏头痛的研究中占主导地位,降钙素基因相关肽(calcitonin gene related peptide,CGRP)主要是由三叉神经节的神经末梢分泌、释放。它是目前所知最强的内源性舒血管物质,CGRP水平与偏头痛发作明确相关[2]。腺苷是一种重要的神经调质,它的受体(adenosine receptor,AR)包括四种亚型,即为A1R、A2AR、A2BR、A3R。其中,A2AR与偏头痛的关系最为密切,不同类型的偏头痛患者的A2AR基因分析,证实该基因的变异可能与偏头痛的发生有关。A2AR激活后可促进神经元CGRP的释放,还能增强CGRP对神经突触间兴奋传递的易化作用[3]。硝酸甘油(Nitroglycerin,NTG)偏头痛模型大鼠与人类偏头痛发作的临床表现相近,是目前研究偏头痛发生机制常用实验动物模型[4]。故本研究通过建立硝酸甘油(nitroglycerin,NTG)偏头痛模型大鼠,检测CGRP及A2AR在模型大鼠三叉神经组织中的表达,以探讨偏头痛的发病机制。
1 材料与方法
1.1 实验仪器和试剂
1.1.1 实验仪器 荧光显微镜(日本 Nikon 公司);X射线摄行暗匣(广东粤华医疗器械厂);电泳仪、电泳槽和转膜系统(美国 Bio-Rad 公司);Image-Pro Plus 6.0图像分析仪(美国Media Cybernetics公司)。
1.1.2 实验试剂 硝酸甘油注射液(北京益民药业有限公司,产品批号:H11020289),CGRP受体抗体(博奥森生物技术有限公司,产品批号:bs-10639R),A2A受体抗体(美国Santa Cruz公司,产品批号:byk-1456R),BCA蛋白质定量测定试剂盒(江苏碧云天生物有限公司,产品批号:P0010S),细胞膜蛋白与细胞浆蛋白提取试剂盒(江苏碧云天生物有限公司,产品批号:P0033)4%多聚甲醛(博士德生物工程有限公司,产品批号:AR1068),四甲基乙二胺(TEMED)(美国Sigma公司,批号:023k0016)。
1.2 方法
1.2.1 实验动物分组及动物模型制备 清洁级健康SD雄性大鼠30只,平均体重200±20克,雌雄各半。由四川省医学科学院.四川省人民医院动物实验中心提供,合格许可证号:SYXK(川)2008-110。自由饮食,分笼喂养。将所有大鼠按随机数字表法随机分为空白对照组、模型组,每组各10只。模型组按TassorelliCristina法[5]在大鼠颈背部皮下注射硝酸甘油(NTG)10mg/Kg,空白对照组则生理盐水(NS)10ml/Kg皮下注射,每周注射1次,共5周。注射NTG约数分钟的大鼠表现出极度的烦躁不安,并出现耳朵发红、搔头、攀爬鼠笼的次数增加甚至咬尾等行为,这些行为约持续3~5小时后逐渐消退,大鼠继而出现蜷卧,活动明显减少。空白对照组则仅在注射NS后数分钟内表现为烦躁不安随后恢复平静,无耳红、搔头等现象出现。对各组大鼠进行行为学评分,总分达6分或以上的可视为造模成功[6,7]。
1.2.2 标本的采集和处理 两组大鼠进行行为学评分后,对大鼠予以10%水合氯醛3ml/kg经大鼠腹部注入体内,等待数分钟将大鼠完全麻醉后固定于手术台,开颅剥去表面的硬脑膜,将大脑组织翻起,暴露颅底的三叉神经节,取三叉神经节及三叉神经颈复合体部分放入 4% 多聚甲醛中固定,4℃保存;另一部组织液氮保存备用。
1.2.3 检测方法
1.2.3.1 HE染色检测三叉神经节组织学结构 取出固定液中的三叉神经节组织,依次置于不同浓度的乙醇中脱水,脱水后的将组织用石蜡包埋后制成厚度约5μm的切片。切片经脱蜡、水化,苏木精复染,盐酸酒精分色,氨水返蓝,脱水,中性树脂封片。最后在100和400倍光镜下观察切片中三叉神经节组织学结构。
1.2.3.2 免疫组化检测CGRP的表达 将三叉神经节标本,从4%多聚甲醛固定液中取出,脱水,石蜡包埋,切片,将其平展贴于硌矾明胶处理过的载玻片上。作免疫组化时,脱蜡,水化,封闭,修复。滴加兔抗大鼠(CGRP抗体,一抗,1:200),滴加生物素羊抗兔(二抗,1:200)50μl/切片,滴加约50μl辣根过氧化物酶标记的链亲和素。DAB显色,封片。最后把制作好的玻片放在×400光镜下观察、采图(如组图6),并使用Image-pro plus 6.0图像分析系统上对标本进行分析,以分泌CGRP的阳性细胞的平均光密度(OD)来表示CGRP的分布及含量。
1.2.3.3 免疫荧光检测A2AR的表达 标本制片、水化,滴加山羊血清封闭,加入 1:2000 的A2AR兔多克隆抗体,滴加用FITC标记稀释(1:100)后的羊抗兔IgG(二抗),充分反应后封片;将制作好的载玻片放于荧光显微镜下用OLYMPUS BX51 观察拍片,同时用PBS做背景对照,在镜下表达A2AR的阳性细胞呈现绿色,用蓝色荧光染料DAPI特异与神经元DNA结合,明确组织中的神经细胞数及分布情况与表达绿色的A2AR的阳性细胞作对照,最后在×200镜下记录每个标本的表达A2AR阳性细胞数,见图3。
1.2.3.4 Western blot检测A2ARD的表达 取出液氮中的组织样本,研钵中撵碎后,用预冷的PBS溶液洗2次;加入10ul/100mg组织蛋白裂解液,再加入lml/l00mg的PMSF,分装于EP管;置于在冰浴中30min充分裂解蛋白,震荡仪震荡混匀;4℃下 11000转/分,离心10-20min,将上清液分装于0.5ml EP管中,行SDS-PAGE蛋白电泳,转膜、封闭、抗原抗体反应及显色。重复实验3次后,使用Quantity One图像分析软件测量条带的光密度值,A2ARD的相对表达丰度则以靶蛋白灰度/β-actin灰度比值表示。
1.3 统计学分析 采用 SPSS 17.0 统计学软件对数据进行分析处理,符合正态分布资料以±s表示,两组间均数的比较采用t检验。取检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 三叉神经节组织HE染色结果 模型组和对照组大鼠三叉神经节组织HE染色后光镜下不同倍数的对照比较,两组均显示神经元与神经纤维分布正常、无紊乱,解剖结构完整,无异常改变。提示:模型偏头痛大鼠三叉神经没有发生明显器质性病变,其行为改变可能是功能性的异常引起,见图1。

图1 三叉神经组织HE染色Figure 1 HE staining of trigeminal ganglion
2.2 两组大鼠三叉神经组织中A2AR表达
2.2.1 Western-blot检测结果模型组与对照组A2AR蛋白表达,模型组A2AR蛋白表达量高于对照组。模型组灰度值高于对照组,差异均有统计学意义(P<0.01),见图2。
2.2.2 三叉神经组织中A2AR表达Western-blot蛋白定量灰度值测定结果,对照组为(59.48±5.58)%,模型组为(145.96±8.45)%,两组比较,P<0.01。
2.2.3 三叉神经组织中A2AR表达蛋白免疫荧光测定结果 表示神经细胞中的DNA分布(蓝色荧光)情况,绿色荧光部分则表示A2AR在三叉神经各神经元中的表达分布情况。对比观察两组绿色荧光部分发现:模型组中的A2AR蛋白所代表的绿色荧光部分面积明显大于对照组,见图3。

图2两组三叉神经节中A2AR蛋白表达的Western-blot结果
Figure2Theresultofwestern-blottotestexpressionofA2ARinthetwogroups
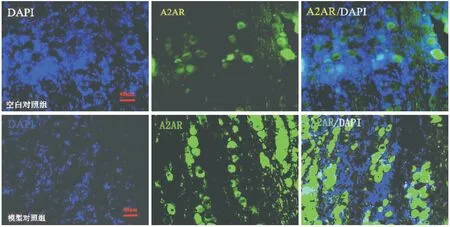
图3 免疫荧光检测大鼠三叉神经节中A2AR蛋白表达情况(n=10,标尺均为40μm)Figure 3 The expression of A2AR protein in immune fluorescence detection in rat trigeminalganglion
2.2.4 通过免疫荧光记录两组三叉神经节上A2AR阳性神经元细胞数及CGRP的OD值比较模型组A2AR阳性神经元细胞数与对照组比较,模型组明显高于对照组P<0.01,差异有统计学意义,模型组CGRP的OD值明显高于对照组(P<0.01),见表1。
2.3 三叉神经组织中CGRP含量免疫组织化学测定(SP法)结果 光镜观察显示对照组中神经元中CGRP含量少,密度低;模型组中CGRP分布丰富,密度高,见图4。
表1两组三叉神经节A2AR阳性神经元细胞数及CGRP的OD值比较
Table1ThenumberofA2ARpositiveneuronsintrigemianlganglionindifferentgroups

组别nA2AR细胞数CGRP/OD对照组1535.73±3.680.15±0.022模型组1577.64±3.93*0.41±0.027t30.1527.23PP<0.01P<0.01
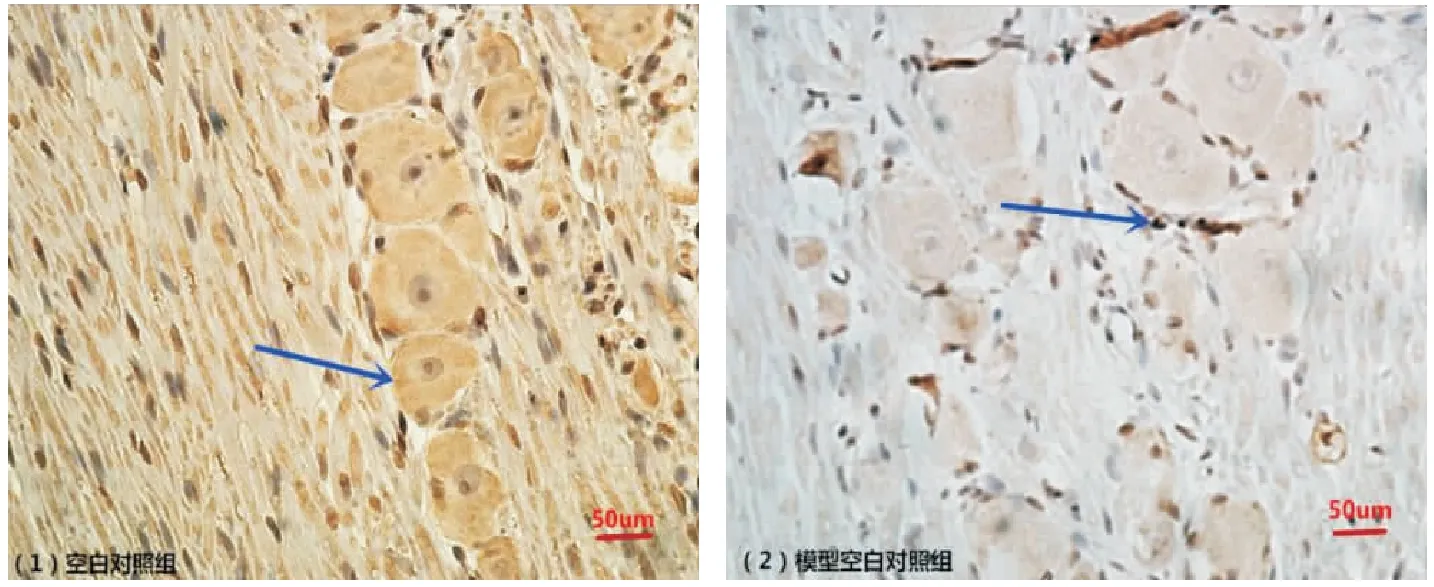
图4 两组大鼠三叉神经节中CGRP分布情况Figure 4 The distribution of CGRP in trigeminal ganglion of rats in each group(IHC,×400,bar=50μm)注:免疫组化,×400,箭头所示为CGRP所分布的神经元,标尺=50μm
3 讨论
偏头痛是一种临床常见的具有明显家族聚集性的血管-神经性头痛,发作时为单侧或双侧搏动性头痛且发作频繁。其的发作机理仍不明确。三叉神经血管学说主要是指中枢血管强烈扩张时,经过一系列病理生理过程,最终导致神经源性炎症,进而引起偏头的发作[1.8]。硝酸甘油在体内分解成一氧化氮(NitrcOxide,NO)。NO能激活平滑肌细胞内腺昔酸环化酶,使环鸟苷酸增高,松弛血管平滑肌和使血管舒张,产生即发性头痛反应,激发三叉神经一血管反射,诱导C-fos的表达,产生迟发性头痛反应,人类偏头痛的各种临床症状投影到偏头痛模型大鼠身上则表现为用前肢抓挠头、耳红、咬尾、攀笼、来回走动等行为[9]。本研究中模型组按在大鼠颈背部皮下注射硝酸甘油(NTG)每周注射1次,5周后出现以上发作。说明模型制作是成功的。本实验的研究结果发现,模型组和空白组大鼠三叉神经节组织HE染色后光镜下不同倍数的对照比较,两组均显示神经元与神经纤维分布正常、无紊乱,解剖结构完整,无异常改变。提示:模型偏头痛大鼠三叉神经没有发生明显器质性病变,其行为改变可能是功能性的异常引起。
研究偏头痛相关活性物质表达有助于探究发病机制及药物研发。目前国内外对CGRP和A2AR两种活性物质在偏头痛发病过程中的变化是研究的热点。A2AR是一种G蛋白偶联受体,广泛分布于中枢神经中,它主要是通过与不同种类的G蛋白或蛋白激酶相偶联,发挥不同的生物学效应[10]。本实验模型制作成功后,三叉神经节中A2AR蛋白表达的Western-blot量及灰度值、免疫荧光测定、A2AR阳性神经元细胞数的测定结果:模型组A2AR表达量明显高于对照组大鼠。说明A2AR参与了偏头痛的发生和发展过程。它可能参与偏头痛的作用机制是:①可以直接介导促进兴奋性氨基酸的释放,提高神经敏感性,诱发偏头痛;②与G蛋白(Gs)相偶联使腺苷环化酶(AC)活性增高,促进cAMP蛋白合成,激活蛋白激酶A(PKA)或激活Ras/Raf-1/MEK/ERK的信号传导途径引起硬脑膜血管扩张;③位于大脑皮层突触前的A2AR激活后可抑制L、N型Ca2+通道,抑制Ca2+的内流,减少细胞内Ca2+浓度,进而可增加兴奋性氨基酸的释放,增强膜的去极化作用使神经元兴奋性升高,舒张血管平滑肌,引起偏头痛[11]。
CGRP它具有介导细胞内第二信使c-AMP的作用,目前已知c-AMP的升高程度与血管舒张反应的强弱强度密切相关,是目前已知脑循环中作用最强的内源性血管舒张肽,是三叉神经微循环激活中的标志物质[12]。三叉神经节CGRP免疫组化表达水平及OD值结果:模型组CGRP及OD值的表达水平明显高于对照组。说明CGRP也参与了偏头痛的发生和发展过程。它诱导偏头痛发生的作用机制主要包括以下几方面:①三叉神经末梢释放的CGRP激活神经元中的N、P型电压敏感性钙离子通道促进Ca2+内流或细胞膜对Ca2+的通透性,直接引起硬脑膜血管的剧烈扩张[13,14]。钙离子通道阻滞剂能够有效抑制脑细胞内的钙离子释放与异常的钙离子内流,舒张血管与平滑肌, 从而解除血管与平滑肌痉挛, 最终达到止痛的目的。②CGRP刺激与其邻近的肥大细胞,促使肥大细胞脱颗粒作用,继而诱发神经源性炎症。除此之外肥大细胞还可以释放出多种如前列腺素、组胺5-HT等的神经血管活性物质,此过程就如一种正反馈机制引起CGRP在神经元中的持续释放,从而引起偏头痛的长期发作[15]。5-HT 受体拮抗药,作用于中枢神经系统和三叉神经中受体介导的神经通路, 逆转偏头痛发作时血中CGRP的增加。通过阻断神经源性炎症起到治疗偏头痛的作用。③大量的CGRP 受体存在卫星胶质细胞中,促进卫星胶质细胞激活和提高其致敏的作用,同时会有利于CGRP 本身的合成和释放,进一步提高和维持神经敏感性和炎症状态[16]。
本实验的研究结果发现在大鼠偏头痛发作时,三叉神经节中A2AR的蛋白表达量和CGRP的含量均升高,提示A2AR和CGRP两者之间量的变化趋势一致。大量的研究证实在海马CAl区使用CGRP刺激兴奋性突触后电位并未发生变化,而当应用A2AR激动剂后,发现兴奋性突触后电位较前明显升高,而此时再加入A2AR抑制剂后,兴奋性突触后电位被明显抑制[17,18]。阻断A2AR或者利用腺苷水解酶清除细胞外腺苷都将会阻断CGRP对神经突触的兴奋性传递作用[19,20]。说明A2AR可能促进大脑血管周围三叉神经CGRP的释放及增强CGRP的神经突触传递作用,共同导致偏头痛的发作。
4 结论
本文资料提示,两组大鼠三叉神经组织无解剖结构上的改变,大鼠行为学改变与三叉神经功能异常有关。表现为A2AR的激活或蛋白上调,CGRP大量释放,A2AR和CGRP两者之间量的变化趋势一致。A2AR、CGRP可能在偏头痛的发作中发挥重要作用。
【参考文献】
[1]于生元,于挺敏,万琪,等.中国偏头痛诊断治疗指南[J].中国疼痛医学杂志,2016,22(10) : 721-727.
[2]王卓群,姚刚,赵继福,等. 降钙素基因相关肽与偏头痛研究进展[J].中华临床医师杂志(电子版),2013,7(22):10209-10211.
[3]Fried NT, Elliott MB, OshinskyML.The Role of Adenosine Signaling in Headache: A Review[J].Brain Sciences,2017, 7 (3) :30.
[4]陈敏,于生元.慢性偏头痛动物模型研究进展[J].解放军医学院学报, 2016,37(3):286-297.
[5]Tassorelli C, Greco R, Morazzoni P,etal. Parthenolide is the component of tanacetum parthenium that inhibits nitroglycerin-induced Fos activation: studies in an animal model of migraine[J]. Cephalalgia,2005,25:612-621
[6]付先军, 宋旭霞, 周永红, 等. 硝酸甘油型实验性偏头痛大鼠模型行为症状学评价[J]. 中华神经医学杂志, 2005,4(5): 449-451.
[7]Pradhan AA,Smith ML,Mcguire B,etal. Characterization of a novelmodel of chronic migraine[J]. Pain,2014,155(2):269-274.
[8]Gasparini CF, Sutherland HG, Griffiths LR. Studies on thepathophysiology and genetic basis of migraine[J]. CurrentGenomics, 2013, 14(5): 300-315.
[9]张帆.近十年偏头痛与三叉神经血管疼痛通路解剖研究进展[J].中国疼痛医学杂志2014,20 (12):889-891
[10] SawynokJ. Adenosine receptor targets for pain[J]. Neuroscience,2015, 338:1-18.
[11] Lu W, Li B, Chen J,etal. Expression of calcitonin gene-related peptide, adenosine A2a receptor and adenosine A1 receptor in experiment rat migraine models[J].Biomedical Reports,2016,4(3):379-383.
[12] Paul LDurham, PhD,Caleb G,etal.Two Mechanisms Involved in Trigeminal CGRP Release:Implications for Migraine Treatment[J]. Headache, 2013;53:67-80
[13] MillerS,Liu,H, WarfvingeK,etal.Immunohistochemical localization of the calcitonin gene-related peptide binding site in the primatetrigeminovascular system using functional antagonist antibodies[J].Neuroscience,2016,328:165-183.
[14] Edvinsson, L.CGRP receptor antagonists and antibodies against CGRP and its receptor in migraine treatment [J].British Journal of Clinical Pharmacology,2015,80(2):193-199.
[15] Hougaard A,Tfelt-Hansen P. Review of dose-response curves for acute antimigraine drugs: triptans,5-HT1F agonists and CGRP antagonists[J]. Expert Opin Drug MetabToxicol, 2015,11(9):1409-1418.
[16] Durham P L. Diverse Physiological Roles of Calcitonin Gene-Related Peptide in Migraine Pathology: Modulation of Neuronal-Glial-Immune Cells to Promote Peripheral and Central Sensitization[J]. Current pain and headache reports,2016,20(8):48.
[17] RomboDM,NewtonK,Nissen W,etal.Synaptic mechanisms of adenosine A2A receptor-mediated hyperexcitability in the hippocampus. [J]. Hippocampus,2015,25(5):566-580.
[18] 李斌,陈金波,宋晓文.侧脑室注射腺苷A1 受体激动剂对硝酸甘油偏头痛模型大鼠的影响[J]. 中风与神经疾病杂志, 2016,33 (12):1091-1094.
[19] Rodrigues TM,Jeronimo-Santos A,Sebastiao AM,etal. Adenosine A(2A) Receptors as novel upstream regulators of BDNF-mediated attenuation of hippocampal Long-Term Depression (LTD) [J]. Neuropharmacology,2014,79:389-398.
[20] 韩喜梅,姚刚,满玉红,等. 都梁软胶囊对偏头痛模型大鼠中脑CGRP及CCK表达的影响[J].重庆医学,2016,45(27):3760-3762.

