宫颈癌患者手术前后血清及病变组织AGR2水平变化及其临床意义
王钧 李蔚范
(1.北京市丰台中西医结合医院妇产科,北京 100072;2.北京大学肿瘤医院妇科,北京 100142)
宫颈癌是常见的妇科恶性肿瘤之一,我国72个肿瘤登记地区宫颈癌发病率为12.96/10万,死亡率为3.28/10万,宫颈癌发病率和死亡率均随着年龄的增加而增加[1]。随着分子生物学的发展,一些与肿瘤预后有关的血清学指标受到越来越多的重视。血清前梯度蛋白2(anterior gradient-2,AGR2)是从乳腺癌细胞系MCF7的cDNA文库中筛选出非洲爪蟾AGR2的同源基因[2]。AGR2在多种恶性肿瘤中过量表达,与肿瘤的发生、发展密切相关,是一个潜在的早期诊断、疗效及预后判断的标志性基因[3-5]。目前有关AGR2在宫颈癌中的临床意义尚不清楚,相关的报道极少。本研究通过检测宫颈癌患者手术前后血清及病变组织AGR2水平变化,分析其与宫颈癌临床病理特征的关系,为AGR2辅助诊断宫颈癌及疗效、预后判断提供一定的参考依据。
1 资料与方法
1.1 一般资料 选取从2014年6月~2016年6月在我院就诊并经手术治疗、术后病理确诊的宫颈癌30例(宫颈癌组)及宫颈上皮内瘤样病变(CIN)患者(CIN组)20例。纳入标准:①首次经病理学确诊的原发性宫颈癌。②术前未接受放化疗及其他辅助抗肿瘤治疗,无其他系统肿瘤病史。③患者均知情同意并自愿参加。年龄51~67岁,平均年龄(52.7±8.3)岁。宫颈瘤组病理类型:鳞癌26例,腺癌4例。肿瘤大小:肿瘤直径≤4cm 21例,>4cm 9例;FIGO分期:I期19例,II期11例;分化程度:高分化4例,中分化15例,低分化11例;淋巴结转移:有淋巴结转移4例,无淋巴结转移26例。CIN组20例,其中,CIN II级7例,CIN III级13例,年龄43~64岁,平均年龄(50.4±5.8)岁。另外采集20例在我院健康体检妇女血清标本以及20例因子宫肌瘤行全子宫切除术的正常宫颈组织标本为正常对照组。
1.2 方法
血清及病变组织AGR2水平检测宫颈癌组及CIN组患者于手术前和手术后1周、健康体检(对照组)女性于清晨采集空腹静脉血3mL,3000r/min,离心10min,取上清置于-80℃冰箱保存,集中检测。术中将切除的新鲜宫颈病变组织生理盐水冲洗后放入预冷的塑料瓶,投入液氮中保存。从液氮中取出组织标本,用预冷的粉碎器将标本粉碎,用天平称取100mg标本,放入匀浆缓冲液试管中,制成匀浆,4℃条件下,5000r/min,离心15min,取上清置于-80℃冰箱保存,集中检测。病变组织前梯度蛋白2(AGR2)和酶联免疫吸附法(ELISA) 试剂盒购自北京易科攀博生物科技有限公司,采用酶联免疫吸附法测定AGR2水平,按试剂盒说明书严格操作。

2 结果
2.1 手术前后宫颈癌及CIN患者血清及病变组织中AGR2水平的比较 宫颈癌组患者手术前血清及癌组织AGR2水平明显高于CIN组和正常对照组(均P<0.01),CIN组患者术前血清AGR2水平略高于正常对照组,无统计学差异(P>0.05);CIN患者病变组织中AGR2水平略高于正常宫颈组织,无统计学差异(P>0.05);宫颈癌及CIN患者术后血清AGR2水平较术前明显降低(均P<0.01),见图1、图2。
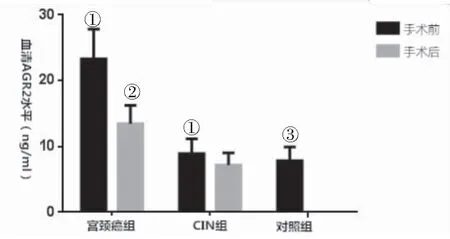
图1 各组血清AGR2水平比较
Figure1ComparisonofserumAGR2levelsinthethreegroups
注:与同组术后比较①P<0.01;与CIN组术后比较②P<0.01;与宫颈癌组术前比较③P<0.01
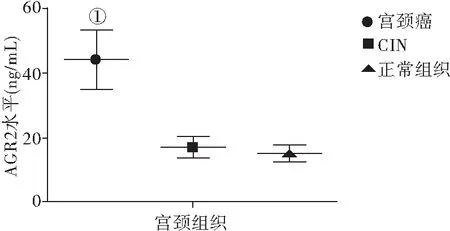
图2 各组宫颈组织AGR2水平比较
Figure2ComparisonofAGR2levelsincervicaltissuesinthethreegroups
注:与CIN和正常组宫颈组织AGR2水平比较,①P<0.01
2.2 宫颈癌血清及组织中AGR2水平与临床病理特征的关系 宫颈癌血清及组织中AGR2水平与肿瘤大小、FIGO分期、淋巴结转移有关(P<0.05),与年龄、病理类型、分化程度无关(P>0.05),见表1。
2.3 宫颈癌组织与血清AGR2水平之间的关系 相关分析显示,宫颈癌及CIN患者术前血清AGR2与术后血清AGR2水平呈正相关(r=0.747,P=0.000),宫颈组织AGR2水平与手术前后血清AGR2水平均呈正相关(r=0.789,P=0.000;r=0.700,P=0.000),见图3、4、5。
表1宫颈癌血清及组织中AGR2水平与临床病理特征的关系
Table1TherelationshipbetweenSerumandtissuelevelsofAGR2incervicalcancerandclinicopathologicalfeatures

项目n血清AGR2(ng/mL)术前术后宫颈组织年龄(岁) ≤501121.27±4.2012.34±2.0342.27±8.75 >501924.51±3.3714.02±2.9345.47±9.59肿瘤大小(cm) ≤42122.15±3.9312.48±2.4742.10±7.89 >4926.06±4.85①15.60±2.31②49.44±10.66①病理类型 鳞癌2623.39±3.9213.42±2.5744.18±8.92 腺癌422.88±8.3013.38±4.5045.10±12.91FIGO分期 Ⅰ期1921.80±3.2612.15±1.5741.16±8.15 Ⅱ期1125.95±5.30①15.59±3.16②49.72±8.88①分化程度 高分化422.38±2.0112.68±1.9240.35±4.89 中分化1522.65±1.3913.30±1.0945.17±5.90 低分化1124.58±1.1313.69±1.2644.55±5.34淋巴结转移 有418.48±1.2111.30±1.5234.10±3.16 无2624.06±1.54①13.74±1.28①45.87±4.56①
注:与同项目前项比较①P<0.05,②P<0.01
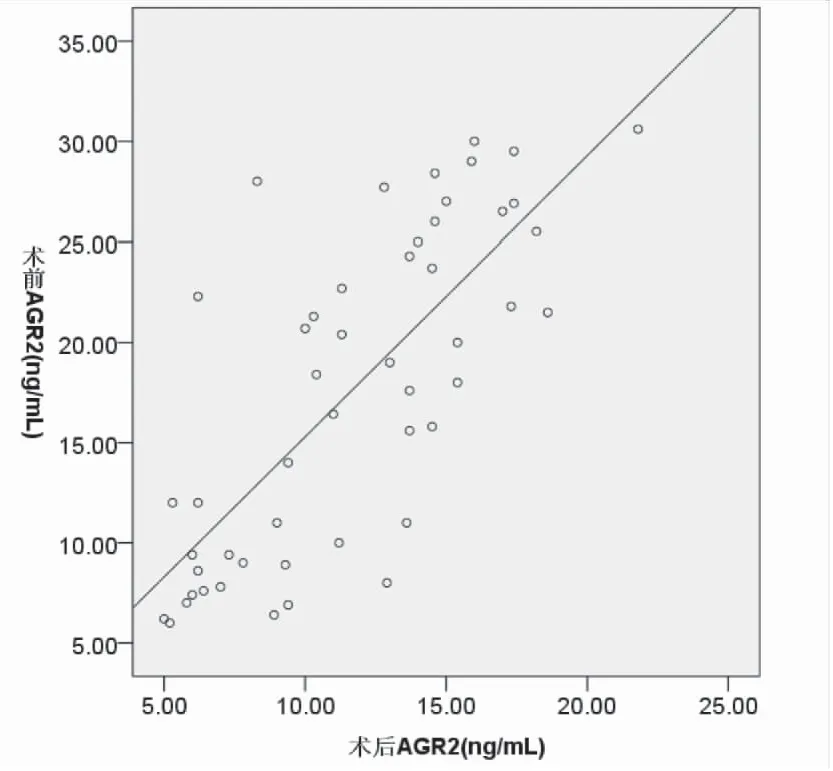
图3宫颈癌及CIN患者术前血清AGR2水平与术后血清水平相关性分析
Figure3ThecorrelationanalysisbetweenpreoperativeserumAGR2levelsandpostoperativeserumlevelsofAGR2incervicalcancerandCINpatients.
3 讨论
研究表明,肿块直径、肿瘤分期、HPV检测、分化程度对宫颈癌的临床预后影响较大,临床干预中需要提供相关指标的监测效能,有针对性的早期干预[6]。手术前后检测相关肿瘤指标水平,可以为宫颈癌早期诊断、疗效评价及预后判断提供了一定的参考价值。宫颈病变及宫颈癌的起源细胞为储备细胞,储备细胞增殖、增生、发生癌变而形成癌变上皮[7]。Sato等[8]研究通过人源性多能干细胞(iPSCs)再生子宫颈储备细胞样特性的方法,诱导出类似于储备细胞样的细胞,发现该细胞存在AGR2表达。已有的研究证实,AGR2在乳腺癌、胃癌、胰腺癌等疾病中呈过量表达,与肿瘤的形成和转移密切相关[9-11]。AGR2是内质网驻留的蛋白质二硫化物异构酶超家族成员,是脊椎动物中包括胚盘形成和肢体再生的基本生物学特性的主要效应因子。AGR2可干扰并影响疾病进程,包括癌症进展和耐药性等[12]。Pohler等[13]研究证实,AGR2通过抑制P53磷酸化及其活性,细胞失去正常调控导致癌变。王巍巍等[14]研究发现,二亚硝基哌嗪(DNP)通过在转录水平上调AGR2的表达,参与鼻咽癌细胞的侵袭和转移。李跃进等[15]研究表明,AGR2在鼻咽癌细胞系5-8F中明显高表达,干扰AGR2可使癌细胞迁移和侵袭功能明显减弱,使其体外成瘤能力显著降低。采用RNAi技术特异地剔除AGR2基因,可明显减少肺癌细胞转移[16]。由此可见,AGR2增高具有促进肿瘤细胞增殖、侵袭及转移等作用。因此,AGR2是一个潜在的肿瘤诊断、疗效及预后判断的生物标志物。目前AGR2在宫颈癌中的表达尚不清楚,相关的文献报道极少。本研究探讨了AGR2在宫颈癌发生发展中的作用,通过ELISA法检测了宫颈癌及CIN患者血清及病变组织的AGR2水平,结果发现,宫颈癌患者手术前血清及癌组织AGR2水平明显高于CIN和正常对照组,宫颈癌及CIN患者术后血清AGR2水平较术前明显降低,相关性分析表明,宫颈癌及CIN组术前与术后血清AGR2水平呈正相关,宫颈组织AGR2水平与手术前后血清AGR2水平均呈正相关,因此,推测术后血清AGR2水平下降可能与体内肿瘤组织切除后AGR2分泌入血减少有关,在一定程度上可作为判断手术疗效的参考指标。
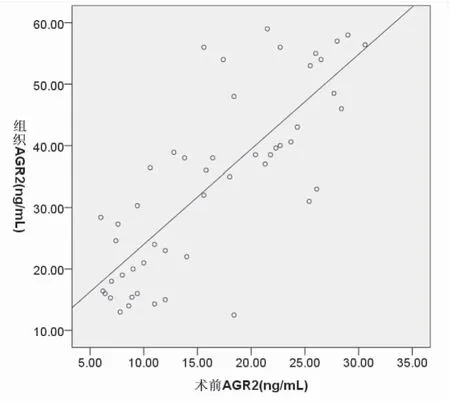
图4宫颈组织AGR2水平与术前血清AGR2水平的相关性分析
Figure4CorrelativeanalysisbetweenAGR2levelsincervicaltissueandpreoperativeserumAGR2levels.
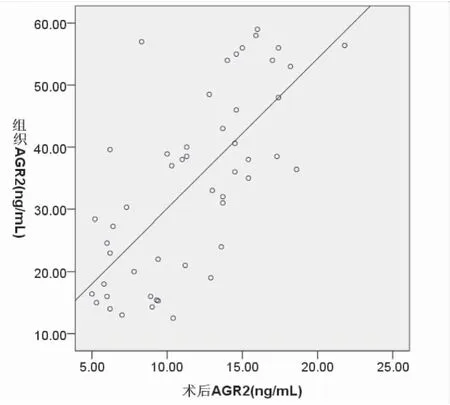
图5宫颈组织AGR2水平与术后血清AGR2水平的相关性分析
Figure5CorrelativeanalysisbetweenAGR2levelsincervicaltissueandpostoperativeserumAGR2levels.
本研究分析了血清及宫颈癌组织中AGR2水平与临床病理特征的关系,结果显示,宫颈癌血清及组织中AGR2水平与肿瘤大小、FIGO分期、淋巴结转移有关,与年龄、病理类型、分化程度无关。表明,AGR2与恶性肿瘤的侵袭转移有着密切的关系。Zhang等[17]研究发现,AGR2与胃癌肿瘤大小、侵袭深度、TNM分期显著相关。白小英等[18]研究发现,卵巢上皮性癌及卵巢交界性肿瘤血清AGR2水平、AGR2蛋白阳性表达均明显高于卵巢良性肿瘤及健康体检者,卵巢上皮性癌血清AGR2水平及癌组织中AGR2的阳性表达率均与临床分期及淋巴结转移相关。刘丽娜等[19]研究发现,结直肠癌组织中AGR2阳性表达率较癌旁正常组织显著性增高,AGR2的阳性表达率与肿瘤分化程度与淋巴结转移呈显著相关,AGR2在结直肠癌的发生、发展过程中发挥了重要作用。Lacambra等[20]研究发现,AGR2表达的预后影响可能与雌激素受体阳性乳腺癌的治疗结果和/或其转移促进作用有关。它可能是临床实践中潜在可利用的重要肿瘤生物标志物和阴性预后因素。以上研究表明,AGR2水平参与了不同肿瘤的侵袭、转移。
4 结论
本文资料显示,宫颈癌患者血清AGR2增高与肿瘤大小、FIGO分期、淋巴结转移相关,并参与了宫颈癌发生、侵袭及转移过程,也为手术疗效的判断和肿瘤治疗提供了新的靶点。但尚需大样本多指标综合研究,以阐明AGR2与宫颈癌预后的关系。
【参考文献】
[1]应倩,夏庆民,郑荣寿,等.中国2009年宫颈癌发病与死亡分析[J].中国肿瘤,2013,22(8): 612-616.
[2]任宝花,刘巍,谭文华.AGR2与肿瘤关系研究进展[J].中国优生与遗传杂志,2014,22(3): 134-136.
[3]魏龙刚,邓鸣涛,赵一楠,等.AGR2:一个新的癌症诊断标记[J].中国细胞生物学学报,2013, 35(12):1-9.
[4]Ma SR, Mao L, Deng WW,etal.AGR2 promotes the proliferation, migration and regulates epithelial-mesenchymal transition in salivary adenoid cystic carcinoma[J]. Am J Transl Res,2017,9(2):507-519.
[5]Tohti M,Li J,Tang C,etal.Serum AGR2 as a useful biomarker for pituitary adenomas[J].Clin Neurol Neurosurg,2017,154:19-22.
[6]姜光瑶,赵志伟,吴江,等.宫颈癌术后患者临床预后影响的多因素分析[J].西部医学,2015,27(12):1806-1809.
[7]白晶,李爱军.宫颈癌干细胞的研究进展[J].肿瘤基础与临床,2013,26(5):458-461.
[8]Sato M,Kawana K,Adachi K,etal.Regeneration of cervical reserve cell-like cells from human induced pluripotent stem cells (iPSCs): A new approach to finding targets for cervical cancer stem cell treatment[J].Oncotarget,2017, (3):
[9]Dumartin L,Alrawashdeh W,Trabulo SM,etal.ER stress protein AGR2 precedes and is involved in the regulation of pancreatic cancer initiation[J].Oncogene,2017,36(22): 3094-3103.
[10] Zhang J,Jin Y,Xu S,etal.AGR2 is associated with gastric cancer progression and poor survival[J].Oncol Lett,2016,11(3):2075-2083.
[11] Li Z,Zhu Q,Hu L,etal.Anterior gradient 2 is a binding stabilizer of hypoxia inducible factor-1α that enhances CoCl2-induced doxorubicin resistance in breast cancer cells[J].Cancer Sci,2015,106(8):1041-1049.
[12] Brychtova V,Mohtar A,Vojtesek B,etal.echanisms of anterior gradient-2 regulation and function in cancer[J].Semin Cancer Biol,2015,33:16-24.
[13] Pohler E, Craig AL, Cotton J,etal.The Barrett's antigen anterior gradient-2 silences the p53 transcriptional response to DNA damage[J].Mol Cell Proteomics,2004, 3(6):534-547.
[14] 王巍巍,唐发清,李跃进.二亚硝基哌嗪上调AGR2促进鼻咽癌细胞转移[J].癌变.畸变.突变,2016,28(2):115-120.
[15] 李跃进,王巍巍,卢金平,等.前梯度蛋白2干扰质粒的构建及其对鼻咽癌细胞生物学功能的影响[J].中国病理生理杂志,2016,32(9):1545-1550.
[16] Hu R,Huffman KE,Chu M,etal.Quantitative Secretomic Analysis Identifies Extracellular Protein Factors That Modulate the Metastatic Phenotype of Non-Small Cell Lung Cancer[J].J Proteome Res,2016,15(2):477-486.
[17] Zhang J, Jin Y, Xu S,etal.AGR2 is associated with gastric cancer progression and poor survival[J].Oncol Lett,2016,11(3):2075-2083.
[18] 白小英,金平,张蕾.AGR2在卵巢上皮性癌患者血清及癌组织中的表达及意义[J].实用妇产科杂志,2013,19(1):31-35.
[19] 刘丽娜,殷云勤,张兆美,等.AGR2、Lgr5在结直肠癌中的表达及其临床意义[J].中国现代医生,2014,52(4):6-11.
[20] Lacambra MD,Tsang JY,Ni YB,etal.Anterior Gradient 2 is a Poor Outcome Indicator in Luminal Breast Cancer[J].Ann Surg Oncol,2015,22(11):3489-3496.

