紫海胆黄油微胶囊制备工艺的研究
徐清云, 潘 南, 陈丽娇, 刘智禹, 吴靖娜, 苏永昌, 苏 捷
(1 福建农林大学食品科学学院,福建 福州 350002;2 福建省水产研究所,国家海水鱼类加工技术研发分中心,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013;3 福建省海洋生物资源开发利用协同创新中心,福建 厦门 361013)
海胆属于棘皮生物门(Echinodermate)分类下的海胆纲(Echinoidea),其现存的种类多达850余种,中国拥有约100种,但可食用的海胆仅占其中的一小部分,只有10余种,主要是光棘球海胆(Strongylocentrotusnudus)、马粪海胆(Hemicentrotuspulcherrimus)、紫海胆(Anthocidariscrassispina)、虾夷马粪海胆(Strongylocentrotusintermedius)、海刺猬(Glyptocidariscrenularis)等[1-2]。海胆主要分为6个部分:体壁、内脏、内脏液、生殖腺、咀嚼器和内含物,其中生殖腺起着重要的作用。海胆的生殖腺又称海胆黄,是指海胆外壳体内包裹着的5小块月牙形的橙黄色稠粥样物,对生殖和储存营养具有重要的作用[3]。研究表明,紫海胆(Anthocidariscrassispina)的生殖腺具有很高的营养价值,含有丰富的蛋白质、矿物质,氨基酸种类丰富,比例合理,含有25%的粗脂肪[4]。海胆黄中的不饱和脂肪酸是以二十碳五烯酸(EPA)和花生四烯酸为主[5],EPA是预防心血管病的有效成分,可以改变脂蛋白中脂肪酸的组成,进而使血液的粘稠度下降,有助于增强血液的流动性,起到降血脂的作用[6-7]。但是海胆黄油中的不饱和脂肪酸易受到外界的光、热、氧等因素的影响而氧化酸败,目前对海胆黄中的脂质进行保健产品的研发一直鲜有报道。
微胶囊具有改变物态,保护敏感成分并降低其易挥发物质的挥发,保持物质中微量元素和活性物质对人体的活性,阻隔互相反应大的组分使其稳定存在,掩蔽不良味道,保护物质不被外界环境因素影响等特点[8]。微胶囊的壁材将芯材包裹在内,使芯材与外界阻隔,避免其与外界因素发生反应。当需要释放芯材时,通过加热、加压及辐射等方法破坏壁材可以在需要的时候将芯材释放出来[9]。将紫海胆黄油进行微胶囊化,既可以保持紫海胆黄油中的营养成分和活性物质,又可以弥补其易氧化,有咸腥味等缺点。制备的紫海胆黄油微胶囊能够很好地适应工业化生产,并且在贮藏、运输及使用时十分便利。
本研究以紫海胆黄油为原料,利用辛烯基琥珀酸酯化淀粉(HI-CAP100)和β-环糊精为壁材,通过喷雾干燥对紫海胆黄油进行微胶囊化,研究其制备工艺条件、产品理化性质和卫生指标。为紫海胆黄油微胶囊产品的研发提供了参考。
1 材料与仪器
1.1 材料
新鲜的紫海胆(Anthocidariscrassispina)采购于深圳市南澳镇,用镊子将其生殖腺取出、冻干、粉碎。利用食品级正己烷制备紫海胆黄油。β-环糊精、辛烯基琥珀酸淀粉(HI-CAP100),德清三富食品有限公司。中性蛋白酶,南宁庞博生物有限公司。氯化钠、石油醚、乙醇,国药集团化学试剂有限公司。食品级正己烷,溧阳市昕光化工有限公司。
1.2 仪器
SP-1500实验型喷雾干燥机,上海顺仪科技有限公司。WJX-A 1000高速多功能粉碎机,上海缘沃工贸有限公司。BILON-T-502低温冷却循环装置,比朗实验设备有限公司。HH-6型数显电子恒温水浴锅,常州国华电器有限公司。T18ULTRA-TURRAX型分散机和C-MAG HS7加热磁力搅拌器,德国IKA公司。CENTRIFUGE5810R冷冻型台式高速离心机,艾本德中国有限公司。料理机,九阳股份有限公司。SHZ-Ⅲ型循环水真空泵,上海亚荣生化仪器厂。R-1001VN旋转蒸发仪,郑州长城科工贸有限公司。
2 方法
2.1 紫海胆黄油的提取
结合朱蓓薇等[10]方法称取紫海胆黄粉末样品,以1∶20(g/mL)的比例加入蒸馏水,分多次充分溶解,按照一定的比例加入最佳酶活为5 000 U的中性蛋白酶搅拌至均匀。放入50 ℃的水浴锅中酶解3 h,再升温至100 ℃,高温灭酶20~30 min。添加NaCl(25%W/V)、乙醇(65%V/V)进行破乳,利用食品级正己烷进行萃取,收集正己烷层,继续萃取直至正己烷层颜色变淡。在40 ℃条件下用旋转蒸发仪对萃取液进行旋蒸提油离心,冷藏保存。
2.2 紫海胆黄油微胶囊的制备工艺
辛烯基琥珀酸酯化淀粉(HI-CAP100)和β-环糊精是近几年包埋油脂效果比较好的壁材[11],本试验以这两种材料为壁材。按照配方称取壁材,将壁材溶解混匀后,加入紫海胆黄油利用IKA分散机乳化30 min,经料理机均质5 min,以500 mL/h的进样速度,在进风温度180 ℃、出风温度80 ℃条件下进行喷雾干燥制得紫海胆黄油微胶囊产品,于4 ℃下真空保存。工艺流程如图1所示。

图1 工艺流程图
2.3 单因素试验
以包埋率和乳化液稳定度为指标,选取壁材比例(HI-CAP100∶β-环糊精)、乳液浓度、油脂添加量为主要考察因素,进行单因素实验,研究其对紫海胆黄油微胶囊效果的影响。
(1)壁材比例(HI-CAP100∶β-环糊精):在乳液浓度为20%、油脂添加量为20%条件下,设定壁材比例为4∶0.5、4∶1、4∶1.5、4∶2和4∶2.5,经过分散机乳化30 min,利用料理机均质5 min,以500 mL/h的进样速度,在进风温度为180 ℃、出风温度为80 ℃条件下制得紫海胆黄油微胶囊,选择适宜的壁材比例。
(2)乳液浓度:在壁材比例(HI-CAP100∶β-环糊精)为4∶2,油脂添加量为20%,设定乳液浓度为10%、15%、20%、25%和30%,利用IKA均质乳化机均质乳化30 min,料理机均质5 min,以500 mL/h的进样速度,在进风温度为180 ℃、出风温度为80℃条件下进行喷雾干燥制得紫海胆黄油微胶囊,选择适宜的乳液浓度。
(3)油脂添加量:在壁材比例(HI-CAP100∶β-环糊精)为4∶2,乳液浓度为20%,设定油脂添加量为10 %、15%、20 %、25%和30%,经过IKA均质乳化机乳化30 min,利用料理机均质5 min,以500 mL/h的进样速度,在进风温度为180 ℃、出风温度为80 ℃条件下进行喷雾干燥制得紫海胆黄油微胶囊,选择适宜的油脂添加量。
2.4 正交实验
根据单因素试验确定的最佳壁材比例和乳液浓度以及油脂添加量,以包埋率和乳化液稳定性为指标,采用L9(34)正交实验方式,对壁材比例(A)、乳化液质量浓度(B)、油脂添加量(C)为因素水平进行正交实验,确定最佳工艺条件,正交试验因素水平设计见表1。

表1 正交因素水平表
2.5 乳化液稳定的测定
将50 mL 已均质完全的乳化液倒入 50 mL 具塞试管中,40 ℃水浴中放置24 h,记录游离水层体积V[12]。
(1)
式中:X—乳化液稳定度,%;V—游离水层体积,mL。
2.6 包埋率的测定
2.6.1 表面油的测定
根据利用石油醚测定紫海胆黄油微胶囊表面所含的油脂[13]。用锥形瓶准确称取10 g(精确到0.001 g)的紫海胆黄油微胶囊粉末,量取沸点为30 ℃~60 ℃的石油醚30 mL于锥形瓶内,充分振摇2 min,用滤纸过滤,后用10 mL的石油醚振摇提取2次,收集滤液转移入干燥至恒重的称量皿内(W1);将称量皿于通风橱内60 ℃水浴蒸干,再移至105 ℃的烘箱中烘干至恒重(W2)。做3组平行,测量结果为其平均值。
(2)
式中:X—样品中表面油的含量,%;W1—称量皿的质量,g;W2—干燥后称量皿和油的质量,g;M—试样的质量,g。
2.6.2 总油的测定
利用石油醚和正己烷测定紫海胆黄油微胶囊的总油[14]。准确称取样品(M)置于洁净干燥的锥形瓶内,使微胶囊粉末充分溶于20 mL的热水中,后依次加入等量的石油醚(30 ℃~60 ℃)和正己烷。搅拌静置后,将上层萃取液移入洁净称重的小烧杯内(M1),重复萃取两次,将萃取液归并入小烧杯,于30 ℃水浴锅中将有机溶剂蒸干,放入烘箱烘干至恒重,称重(M2),做3组平行,测量结果为其平均值。
(3)
式中:X—样品总油的含量,%;M1—小烧杯的质量,g;M2—烘干后小烧杯和油的质量,g;M—试样的质量,g。
2.6.3 包埋率计算
(4)
式中:Y—包埋率,%;F—表面油含量,g;T—总油含量,g;
2.7 理化性质
2.7.1 感官评价及水分测定
依据水产行业标准(SC/T3505—2006)[15],对微胶囊产品的气味、色泽和组织状态进行感官评价;水分含量依据国标中的直接干燥法(GB 5009.3—2016)测定。
2.7.2 溶解度
用干燥至恒重的烧杯称取5 g的紫海胆黄油微胶囊粉末,在微胶囊粉末中倒入50 mL 蒸馏水,搅拌直至充分溶解,移入离心管内于4 500 r/min条件下离心10 min,取出后去除上层蒸馏水,再加入50 mL蒸馏水搅拌溶解后再次离心,去除上层蒸馏水后将沉淀移入已称重的烧杯(M1)中,在105 ℃的烘箱内将其烘干至恒重(M2)[16]。
(5)
式中:M—样品质量,g;M1—烧杯的质量,g;M2—烧杯与沉淀的质量,g;B—样品的水分含量,%。
2.7.3 直流角
将漏斗置于铁架台,将粉末油脂样品倒入漏斗,使粉末注入到圆盘的中心,直至粉末累积到一定高度,沿培养皿的四周流出为止,停止注入粉末。测量培养皿的直径d,锥体高度H,培养皿高度h,紫海胆黄油微胶囊样品与水平面构成的夹角就是直流角F[17]。
(6)
式中:F—直流角,°;H—锥体高度,cm;h—粉末锥体高度,cm;d—圆盘直径,cm。
2.8 安全卫生指标
根据微生物学的理论和方法,按照国家标准[GB 4789.2(3、4、10、15)—2016]测定菌落总数、大肠菌群、沙门氏菌、金黄色葡萄球菌、霉菌和酵母;志贺氏菌是依据国家标准(GB 4789.5—2012)[18],通过血清型分析和生化鉴定进行检验。
2.9 数据分析

3 结果与分析
3.1 壁材比例对微胶囊影响
微胶囊壁材的比例能够对微胶囊包埋效果产生一定的作用。壁材比例对微胶囊效果影响如图2所示。

图2 壁材比例对微胶囊效果影响
在一定的油脂添加量、乳液浓度下对紫海胆黄油进行微胶囊化,由图2可知,其乳化液稳定度及包埋率随着β-环糊精占壁材比重的增长,呈现先上升后降低的趋势,但其因壁材比例的不同而有着不同的变化幅度。
当壁材比在4∶0.5~4∶2之间时,紫海胆黄油微胶囊乳化液的稳定度性及包埋率皆显著上升;在4∶2时,乳化液稳定性和包埋率达到最高,乳化液稳定性为96.3%、包埋率为94.07%;但随着壁材比例高于4∶2后,乳化液稳定性和包埋率反而降低。这是由于辛烯基琥珀酸酯化淀粉(HI-CAP100)本身具有可以有效降低O/W界面上的张力,可以满足高浓度低黏度的要求[19];β-环糊精具有良好的包络作用[20],适量的β-环糊粉精在壁材中,可以使得微胶囊壁的结构更加致密,提高乳化液的稳定性,使紫海胆黄油微胶囊的包埋效果较好[21-22]。当壁材比高于4∶2时,由于辛烯基琥珀酸酯化淀粉(HI-CAP100)在壁材中所占比重的减小,其乳化液稳定性显著减小,导致紫海胆黄油易与壁材分离,表面含油量升高,包埋率随之减小。因此,选择的壁材比例(HI-CAP100∶β-环糊精)为4∶2。
3.2 乳化液质量浓度
乳化液质量浓度的大小对紫海胆黄油微胶囊的包埋效果存在一定的影响。由图3可看出,在一定区间内,随着乳化液质量浓度的增大,紫海胆黄油微胶囊的乳化液稳定性和包埋率先上升后降低。

图3 乳化液质量浓度对微胶囊效果的影响
当乳化液质量浓度区间为10%~20%时,随着乳化液浓度的增大,其乳化液稳定性及包埋率也随之增大,其中乳化液稳定度的上升程度较包埋率更为显著;在乳化液质量浓度为20%时,其乳化液稳定性和包埋率达到最大值,分别为(96.53±0.71)%、(94.03±0.32)%;在乳化液质量浓度在20%~30%之间时,随乳化液质量浓度的上升,其乳化液稳定性和包埋效果反而下降。这是由于在一定的浓度范围内,随着乳化液质量浓度的增大,乳化液稳定度变强,油脂与壁材的融合度变大,喷雾干燥时,壁材更易形成包膜,紫海胆黄油微胶囊产品的包埋率随之上升。但当乳化液质量浓度超过一定范围时,乳化液质量浓度越大,乳化液的黏度变大[23],液滴成膜速度过快,致使液滴中水分不易蒸发气化,微胶囊产品的水分含量过大,在进行喷雾干燥的过程中容易粘附在壁上,且包埋效果降低[24]。因此选择的乳化液质量浓度为20%。
3.3 油脂添加量
油脂添加量是紫海胆黄油微胶囊化的一个重要指标。由图4可知,随油脂添加量的增大,乳化液稳定性呈先上升后下降趋势。
当油脂添加量为10%~15%时,紫海胆黄油微胶囊的乳化液稳定和包埋率的变化趋势并不显著,其中乳化液稳定性略有上升、包埋率略微下降;15%~30%之间时,紫海胆黄油微胶囊的乳液稳定性和包埋率迅速下降。这可能是由于随着油脂的添加量的增大,壁材比例降低,乳化液的乳化效果降低,制备的紫海胆黄油微胶囊其囊壁厚底和致密性随之下降,在喷雾干燥过程中被包埋的紫海胆黄油脂距离干燥表面近,导致油脂易从囊壁渗出,致使包埋效果不好、表面油含量增高,进而使得其乳化液稳定性和包埋率下降[25-26]。综合考虑紫海胆黄油微胶囊的品质和经济成本等原因,选择油脂添加量为15%。
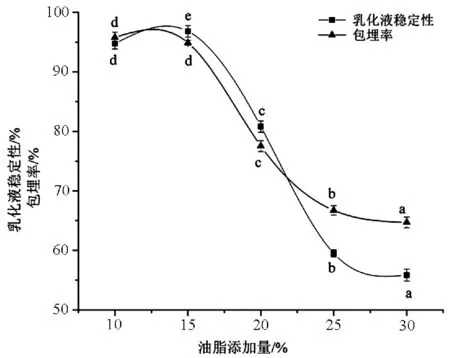
图4 油脂添加量对微胶囊效果的影响
3.4 正交实验与分析
根据单因素试验的结果,以包埋率和乳化液稳定性为评价指标,以HI-CAP100和β-环糊精的比例(A)、乳化液浓度(B)和油脂添加量(C)三个因素作为研究对象,进行3因素3水平L9(34)正交实验。正交实验结果和极差分析见表2,正交实验的方差分析见表3、表4。

表2 正交实验结果
由表2极差分析结果可知,对紫海胆油微胶囊包埋率影响的主次顺序依次为:A(壁材比例)>B(乳化液质量浓度)>C(油脂添加量),即壁材比例对乳化液稳定性和包埋率的影响最为明显,油脂添加量最不明显。最优方案为A2B1C2,即壁材比例(HI-CAP100∶β-环糊精)为4∶2、乳化液质量浓度为17%、油脂添加量为15%。跟其他鱼油微胶囊相比,紫海胆黄油微胶囊的载油量比较低,可能是由于紫海胆黄中总油脂中脂肪酸组成的种类以及含量相对比较丰富[4],导致在制备微胶囊的过程中,其乳化油脂所需要的壁材增多,载油量较低。
表3、表4显示,因素A(壁材比例)和B(乳化液浓度)对乳化液稳定性具有显著影响(P<0.01),说明壁材比例和乳化液质量浓度对制备紫海胆黄油微胶囊中的影响较大,但是油脂添加量的影响不显著(P>0.05)。

表3 包埋率方差分析
注:“**”表示差异极显著

表4 乳化液稳定性方差分析
注:“**”表示差异极显著
3.5 验证试验
将正交实验中最优方案A2B1C2进行验证试验,其包埋率和乳化液稳定性都高达95%以上,制得的紫海胆黄油微胶囊品质较好。因此,选取A2B1C2,即利用喷雾干燥制备微胶囊的最优工艺参数为辛烯基琥珀酸酯化淀粉(HI-CAP100)和β-环糊精的壁材比例为4∶2、乳化液浓度为17%、油脂添加量为15%,利用分散机乳化30 min,料理机均质5 min,在进风温度180 ℃、出风温度80 ℃,进料速度500 mL/h下进行喷雾干燥,制得的微胶囊成品的包埋率和乳化液稳定性较好。
3.6 理化性质
紫海胆黄油微胶囊的色泽呈淡黄色,色泽均匀一致,有光泽、产品整体呈粉末状,粒径微小且均匀一致,分散性较好、有水产品特有的腥味,无异味。其水分含量为(2.82±0.10)%,符合水产行业标准鱼油微胶囊的水分含量应≤5%的要求[15]。水分含量对粉末产品的影响很大,过高的含水量会导致样品发霉结块,降低了产品的流动性和贮藏期限;溶解度为(71.94±0.01)%,其溶解性较好;直流角为(22.05±0.03)°,研究表明直流角反映了颗粒与原型的接近程度,从而反映物质的流动性,其值越大,流动性反之越差,直流角F<30°时流动性较好,F>45°时流动性差[27-28],说明制备的紫海胆黄油微胶囊粉末产品的流动性较好,可以满足生产过程中的需求。
3.7 安全卫生指标
根据国家的相关规定,在紫海胆黄油微胶囊中检测8种卫生安全指标(表5),由表5可知:紫海胆黄油微胶囊的菌落总数为480 CFU/g,大肠菌群数<30 MPN/100 g,霉菌和酵母均<10 CFU/g,沙门氏菌、志贺氏菌、金黄葡萄球菌和铅均未检出,检测结果均符合水产行业标准[15]。

表5 紫海胆黄油微胶囊的安全卫生指标
4 结论
通过喷雾干燥对紫海胆黄油进行微胶囊化,对其壁材比例、乳化液质量浓度和油脂添加量进行考察。结果发现,壁材比例、乳化液质量浓度和油脂添加量对微胶囊产品的乳化液稳定性和包埋率两个重要指标均有影响。在单因素试验的基础上,进行正交实验,确定了最优制备条件为:壁材比例(HI-CAP100∶β-环糊精)为4∶2、乳化液质量浓度为17%、油脂添加量为15%。在该条件下经过分散机乳化30 min,利用料理机均质5 min,以500 mL/h的进样速度,在进风温度为180 ℃、出风温度为80 ℃的工艺下对紫海胆黄油进行喷雾干燥制得的紫海胆黄油微胶囊成品,其色泽淡黄均匀有光泽,呈粉末状,分散性较好,包埋率为95.7%,乳化液稳定度为96.8%,理化性质及安全卫生指标皆符合行业标准。紫海胆黄油微胶囊可以保持紫海胆黄油中的营养成分和活性物质,又可以弥补其易氧化,该工艺的研究可以为紫海胆黄脂质的开发提供参考依据。
□
参考文献
[1] 左然涛,侯受权,常亚青,等.海胆营养生理研究进展[J].大连海洋大学学报,2016,31(4):463-468.
[2] 赵兰珍.大连紫海胆[J].开卷有益:求医问药,2016(3):69-70.
[3] 王冬,王政乾,田红伟,等.海胆的研究进展及其应用现状[J].中国海洋药物,2006,25(4):52-54.
[4] 徐清云,潘南,吴靖娜,等.紫海胆黄基本营养成分的分析与评价[J].渔业现代化,2017,44(2):50-55.
[5] 牛宗亮,王荣镇,董新伟,等.马粪海胆生殖腺营养成分的含量测定[J].中国海洋药物,2009,28(6):26-30.
[6] ANGERER P,VON S C.n-3 polyunsaturated fatty acids and the cardiovascular system[J].Current Opinion in Lipidology,2000,11(1):57-63.
[7] TAKADA K,ISHIKAWA S,YOKOYAMA N,et al.Effects of Eicosapentaenoic Acid on Platelet Function in Patients Taking Long-Term Aspirin Following Coronary Stent Implantation[J].International Heart Journal,2014,55(3):228-233.
[8] 张笑含,刘琳,张紫茜,等.微胶囊技术及其应用[J].黑龙江医药,2014,27(5):1051-1055.
[9] 韩丹,熊华,白春清,等.微藻油微胶囊贮藏稳定性的初步研究[J].食品科学,2009,30(17):123-126.
[10]ZHU B W,QIN L,ZHOU D Y,et al.Extraction of lipid from sea urchin(Strongylocentrotusnudus) gonad by enzyme-assisted aqueous and supercritical carbon dioxide methods[J].European Food Research & Technology,2010,230(5):737-743.
[11]杨佳,侯占群,贺文浩,等.微胶囊壁材的分类及其性质比较[J].食品与发酵工业,2009,35(5):122-127.
[12]桂仕林,邢慧敏,李琳,等.藻油乳化液的制备及稳定性研究[J].食品研究与开发,2014(3):51-54.
[13]李佳栋,陈昊,许慧,等.微胶囊化大豆粉末油脂包埋技术的研究[J].食品工业科技,2013,34(5):244-246.
[14]黄小芬,陈静.鳗鱼油微胶囊化工艺条件的研究[J].食品工业,2013(6):35-37.
[15]SC/T—2006鱼油微胶囊[S].
[16]孙新虎.番茄红素微胶囊包埋的研究[D].江苏:江南大学,2004.
[17]GOKMEN V,SERPEN A.Equilibrium and kinetic studies on the adsorption of dark colored compounds from apple juice using adsorbent resin.[J].Journal of Food Engineering,2002,53(3):221-227.
[18]GB4789—2012食品志贺氏厌菌检验[S].
[19]王恺,王振伟.辛烯基琥珀酸淀粉酯为壁材的微胶囊化粉末油脂的制备及性质研究[J].黑龙江科技信息,2010(28):41.
[20]苏阳,徐方旭,冯叙桥.鱼油微胶囊化研究进展[J].食品研究与开发,2013(12):133-136.
[21]刘幻幻.环糊精的油水界面行为及其稳定乳液性质[D].无锡:江南大学,2016.
[22]朱卫红,许时婴,江波.微胶囊壁材辛烯基琥珀酸酯化淀粉的界面性质和乳化稳定性[J].食品科学,2006,27(12):79-84.
[23]王缈,赵战利,李宁,等.微胶囊化玉米胚芽油粉的制备工艺研究[J].中国食品添加剂,2014(2):187-193.
[24]林彩平,苏永昌,黄煜,等.鱿鱼肝油微胶囊化技术研究[J].渔业研究,2012,34(2):111-120.
[25]TONON R V,GROSSO C R F,HUBINGER M D.Influence of emulsion composition and inlet air temperature on the microencapsulation of flaxseed oil by spray drying[J].Food Research International,2011,44(1):282-289.
[26]卢燕霞,田永强,刘惠琴,等.牛至精油β环糊精微胶囊的制备及其抑菌效果研究[J].包装工程,2016(5):84-88.
[27]王晨光,方建国.药物粉体流动性的测量方法和应用[J].中国新药杂志,2013(7):809-813.
[28]吴福玉.粉体流动特性及其表征方法研究[D].上海:华东理工大学,2014.

