乳腺癌超声征象与病理组织学类型及组织学分级的临床关系研究
陈晓婷 王东平 周 建
近年来,乳腺癌发病率呈现上升趋势,也成为严重威胁女性健康的典型性疾病[1]。临床通过超声常规检查可及时发现乳腺疾病,为早期治疗赢得宝贵的时间。本研究以我院收治的乳腺癌患者为研究对象,对其进行前瞻性研究,探讨超声征象和病理组织学类型及组织学分级之间的联系。现报告如下。
1 资料与方法
1.1 一般资料
选取我院2014年11月至2016年11月收治的127例乳腺癌患者为研究对象,患者均为女性,年龄27~68岁,平均年龄为(53.1±2.2)岁。患者均实施了乳腺病变切除活检术,在实施手术前均实施了乳腺超声检查,超声检查显示病变,经病理证实为乳腺癌。入组患者均知情,签署知情同意书,本研究经院伦理委员会审核批准。
1.2 检查方法
患者取仰卧位,双臂需要向上举起,并向外延伸,充分暴露两侧乳房及腋部,检查设备采用PHILIPS IU22彩色多普勒超声诊断仪,探头频率为5~12 MHz,利用高频超声显示乳腺肿瘤最佳切面,确保无扫描盲区,记录病灶声像图信息资料,重点记录毛刺、钙化、形态、后方回声衰减等情况。病理组织学类型按照WHO1981乳腺癌分类标准进行区分[2]。浸润性导管癌组织学分级按照Nottingham Combined Histologic Grade分级标准进行[3]。
1.3 统计学处理
采用SPSS18.0软件进行数据处理,采用χ2检验,P<0.05为差异具有统计学意义。
2 结果
本组127例乳腺癌患者中,超声显示毛刺阳性62例,形态不规则68,微小钙化77例,后方回声减弱100例。
2.1 超声征象与病理类型
127例患者中,经病理证实浸润性导管癌84例,浸润性小叶癌43例。在毛刺、形态、微小钙化上浸润性导管癌和浸润性小叶癌差异具有统计学意义(P<0.05)。见表1。
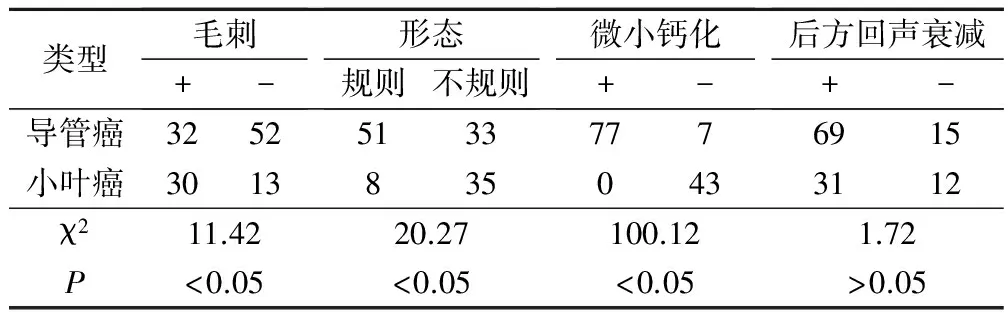
表1 乳腺癌超声征象与病理类型的关系/例
2.2 超声征象与组织学分化
84例浸润性导管癌患者中,在毛刺和形态上高中分化和低分化之间存在统计学差异(P<0.05)。见表2。

表2 84例浸润性导管癌超声征象与组织学分化的关系/例
3 讨论
乳腺癌是常见的人类恶性肿瘤之一[4],根据最近世界卫生组织对乳腺癌患者调查发现,自从进入到2010年以来,每年全世界新患有乳腺癌的患者大约在150万,而中国每年发现新增病例大约在30万[5]。随着医疗技术的进步,越来越多的乳腺癌早期被发现。而超声以无创、简便、价廉等优势,依然是目前乳腺常规检查的首选方式,具有较高的诊断价值。
乳腺恶性肿瘤组织生长形状没有固定性,在造影显示中肿瘤四周呈现模糊状[6],双臂活动时会带有剧烈的疼痛感。乳腺良性肿瘤在形状上具有规律性,在肿瘤组织形成初期,组织结构非常小,当病情逐步恶化,肿瘤组织结构不断长大,乳房外皮外观橙皮现象偶发出现“酒窝”形态,这个时候的肿瘤情况就相当严重了[7-8],处于乳腺癌晚期阶段。早期准确诊断具有重要意义。高频超声成像技术作为价廉、简便且无创的检查方法,在清晰显示二维声像图特征的基础上可进一步显示肿块内部及周边组织情况[9-10]。利用高频超声成像技术可以更准确评估乳腺肿瘤组织情况,能显著提高对乳腺癌组织学类型及组织学分级的准确性,为乳腺癌诊断提供更有价值的参考信息[11-12]。超声具有以下几项明显优势:第一,方便快捷、无创口、费用较低,并且可以反复进行检测而不会对患者的身体产生影响;第二,任何年龄层次的人都适用,无论是老人、孕妇还是哺乳期的妇女都可以进行超声检查;第三,对致密型乳腺肿块,利用超声进行检测,可以清楚地显示出乳腺肿块的位置、形状结构以及周围组织的发散情况[13]。第四,对囊性病变和实性病变能够有效区分;第五,通过超声检查可以对病情进行进一步的细致观察,可以比较准确区分乳腺癌组织学类型及组织学分级[14]。
乳腺癌的病理类型在临床上通常分为浸润性导管癌、浸润性小叶癌、导管内癌、小叶原位癌等4种类型[13,15],以浸润性导管癌、浸润性小叶癌最为常见[16]。浸润性导管癌、浸润性小叶癌在病理类型、病变组织及临床预后上均存在显著差距[17]。本研究结果显示,经病理证实浸润性导管癌84例,浸润性小叶癌43例。经比较分析在毛刺、形态、微小钙化上浸润性导管癌和浸润性小叶癌差异具有统计学意义(P<0.05)。84例浸润性导管癌患者中,高中分化和低分化在毛刺和形态上比较存在显著差异(P<0.05)。
综上所述,乳腺癌超声征象和病理组织学变化具有关联性,超声形态特点对病理组织分型和组织学分级具有预测提示作用。
[1] Kelly KM,Dean J,Comulada WS,et al.Breast cancer detec-tion using automated whole breast ultrasound and mammogra-phy in radiographically dense breasts〔J〕.Eur Radiol,2010,20(3):734-742.
[2] 邓宏武,周征宇,万能斌,等.TAC与TC新辅助化疗方案治疗局部晚期乳腺癌疗效比较〔J〕.临床外科杂志,2012,20(11):770-772.
[3] 杨俊娥,陆 苏,刘 红,等.不同新辅助化疗方案治疗乳腺癌近期疗效观察〔J〕.中国肿瘤临床,2011,38(7):405-408.
[4] 温 静.超声弹性成像技术结合彩色多普勒超声诊断乳腺肿瘤的研究〔J〕.实用医学杂志,2012,28(10):1669-1670.
[5] von Minckwitz Gl,Untch M,Blohmer JU,et al.Definition andimpact of pathologic complete response on prognosis afterneoadjuvant chemotherapy in various intrinsic breast cancersubtypes〔J〕.J Clin Oncol,2012,30(15):1796-1804.
[6] 杨 蕾,周纯武.数字乳腺三维断层摄影技术联合FFDM与单独FFDM诊断乳腺癌的比较研究〔J〕.中国临床医生杂志,2015,43(4):32-35.
[7] Paul W.Stoodley,David A.B,et al.The potential role of echocardiographic strain imaging for evaluating cardiotoxicity due to cancer therapy〔J〕.Heart Lung Circ,2011,20(1):3-9.
[8] Raza S,Odulate A,Ong EM,et al.Using real-time tissue elastography for breast lesion evaluation:our initial experience〔J〕.J Ultrasound Med,2010,29:551-563.
[9] Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010〔J〕.CA CancerJ Clin,2010,60(5):277-300.
[10] 董晓秋,邵小慧,王思明,等.乳腺良恶性疾病超声造影典型模式分析及其临床价值〔J〕.中国超声医学杂志,2010,11:39-41.
[11] 耿翠芝.2010 年乳腺癌相关研究进展〔J〕.中国医学前沿杂,2011,3(1):53-55.
[12] Ohyama K,Tomonari M,Ichibangase T,et al.A toxicoproteomic study on cardioprotective effects of pre-administration of docetaxel in a mouse model of adriamycin-induced cardiotoxicity〔J〕.Biochem Pharmacol,2010,80(4):540-547.
[13] těrba M,Popelová O,Leno J,et al.Proteomic insights into chronicanthracycline cardiotoxicity〔J〕.J Mol Cell Cardiol,2011,31:132-135.
[14] 龚 丽,邹天宁.乳腺癌分子分型与新辅助化疗疗效关系的研究〔J〕.中国医药导报,2013,10(13):42-44.
[15] Patrick G,Morris,Monica N.Optimizing the use of anthracyclines in older patients with breast cancer〔J〕.Crit Rev Oncol Hematol,2011,77(2):131-141.
[16] Galetta F,Franzoni F,Cervetti G,et al.In vitro and in vivo study on the antioxidant activity of dexrazoxane〔J〕.Biomed Pharmacother,2010,64(4):259-263.
[17] 蔡 媛,翁寿田,车潇良,等.乳腺癌组织学类型及分级对预测新辅助化疗疗效的价值〔J〕.现代肿瘤医学,2013,21(1):78-80.

