β-榄香烯注射液对人肝癌HepG-2细胞侵袭、迁移的作用及其相关机制
毛雨秋
肝癌恶性程度高、预后差,是消化系统比较多见的恶性肿瘤。手术切除仍是临床治疗肝癌的有效方式之一,但复发率较高[1-2]。术后肿瘤复发、侵袭及转移是影响肝癌患者预后的关键因素。但肿瘤侵袭及转移的机制较为复杂,目前尚未研究确切。据报道[3-4],基质金属蛋白酶(MMPs)可有效降解胶原原纤维和细胞外基质成分,与肿瘤的侵袭、转移机制具有密切关联。β-榄香烯主要是由姜科植物中提取而来,是一种典型的抗肿瘤成分,体外研究表明,β-榄香烯注射液具有良好的抗肿瘤活性,可诱导肿瘤细胞快速凋亡,但其具体作用机制尚不确切[5-7]。本研究旨在探讨β-榄香烯注射液对人肝癌HepG-2细胞侵袭及转移的影响,进一步分析HepG-2细胞侵袭及转移机制,现报告如下。
1 材料与方法
1.1 材料
1.1.1 细胞株 人肝癌细胞株HepG-2,购于中科院上海细胞库。
1.1.2 主要试剂及仪器 β-榄香烯注射液(由大连金港制药厂提供,并经南京中医药大学药学院药化实验室鉴定,纯度为99.8%),DMEM培养基,胎牛血清(FBS,GIBCO公司),四甲基偶氮噻唑蓝(MTT,购于Sigma公司),Transwell小室(Millipore公司),胰蛋白酶(Bio SHARP公司),β-actin(Sigma公司),兔抗MMP-2/9抗体(Santacruz公司),羊抗兔IgG-辣根过氧化物酶(HRP)(Bio world公司);电泳仪(Bio Rad公司)。
1.2 方法
1.2.1 HepG-2细胞培养 以含有10%FBS的DMEM高糖培养基,置于37 ℃、5%CO2培养箱中培养,待细胞生长贴壁达亚融合状态时,以0.25%胰酶消化,备用。
1.2.2 MTT法检测细胞活力 将对数生长期细胞以胰酶消化,配置成细胞悬液,调整细胞悬液浓度为105个/mL,接种于96孔板,100 μL/孔。分别加入浓度为0、10、20、30、50、100、200、400 μg/mL的β-榄香烯注射液处理24 h,各样本设置5个复孔。加入5 μg/mL新鲜配置的MTT溶液20 μL,孵育4 h后吸除上清;然后加二甲基亚砜(DMSO)150 μL/孔,于摇床震荡10 min。以酶标仪测定各孔490 nm下的吸光度(OD490 nm)并详细记录,细胞活力指数=(实验组OD490 nm/阴性对照组OD490 nm)×100%。
1.2.3 细胞-基质粘附实验检测细胞粘附能力 将对数生长期的细胞接种于6孔板,106个/孔,分别以浓度为0、10、20、30 μg/mL的β-榄香烯注射液处理24 h后,以含10% FBS的培养液重悬,接种于预先铺好Matrigel基质胶的96孔板中,104个/孔,各孔设置3个复孔,继续培养1 h。然后以甲醇固定粘附细胞15 min,加入0.1%的结晶紫染色液,清洗,风干,以0.2% TritonX-100溶解,采用酶标仪测定各孔550 nm下的吸光度(OD550 nm)并详细记录。细胞粘附率=(实验组550 nm/阴性对照组OD550 nm)×100%。
1.2.4 Transwell迁移/侵袭实验检测HepG-2细胞的侵袭及迁移情况 细胞样本的分组及给药方式同上。处理24 h后用无血清培养液调整细胞浓度为5×105个/mL,取200 μL细胞悬液加至Transwell上室,另取600 μL含20% FBS的培养基加入Transwell下室,24 h后取出Transwell小室,经PBS洗3次,以棉签擦去上室未穿过去的细胞,加入甲醇固定15 min,PBS洗3次,加0.1%的结晶紫染液,30 min后以自来水洗涤,于倒置相差显微镜下观察细胞迁移情况,拍照并记录,计算HepG-2细胞的迁移抑制率。侵袭实验的方法与迁移实验相似,不同之处是在上室加入50 μL 1∶8比例稀释过的Matrigel基质胶。于倒置相差显微镜下观察细胞侵袭情况,拍照并记录,计算HepG-2细胞迁移、侵袭抑制率,抑制率=(对照组-实验组)迁移、侵袭细胞数量/对照组迁移、侵袭细胞数量×100%。
1.2.5 蛋白免疫印迹(Western blot)法检测MMP-2及MMP-9基因的表达情况 细胞样本的分组及给药方式同上。处理24 h后提取细胞蛋白,经BCA法检测蛋白浓度并调节一致。取50 μg蛋白上样(β-actin为内参),以用10%的分离胶及5%的浓缩胶进行SDS PAGE电泳,电泳结束后,将凝胶上的蛋白转移至PVDF膜上,以封闭液在室温下封闭1 h,加入一抗(兔抗MMP-2/9抗体,工作浓度为1∶1 000),4 ℃下孵育过夜,TBST洗膜3次,10 min/次,随后加入二抗(HRP标记的羊抗兔IgG,工作浓度1∶5 000),室温摇床上缓慢摇动1 h,TBST洗膜3次,10 min/次,发光液发光后,凝胶成像仪下扫描拍照。
1.3 统计学方法
应用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,进行t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 MTT检测β-榄香烯注射液对HepG-2细胞活力的影响
MTT检测结果显示,当β-榄香烯注射液浓度为50、100、200及400 μg/mL时,HepG-2细胞活力明显降低,且HepG-2细胞的活力随β-榄香烯注射液浓度的增大而明显降低(P<0.05),具有浓度依赖性。见图1。因此本研究选取β-榄香烯注射液浓度0、10、20、30 μg/mL,以排除高浓度β-榄香烯注射液对HepG-2细胞增殖活性的影响,而进行后续实验。
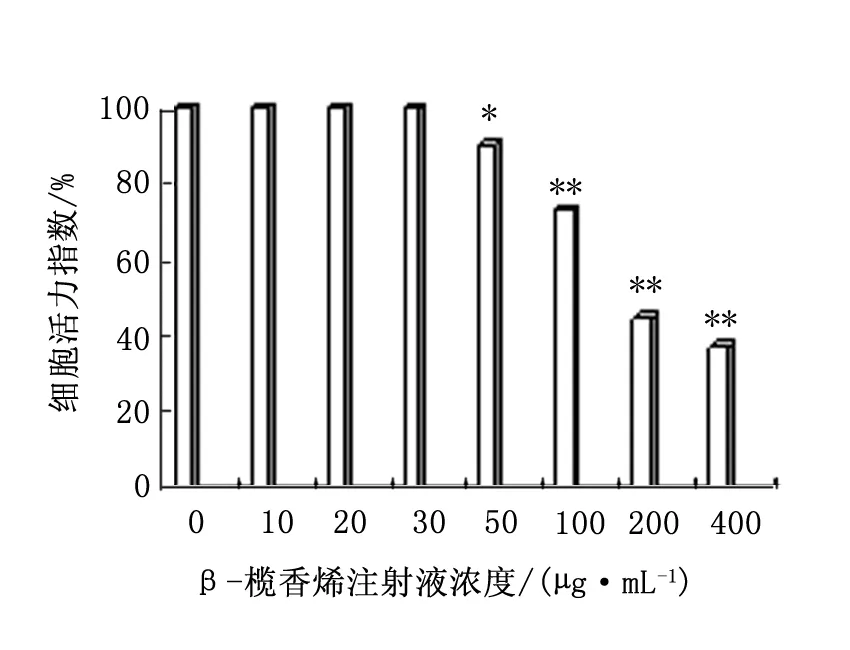
图1 MTT检测β-榄香烯注射液对HepG-2细胞活力的影响
2.2 β-榄香烯注射液对HepG-2细胞粘附能力的影响
细胞-基质粘附实验结果显示,随着β-榄香烯注射液浓度的增大,HepG-2细胞的粘附率明显降低(P<0.05或P<0.01)。见图2。

图2 β-榄香烯注射液对HepG-2细胞粘附能的影响
2.3 β-榄香烯注射液对HepG-2细胞侵袭及迁移能力的影响
Transwell迁移及侵袭实验结果显示,随着β-榄香烯注射液浓度的加大,HepG-2细胞侵袭及迁移数量逐步降低,且β-榄香烯注射液浓度为20、30 μg/mL的HepG-2细胞迁移及侵袭细胞数量明显降低,而迁移及侵袭抑制率显著升高(P<0.05或P<0.01)。见表1。
2.4 β-榄香烯注射液对HepG-2细胞MMP-2、MMP-9蛋白表达的影响
Western blot实验显示,随着β-榄香烯注射液浓度的加大,MMP-2及MMP-9蛋白表达量均逐渐降低,且对MMP-2蛋白表达的抑制作用更为显著。见图3。
3 讨论
肝癌是目前导致人类死亡的主要恶性肿瘤之一,其中肿瘤细胞的侵袭及迁移是导致癌症患者死亡的主要原因。β-榄香烯是从姜科植物温莪术中提取的萜烯类化合物。早在上世纪70年代就发现莪术挥发油对局部治疗宫颈癌效果显著。近年来研究发现,β-榄香烯是温莪术抗肿瘤作用的主要有效成份,其具有广谱抗肿瘤作用,疗效确切且毒副作用轻微,目前在临床广泛用于肺癌、恶性浆膜腔积液、消化道肿瘤、脑瘤或其它浅表性肿瘤的治疗[8-9]。但有关β-榄香烯注射液抗肿瘤的作用机制尚不确切,本研究主要探讨β-榄香烯注射液对HepG-2细胞侵袭及迁移能力的影响,探讨其抗肿瘤机制。
本研究中体外基础实验证实,β-榄香烯注射液对HepG-2细胞增殖活性具有明显的选择性抑制作用,其中当β-榄香烯注射液浓度为50、100、200及400 μg/mL时,HepG-2细胞活力明显降低,且HepG-2细胞活力随β-榄香烯注射液浓度的增大而明显降低,具有浓度依赖性,因此本研究选取β-榄香烯注射液浓度为0、10、20、30 μg/mL,排除高浓度β-榄香烯注射液对HepG-2细胞增殖活性的影响。粘附是HepG-2肿瘤细胞侵袭的开始,肿瘤细胞表面特定的受体可与正常细胞基膜的层粘连蛋白、纤维连接蛋白和Ⅳ型胶原蛋白等粘连,在蛋白水解酶及相关因子的作用下,侵袭基膜,降解细胞外基质,进行快速侵袭性生长并发生转移[10]。本研究中通过细胞-基质粘附实验结果显示,随着β-榄香烯注射液浓度的增大,HepG-2细胞的粘附率明显降低,提示β-榄香烯注射液可有效降低HepG-2细胞的粘附能力,阻碍其后续的侵袭及转移。此外,本研究中采用与天然基膜极为相似的基质胶铺在Transwell小室膜上,进行Transwell小室侵袭及迁移实验,形象地在体外模拟肿瘤细胞侵袭、迁移过程,结果显示,HepG-2细胞侵袭及迁移数量随β-榄香烯注射液浓度的增加而呈逐渐降低趋势,且当浓度为20、30 μg/mL时HepG-2细胞迁移及侵袭细胞数量明显降低,而迁移及侵袭抑制率显著升高。提示β-榄香烯能有效地降低HepG-2肝癌细胞侵袭和迁移的能力,且呈剂量依赖性,与相关研究[11]结果相似。
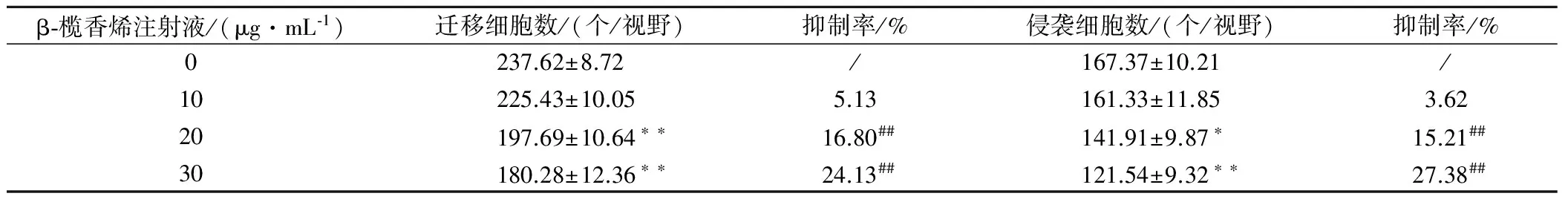
表1 β-榄香烯注射液对HepG-2细胞增殖的影响
与0 μg/mL比较,*为P<0.05,**为P<0.01;##为与10 μg/mL比较,P<0.01。

图3 β-榄香烯注射液对HepG-2细胞MMP-2、MMP-9蛋白表达的影响
肿瘤细胞侵袭及转移是一个复杂的、连续的多步骤的过程,也是导致肿瘤患者恶性程度升高的关键。肿瘤细胞具有从原发部位迁移并进行增殖的能力,其不仅与肿瘤细胞自身改变有关,也与宿主微环境与肿瘤细胞间的相互作用有关[12]。MMPs是参与细胞外基质和基膜降解的蛋白水解酶,其中MMP-2及MMP-9是典型的MMPs,HepG-2细胞中MMPs的结构功能及水平的变化与HepG-2细胞侵袭及迁移密切相关。本研究中Western blot实验结果显示,随着β-榄香烯注射液浓度的加大,MMP-2及MMP-9蛋白表达量均逐渐降低,且对MMP-2蛋白表达的抑制作用更为显著,提示β-榄香烯注射液可明显减少细胞外基质和基膜的降解,降低肝癌细胞侵袭和转移的能力。
综上,β-榄香烯注射液可显著降低肝癌HepG-2细胞的粘附能力,并抑制其侵袭及迁移,其作用机制很可能与其明显下调机体MMP-2、MMP-9蛋白表达相关,但具体的抗肝癌作用机制仍需临床进一步深入研究。
[1] 孙 宇,单路娟,刘越坚,等.华蟾素注射液对人肝癌HepG-2细胞增殖及凋亡的影响〔J〕.中国肿瘤,2010,19(6):410-413.
[2] Lee KR,Kozukue N,Han JS,et al.Glycoalkaloids and metabolites inhibit the growth of human colon (HT29) and liver (HepG2) cancer cells〔J〕.J Agric Food Chem,2004,52(10):2832-2839.
[3] 赵 新,董 磊,洪智贤,等.新型基质金属蛋白酶抑制剂LY52对肝癌细胞HepG2.2.15体外侵袭能力的影响〔J〕.传染病信息,2012,25(5):269-272.
[4] 吴 丹,冯 华,赵 然,等.MMP2和MMP9在HepG2肝癌细胞系及HCC组织中表达的比较研究〔J〕.哈尔滨医科大学学报,2010,44(1):29-32.
[5] 毛雨秋,梁鑫淼,付海雁,等.β-榄香烯注射液对人肝癌HepG-2细胞微管蛋白α的影响〔J〕.中国肿瘤,2012,21(2):145-149.
[6] 龚 敏.榄香烯对人肝癌HepG-2细胞拓扑异构酶Ⅰ和Ⅱ的影响〔D〕.大连医科大学,2011.
[7] 李学农,庄将协.β-榄香烯对人肝癌细胞侵袭转移及相关机制的实验研究〔J〕.福建医药杂志,2012,34(3):70-73.
[8] 花文峰,蔡绍晖.β-榄香烯抗肿瘤作用的基础与临床研究〔J〕.中药材,2006,29(1):93-97.
[9] 郑 瑾,刘 强,任凯夕,等.β-榄香烯对肝癌细胞SK-hep-1的迁移和侵袭力的影响〔J〕.现代肿瘤医学,2009,17(11):2054-2058.
[10] 李茹茹,史恒军,任秦有,等.β-榄香烯抑制HepG2细胞侵袭及转移的作用机制〔J〕.现代肿瘤医学,2016,24(12):1870-1875.
[11] Shi H,Liu L,Liu L,et al.β-Elemene inhibits the metastasis of B16F10 melanoma cells by downregulation of the expression of uPA,uPAR,MMP-2 and MMP-9〔J〕.Melanoma Res,2014,24(2):99.
[12] 李 悦,杨向红,刘云鹏.β-榄香烯对血管内皮细胞成血管能力、细胞凋亡及MMP-2和MMP-9活性的影响〔J〕.中国医科大学学报,2012,41(7):618-621.

