三阴性乳腺癌中TOPOⅡα表达以及预后关系研究
徐国萍 王 杰 杨 莉 何 奇
三阴性乳腺癌是1种具有较强临床侵袭性表现的乳腺癌,是为雌激素受体(ER),孕激素受体(PR)以及人体表皮生长因子受体2(CerbB-2)免疫组化标记均为阴性的1种特殊类型乳腺癌[1],约占乳腺癌的15%。从目前来看临床治疗上因缺乏针对三阴性乳腺癌的靶向药物而导致治疗效果的不佳以及传统预后指标的不明确使乳腺癌预后不良的案例屡见不鲜,所以找出对三阴性乳腺癌敏感,并且对其预后有重要参考价值的生物分子指标显得非常重要。故本文针对三阴性乳腺癌的分子生物学特征进行深入探讨作为判断肿瘤预后以及寻找靶点便于临床治疗有着一定的临床指导意义。本文采用链霉亲和素-生物素-过氧化物酶复合物技术(streptavidin-biotin-peroxidsae complex method,SABC)检测186例三阴性乳腺癌患者病理组织中TopoⅡα的表达,并综合患者的年龄、肿瘤大小和病理类型、临床分期、组织学分级和有无淋巴结转移情况展开深入的分析和讨论。
1 材料与方法
1.1 研究对象
选取2015年1月至2016年12月我院收治的186例经病理证实的女性三阴性乳腺癌患者。年龄≥60岁的43例,<60岁的143例,中位年龄69岁。其中肿瘤直径>5 cm者9例,≤2 cm者101例,>2 cm且≤5 cm者76例。病理组织学类型:浸润性导管癌165例,导管原位癌21例。腋窝淋巴结转移阴性者123例,腋窝淋巴结转移阳性者63例。TNM分期:Ⅰ期72例,Ⅱ期92例,Ⅲ期22例。组织学分级:Ⅰ级12例,Ⅱ级72例,Ⅲ级102例。所有患者均进行常规胸片以及腹腔B超,并确定肿瘤分期和排除其他肿瘤的可能。经过穿刺活检以及外科手术的方式采集三阴性乳腺癌的组织标本,并应用10%福尔马林液固定,石蜡包埋,DAB显色。另选择40例乳腺增生患者以及40例导管上皮不典型增生患者为良性对照。
1.2 主要试剂
鼠抗人TopoⅡα单克隆抗体及其相关试剂主要购于上海拜力生物科技有限公司。
1.3 方法
采用SABC免疫组化法[2]。先将组织切片用EDTA修复液抗原,缓冲液切片PBS冲洗。于标本上滴加山羊血清封闭液,室温20 min。滴加Ⅰ抗(鼠抗人TopoⅡα单克隆抗体),4 ℃放置24 h。生物素化二抗(羊抗兔IgG)滴加切片。切片上滴加SABC,PBS缓冲液冲洗,DAB显色,蒸馏水冲洗。再使用苏木精复染、盐酸酒精分化。酒精脱水,用二甲苯透明、树胶封片。用正常的PBS代替一抗作为阴性对照,实验人员按照试剂盒要求严格进行操作。
1.4 结果评定标准
所有标本切片染色后均由研究者和病理科医生通过双盲法读片。每例切片在光镜下选取5高倍镜视野进行结果判定,免疫组化阳性反应为出现棕褐色颗粒并参照二级计分法:①按照阳性细胞计数:阳性细胞≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;②按照染色深浅:无染色为0分,黄色1分,棕黄色2分,棕褐色为3分。两者得分乘积≥4~6分为阳性表达,7~9分为强阳性表达,<4分为阴性表达。
1.5 统计学处理
数据应用SPSS 20.0软件分析,计数资料应用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 TopoⅡα在三阴性乳腺癌中的表达情况
TopⅡα主要定位于细胞核染成棕黄色。186例三阴性乳腺癌组织中TopoⅡα阳性率表达率为70.9%(132/186),与40例乳腺增生组织中TopoⅡα阳性率表达[27.5%(11/40)]以及40例导管上皮不典型增生组织中TopoⅡα阳性表达率[22.5%(9/40)]相比,差异具有统计学意义。在165例浸润性导管癌中TopoⅡα阳性或强阳性表达有122(73.9%)例,与在21例导管原位癌[10例(47.6%)]相比,差异具有统计学意义。TopoⅡα表达在乳腺增生组织转变为三阴性乳腺癌以及乳腺癌发生发展的过程中水平不断提高,TopoⅡα可能与乳腺增生组织的恶性转变有关,见表1。
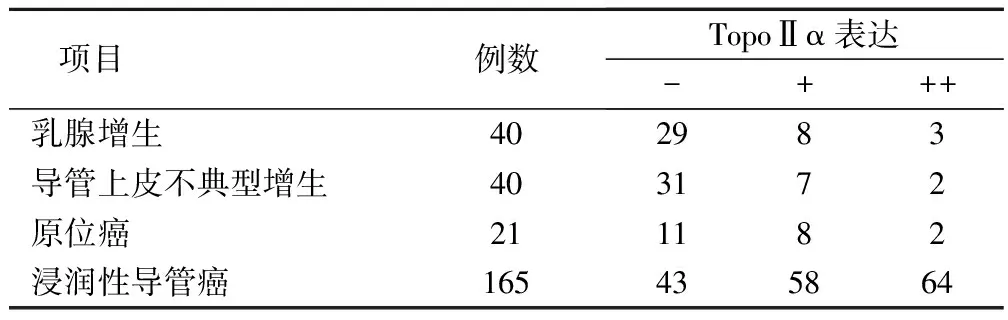
表1 TopoⅡα在乳腺疾病组织中的表达情况/例
2.2 TopoⅡα表达与浸润性导管癌各临床病理指标的关系
三阴性乳腺癌中TopoⅡα表达与患者年龄、肿瘤大小、组织学分级、TNM临床分期均无关(P>0.05),TopoⅡα表达与淋巴结转移有关,TopoⅡα阳性表达率在腋窝淋巴结转移者中高达80.9%,在未发生淋巴结转移者中仅有49.6%,差异具有统计学意义(P<0.05),见表2。
3 讨论
乳腺癌是女性发病率最高的恶性肿瘤[3],约占所有恶性肿瘤的23%。其中三阴性乳腺癌约占所有乳腺癌病理类型的15%左右,具有组织学分级高、病理类型几乎均为导管癌、肿瘤细胞多表达等特点,由于其雌、孕激素受体均为阴性,使其无法从较为成熟的乳腺癌内分泌治疗以及靶向治疗中收益,使得在临床治疗中滥用化疗药物给患者带来不良的预后以及经济方面的困难,因此对这一群体的研究显得非常重要和迫在眉睫。故本文从蛋白质的角度来选择癌症发生发展中的特异性指标TopoⅡα来研究希望可以为临床治疗提供有效的信息。
DNA拓扑异构酶(Topo)主要存在于真核及原核细胞中并参DNA复制、转录、重组,DNA拓扑异构酶可分为Ⅰ型和Ⅱ型两种[4]。TopoⅡ又称旋转酶,具有α和β两种同工酶,TopoⅡα位于增殖细胞中,通过在DNA的复制过程中,使其形成1个双链缺口从而使得双链DNA与断裂的DNA通过此缺口来进行重新连接使得下一步解链复制得以进行,TopoⅡα蛋白在细胞分裂时 DNA 转录、重组、复制,染色体固缩和分离及染色体结构的保持上起重要作用[5]。Bria等[6]发现,TopoⅡα的表达具有周期特异性,在细胞周期S期-G2/M期TopoⅡα含量快速上升,有丝分裂后(G1、G0期)下降,TopoⅡα蛋白阳性提示肿瘤细胞处于增殖状态,可反映肿瘤细胞的增殖活性。TopoⅡα 的蛋白编码位于人染色体17q12-21这一区域内,这意味着无论TopoⅡα扩增或缺失都预示着不良的预后。也有研究表明,TopoⅡα在乳腺癌组织的表达与预后指标存在一定的关系[7]。在本实验的结果中可以看出从乳腺增生组织发展成原位癌再进一步成为浸润性导管癌的过程中,TopoⅡα的表达逐渐增强,染色程度有黄色发展成棕褐色,在腋窝淋巴结转移的过程中也发现了TopoⅡα的阳性表达增高。这进一步说TopoⅡα的表达使得细胞复制加快并随着肿瘤的不断增殖,恶性程度的不断提高而升高。这可以从正面反映TopoⅡα可以预示肿瘤的发生发展以及预后的关系。在目前三阴性乳腺癌的临床治疗中,将蒽环类和紫杉醇类药物纳入辅助化疗方案已经基本达成共识。蒽环类药物的作用机制是抑制TopoⅡα,通过与TopoⅡαDNA复合体相互作用,导致双链DNA断裂随后发生细胞凋亡[8]。然而,蒽环类药物的抗肿瘤过程中膜脂过氧化导致自由基形成,具有心脏毒性。所以,应用蒽环类药物治疗乳腺癌之前,要权衡预期的疗效和副作用,选择可能最大受益的个体,有鉴于此,需深入研究TopoⅡα的基因状况而TopoⅡα为蒽环类抗生素的作用靶点,肿瘤内TopoⅡα表达能直接影响到化疗的整体疗效水平,这点与韩艳春等[9]的研究观点一致。是否在联合化疗中添加TopoⅡα抑制剂来提高肿瘤对抗肿瘤药物的敏感性以获得更好的疗效和预后使得TopoⅡα的检测在临床治疗的过程中变得至关重要,也在用药方面提出了指导性意见,值得进一步推广和深入的研究。在本实验中,研究TopoⅡα在三阴性乳腺浸润性导管癌的病理指标时发现,TopoⅡα在发生腋窝淋巴结转移时阳性表达率高达80.9%显著高于未发生腋窝淋巴结转移患者的阳性表达率49.6%,但与患者的年龄大小,肿瘤的组织学分级以及TNM分期无关。这证明了TopoⅡα的高表达率能提示肿瘤出现淋巴结转移的情况,能为肿瘤恶性程度以及出现转移做出预示和评价。也有研究表明TopoⅡα高表达也可能与肿瘤发生远端转移有关[10]。另外据报道,在TopoⅡα阳性表达高度时,患者采用单一药物阿霉素进行治疗,其症状缓解程度相对较高,体内TopoⅡα高度表达的乳腺癌患者依然可以通过蒽环类抗肿瘤药物取得显著的疗效[11]。
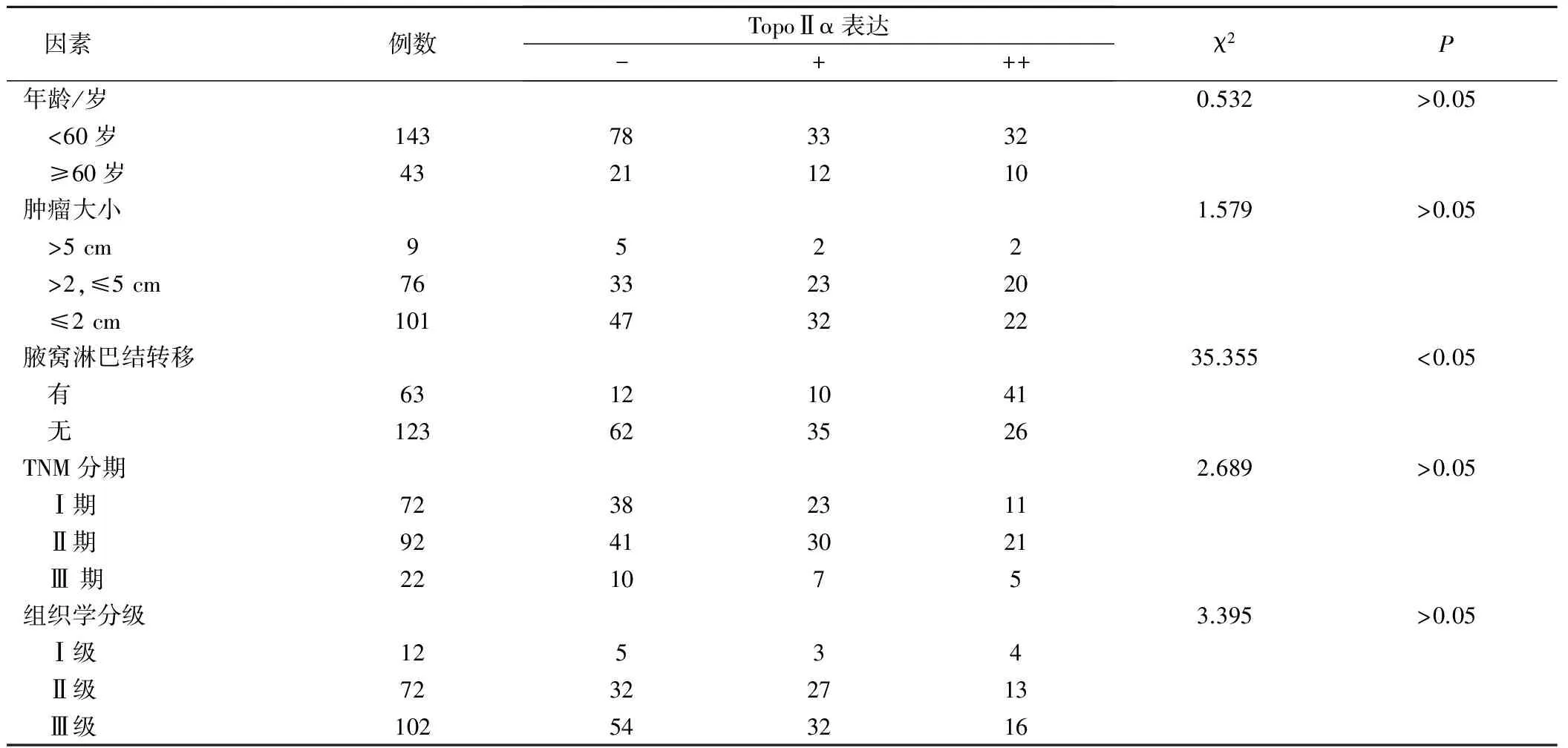
表2 浸润性导管癌TopoⅡα表达与临床病理特征的关系/例
不仅仅在三阴性乳腺癌中,李晶等人发现TopoⅡα阳性表达与胃癌的浸润程度,淋巴结转移,脉管内癌栓有显著的相关性[12];屈王蕾等发现TopoⅡα表达随着宫颈癌前病变的严重程度而上调,可能参与宫颈上皮的异常增殖和恶性转变[13]。
综上所述,TopoⅡα的高度表达患者肿瘤恶性程度高,出现淋巴结转移以及肿瘤转移的可能性高,检测TopoⅡα可以为预后提供评价。免疫组化法易于检测TopoⅡα可为患者制定个体化化疗方案以及用药指导提供可靠的依据。TopoⅡα可作为化疗用药选择的指导标准。TopoⅡα在胃癌、宫颈癌等其他癌症中也有表达,TopoⅡα值得研究人员和学者们进行更加深入的研究和学习。
[1] 李春艳.张 晟.刘 艳.等.三阴型乳腺癌159例临床病理特征分析〔J〕.实用癌症杂志,2012,27(6):624-626.
[2] Gumuskaya B,Alper M,Hucumenoglu S,et al.EGFR expression and gene copy number in triple-negative breast carcino-ma 〔J〕.Cancer Genet Cytogenet,2010,203 (2):222.
[3] 葛文凯,左文述.乳腺癌与Kindlin基因相关性的研究进展〔J〕.肿瘤防治研究,2014,41(6):686-688.
[4] 陈 旺.DNA拓扑异构酶Ⅱα拟天然产物抑制剂的设计合成与抗肿瘤活性研究〔D〕.山东大学,2015.
[5] urden DA,Osheroff N.Mechanism of action of eukaryotictopoisomeraseⅡ and drugs targetedto the enzyme〔J〕.Biochimbio-phys Acta,1998,1400(6):139-154.
[6] Bria E,Furlanetto J,Carbognin L,et al.Human epidermal growth factor receptor 2-positive breast cancer:heat shock protein 90 overexpression,Ki67 proliferative index,and topoisomerase II-α co-amplification as predictors of pathologic complete response to neoadjuvant chemotherapy with trastuzumab and docetaxel〔J〕.Clin Breast Cancer,2015,15(1):16-23.
[7] 马 静.三阴乳腺癌患者预后生存因素分析及BRCA1、TopoⅡα、Bcl-2对乳腺癌预后影响〔D〕.河北医科大学,2012.
[8] 邵牧民.徐 华.余学问.等.基底型乳腺癌中拓扑异构酶Ⅱ α基因状态分析〔J〕.临床与实验病理学杂志,2010,26(4):421-424.
[9] 韩艳春,刘鲁英,王 霞,等.多药耐药基因产物和激素受体在乳腺癌中的表达及意义〔J〕.滨州医学院学报,2014,37(1):5-8.
[10] Du YY.Progress sensitivity DNA topoisomerase Ⅱα( topo Ⅱα)and anthracycline chemotherapy in breast cancer〔J〕.Fudan University( Medical Sciences),2012,39(2):203- 206.
[11] 肖华伍.欧阳取长.TopoⅡα在乳腺癌组织中表达及其与蒽环类药物敏感性的关系〔J〕.实用癌症杂志,2013,28(6):590-592.
[12] 李 晶.汪 竹.袁 昕.Ki67和 TOPOⅡα在胃癌中的表达及临床意义〔J〕.现代肿瘤医学,2015,23(5):666-668.
[13] 屈王蕾,高宝辉,董剑达.TopoⅡα在宫颈癌前病变中的表达及其与高危型人乳头瘤病毒感染的关系〔J〕.医学研究杂志,2012,41(2):25-28.

