响应面法优化鲟鱼精蛋白肽的酶解提取
白婵,饶丹华,2,熊光权,磨定信,张金木,王宝华,李宁,廖涛*
1(湖北省农业科学院农产品加工与核农技术研究所/湖北省农产品辐照工程技术研究中心,湖北 武汉,430064) 2(武汉工程大学 化学与环境工程学院,湖北 武汉,430073)3(武汉鲟龙生物科技有限公司,湖北 武汉,430015)
合成药物和添加剂总是伴随有一定的毒性,通过适当的方法分离天然活性物质不仅可以保持功能活性物质,还可大大降低对机体的致毒性和免疫性,并且分子质量越小安全性越高吸收也越好,因此,小分子质量的天然活性蛋白肽类近年来越来越成为研究重点。CHEN[1]等人发现大豆多肽具有良好的抗氧化性,可以显著抑制脂质的过氧化进程。MOURE等[2]的研究表明不同分子质量的大豆多肽组分当中,分子质量小于10 kDa的组分抗氧化活性最强。
鱼精蛋白是鱼类精巢组织当中一类具有多种药用功能的蛋白质,并且在体外心脏循环手术当中充当重要的抗肝素剂[3],此外还具有良好的抑菌谱特性,早在1937年M UYTTENDAELE就报道了鱼精蛋白具有抗菌活性[4]。鱼精蛋白作为异种蛋白在临床上仍有过敏反应发生[5],王万娟等[6]就曾报道鱼精蛋白致使过敏者出现毛细血管渗漏综合征。刘妍妘[7]通过ELISA和Western-blotting分析确定了大黄鱼鱼精中的主要过敏原为12 kDa的蛋白组分。通过酶解,降低活性蛋白分子量可以有效避免过敏。
目前为止除了王勇刚等[8-9]鲜少有酶解鱼精蛋白多肽的研究,现在我国已成为世界鲟鱼第一养殖大国,年产量约15 000 t,鲟鱼向来以高营养价值著称,蛋白质含量高,8种必需氨基酸评分均超过WHO推荐的成人氨基酸需要量模式[10]。鲟鱼-甲骨板是达氏鳇和史氏鲟的杂交品系,由于其生长快,抗病力强,已在湖北省乃至全国广泛人工养殖。且甲骨板精巢组织(俗称鱼白)较大,约占鱼体重的8%,本实验对淡水鲟鱼-甲骨板精蛋白肽的酶解工艺进行探究,通过构建优化方案制备鱼精蛋白肽,为相应产品的开发提供基础,提供鲟鱼加工副产物的综合价值,从而推动鲟鱼产业链的快速发展。
1 材料与方法
1.1 材料来源与主要试剂
1.1.1 原料及来源
鲟鱼(AcipensersturioLinnaeus)鱼白(固态组织)由武汉鲟龙生物科技有限公司于2016年春季提供。
1.1.2 主要试剂
胃蛋白酶(3 000 U/mg),木瓜蛋白酶(650 U/mg),胰蛋白酶(650 U/mg),Sigma-Aldrich公司;NaCl,浓H2SO4,乙醇,乙醚,异丙醇等(分析纯),国药集团。
1.2 仪器与设备
GL-25MS高速冷冻离心机,上海卢湘仪离心机仪器有限公司;DF-101S集热式恒温加热磁力搅拌器,武汉科尔仪器设备有限公司;凯氏定氮装置,蜀牛化玻仪器有限公司。
1.3 试验方法
1.3.1 鲟鱼鱼精蛋白肽的提取[11-12]
鲟鱼鱼白解冻后置于高速组织捣碎机中捣碎,称取10 g加入100 mL 0.14 moL/L NaCl溶液,匀浆1 min后,冰浴中搅拌20 min,静置10 min,4 000 r/min低温(0 ℃)离心分离10 min,弃去上清液。重复上述操作1次,弃去上清液。沉淀用体积比为2∶2∶8的乙醚-异丙醇-蒸馏水脱脂浸提液在恒温摇床中脱脂3 h,重复脱脂1次,离心弃上清液。
沉淀按一定比例加水匀浆,加入一定量活性的酶,调至最佳pH,在一定温度恒温水浴酶解一定时间。结束用沸水浴灭酶10 min,冷却后5 000 r/min低温(0 ℃)离心15 min,取上清液冷冻干燥。以水解度为指标指示工艺选择。
1.3.2 检测方法
蛋白氮含量测定:凯氏定氮法[13]。
游离氨基氮含量测定:甲醛滴定法[14]。
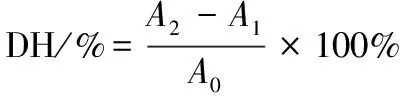
(1)
式中:DH,水解度;A0,原料蛋白氮含量;A1酶解游离氨基氮含量;A2,酶解液游离氨基氮含量。
1.3.3 单因素试验
选用木瓜蛋白酶,胃蛋白酶,胰蛋白酶对样品进行酶解,随后继续对最佳蛋白酶酶解实验的加酶量、液料比、酶解时间、pH值、酶解温度值等条件进行单因素实验。
(a)选酶。原料按液料比20∶1加入蒸馏水,对应调至木瓜蛋白酶,胰蛋白酶,胃蛋白酶最适pH值,分别加入24 000 U/g加酶量的木瓜蛋白酶,胰蛋白酶,胃蛋白酶。30 ℃恒温提取2 h。每组3个平行。
(b)加酶量。原料按液料比20∶1加入蒸馏水,调pH值至6.3,分别加入1.5%, 2%, 3%, 4%, 6%, 8%的木瓜蛋白酶。30 ℃恒温提取2 h。每组3个平行。
(c)液料比。原料分别按液料比10∶1,20∶1,30∶1,40∶1,50∶1加入蒸馏水,调pH值至6.3,加入3%的木瓜蛋白酶。30 ℃恒温酶解2 h。每组3个平行。
(d)酶解时间。原料按液料比20∶1加入蒸馏水,调pH值至6.3,加入3%的木瓜蛋白酶。30 ℃恒温提取,提取时间分别为2,4,6,8,10 h。每组3个平行。
(e)pH值。原料按液料比20加入蒸馏水,调pH分别为4、5、6、7、8,加入3%的木瓜蛋白酶。35 ℃恒温酶解2 h。每组3个平行。
(f)酶解温度。原料按液料比20∶1加入蒸馏水,调pH值至6.3,加入3%的木瓜蛋白酶。在30、40、50、55、60、70 ℃下分别恒温酶解2 h。每组3个平行。
1.3.4 响应面试验
根据单因素试验结果,采用响应面法依据Box-Behnken试验原理设计3因素3水平试验[15],进一步优化最佳工艺条件。检测指标为鱼精蛋白肽水解度,试验编码和水平如下表所示。
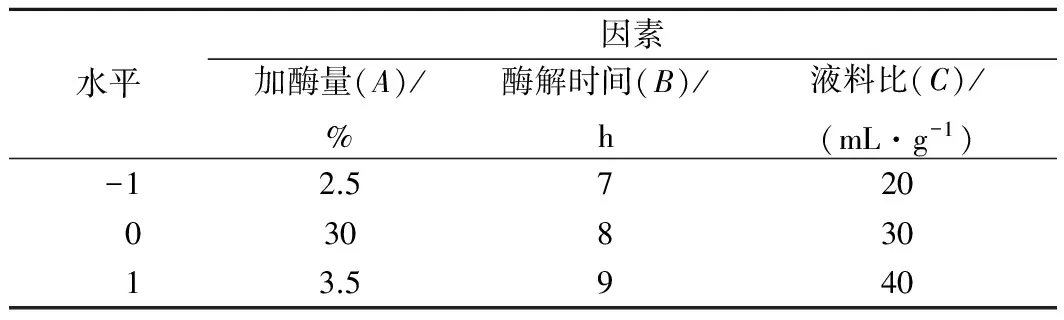
表1 响应面分析因子及水平Table 1 Analysis factors and levels in Box-Behnken design
1.3.5 蛋白肽的抑菌实验
采用滤纸片法[16-17]测试提取蛋白多肽的抑菌性,用无菌水作空白对照。
1.4 数据处理
单因素实验数据采用Origin 8.0软件处理作图,响应面实验数据采用Design-Expert V8.0.6软件处理分析。
2 结果与分析
2.1 单因素试验
由图1-A可看出,木瓜蛋白酶、胰蛋白酶和胃蛋白酶均能够使鲟鱼鱼白中的蛋白肽键断裂,产生一定的水解度,其中木瓜蛋白酶的水解程度最佳,可以获得更多小分子质量鱼精蛋白肽,远优于胃蛋白酶。可能是鱼精蛋白中主要成分为精氨酸、赖氨酸和组氨酸,而木瓜蛋白酶相对另外2种酶与这3种氨基酸具有较好的结合能力。采用木瓜蛋白酶试验加酶量、液料比、酶解时间、pH值、酶解温度等工艺条件对水解度的影响如图1-B~图1-F所示。
木瓜蛋白酶添加量对蛋白的水解度影响显著,在未达到3%添加量时,底物充足,少量添加酶都可以迅速提高水解进程,但达到3%后底物的酶解达到饱和,酶的继续增多只会引起水解度在一定范围内上下波动,此外基于经济考虑,酶添加量3%最合适。图1-C说明酶解的液料比具有峰形规律,鲟鱼鱼白溶液过浓过稀都不利于酶解反应的进行。过浓使得溶液黏性大,阻碍了酶与底物的传质过程;过稀又使得酶与底物结合的效率降低,因此在液料比30∶1时,水解度达到峰值,条件最佳。图1-D表明,酶解时间适当延长可使酶解更充分,但达到8 h后,由于蛋白水解达到饱和平衡,继续酶解作用不大,因此最佳酶解时间为8 h。酶解过程溶液的pH值和温度同样对酶解过程有影响,且均是在较低区域产生较大影响,pH值和温度由低增大,水解程度呈现先快速提高后轻微下降的趋势。pH值和温度主要对木瓜蛋白酶的活性产生影响,在pH值为7.0,温度55 ℃的溶液环境中,木瓜蛋白酶的活性最大,制备小分子蛋白肽的效果也最佳。
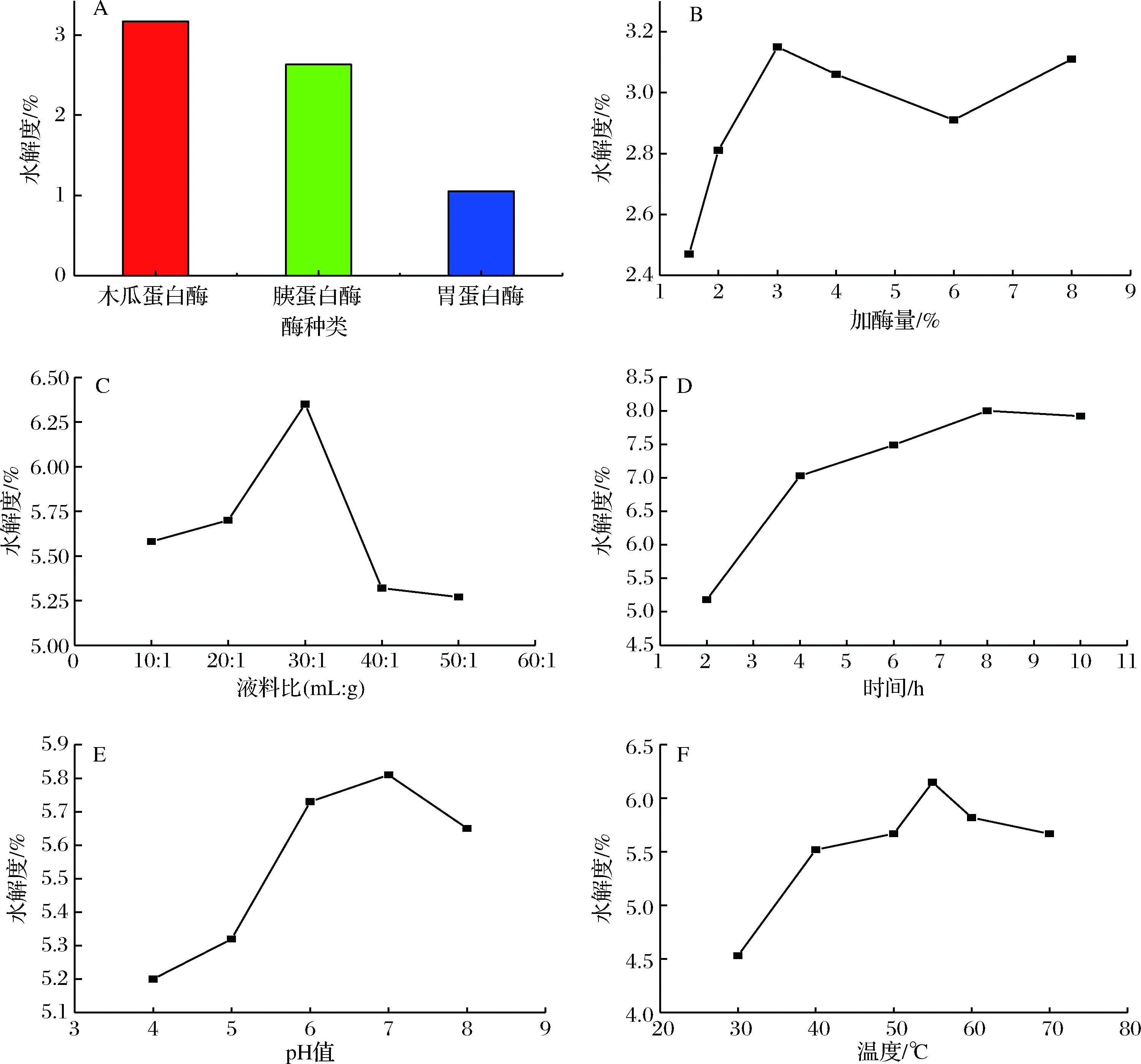
图1 单因素对鱼精蛋白水解度的影响
Fig.1 Effect of single factors on protamine hydrolysis degree
2.2 响应面试验
2.2.1 设计及结果
根据Box-Behnken 实验原理,以水解度DH为响应值,以加酶量A,酶解时间B,液料比C组成的3因素3水平响应面实验水解度的结果如表2所示。
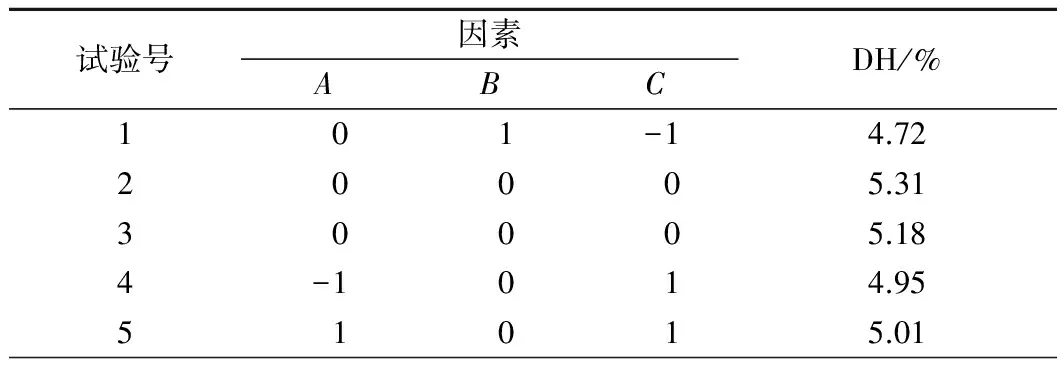
表2 试验设计方案及结果Table 2 Experimental design and results
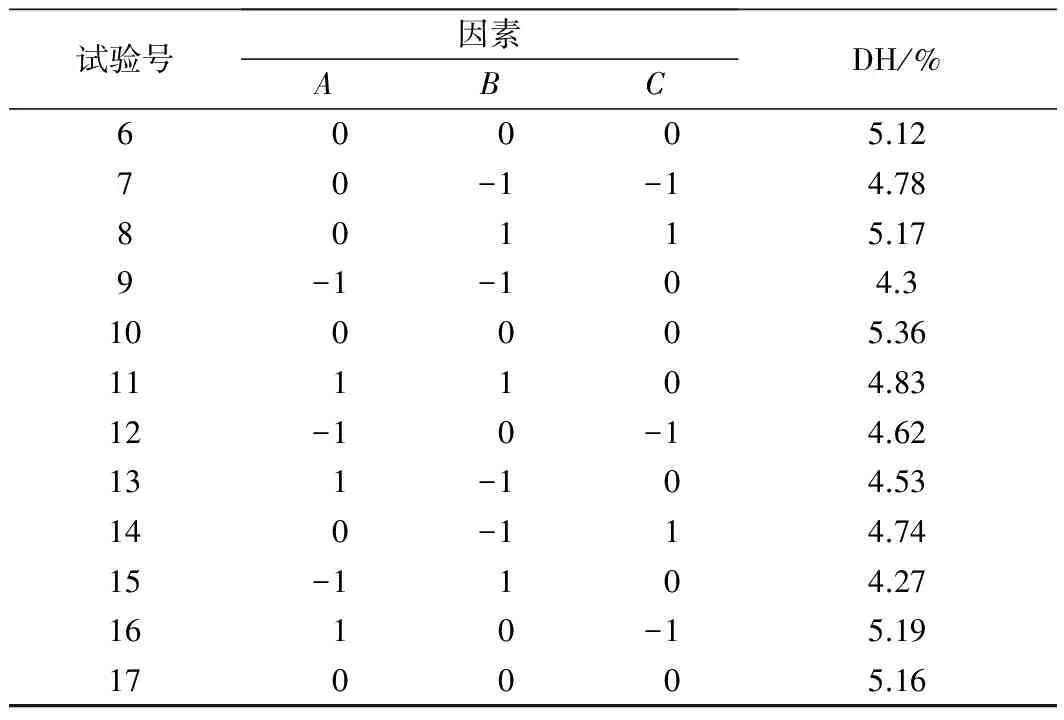
续表2
2.2.2 响应面模型可靠性分析
Design-expert软件通过拟合的回归模型,得出蛋白水解度关于加酶量A、酶解时间B和液料比C的多元二次回归方程为:
DH=-30.129 75+7.642 00A+5.885 50B-0.040 450C+0.165 00AB-0.025 500AC+0.012 250BC-1.307 00A2-0.416 75B2+4.325E-4C2
软件对试验数据进行多项拟合得到鱼精蛋白肽提取工艺的模型分析参数见表3。
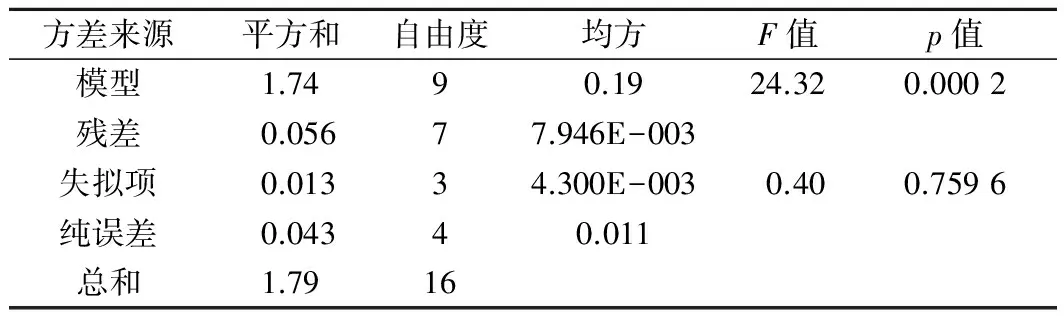
表3 回归模型的方差分析Table 3 Variance analysis of the regression model
为了检验构建模型的有效性,如表3所示对模型进行方差分析[18-19]。模型F值为24.32表明模型是显著的,由噪声引起的系统误差仅有0.02%的发生概率。当p值大于0.1时表示该模型项对水解程度的影响不显著,而本预测模型p值远小于0.05说明模型条件具有显著性,该模型中A,B,AC,BC,A2,B2均是显著影响项。失拟项的F值为0.4表示与误差相关的失拟项不显著,且模型R2=0.969 0,预测模型与实际情况的吻合度达到96.9%,综上,该预测模型可以良好准确地反映实际工艺情况,分析得出的最佳酶解工艺科学性、准确性和可靠性高。
2.2.3 响应面因素分析
预测模型对各个因素项和因素交互项进行的显著性分析结果如下:
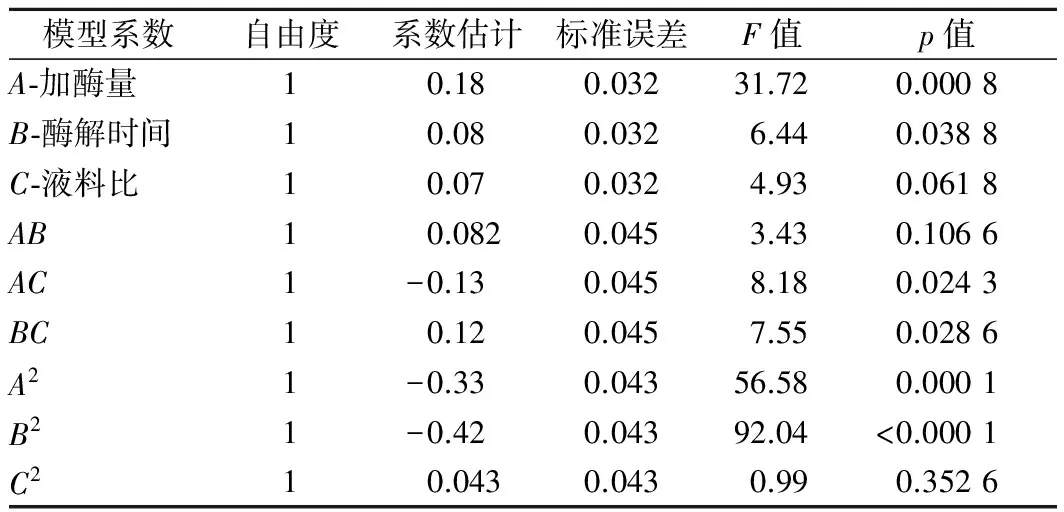
表4 回归模型系数的显著性检验Table 4 Coefficients of the regression model and theirsignificance test
由表4可知,回归模型中,因素A(加酶量)的p值=0.000 8远小于0.01,表明加酶量对鲟鱼鱼精蛋白的水解影响极其显著。因素B(酶解时间)的p值为0.01<0.038 8<0.05,表明酶解时间对鲟鱼鱼精蛋白水解度影响较为显著,因素C(液料比)的p值为0.061 8,大于0.05,表明液料比对鲟鱼鱼精蛋白的水解影响不显著,可以得知底物物料和酶量一定且酶解足够长时间如8 h时,底物溶液的浓度不会显著影响蛋白水解的平衡,只是会影响酶解过程达到平衡的时间快慢。单因素实验中酶解时间仅为2 h,酶解过程不充分,所以浓度适当增大既减少溶液的粘滞阻力又有足够大的碰撞概率,会对酶解过程的水解度产生较大影响,与8 h的不明显影响相区别。3个因素对水解度的影响依次为:加酶量>酶解时间>液料比。交互项的影响依次为:AC>BC>AB[20],AC、BC对水解度影响均较为显著。二次项中的B2、A2对水解度的影响极其显著,p值均小于等于0.000 1,说明加酶量和酶解时间是酶解工艺中必须要重点控制的条件。二次项3个因素显著性:B2>A2>C2。以上说明加酶量、酶解时间、液料比三个因素之间相互影响,并不是简单的线性关系。
2.2.3 二次交互项分析
加酶量、酶解时间和液料比两两交互作用对鱼精蛋白水解度的影响情况如图2~图4所示。
由图可知加酶量与液料比、液料比与酶解时间之间的交互作用较强,等高线图均呈明显的椭圆形,结果与上表的p值结果一致。而加酶量与酶解时间的等高线图显示类似圆形,加酶量与酶解时间交互作用较小,二者线性作用关系较强,对鱼精蛋白水解度产生叠加影响。
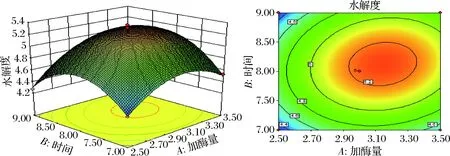
图2 液料比为30时,酶解时间和加酶量对鱼精蛋白水解度的影响
Fig.2 Effect of enzyme extraction time and pepsin amount on the extraction rate of protamine, when solvent-to-solid ratio is 30
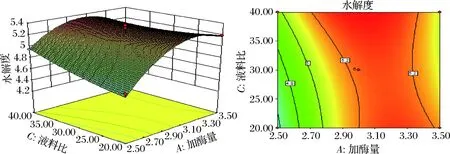
图3 酶解时间为8 h时,液料比和加酶量对鱼精蛋白水解度的影响
Fig.3 Effect of solvent-to-solid ratio and pepsin amount on the extraction rate of protamine, when enzyme time is 8 hours
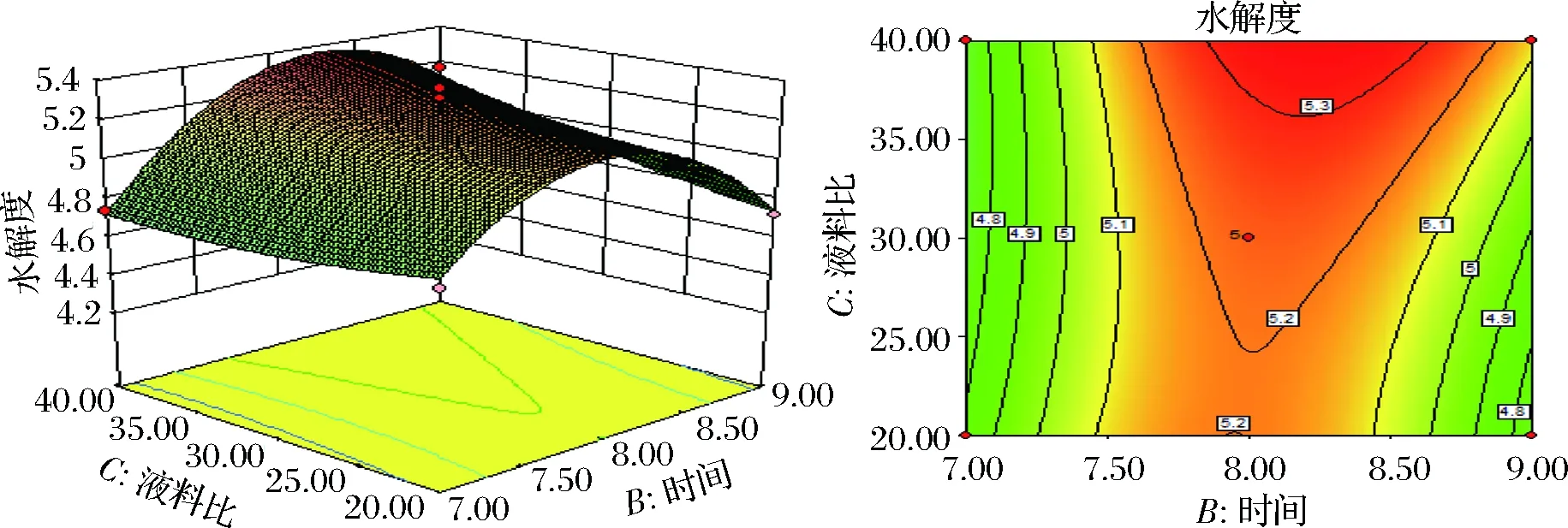
图4 加酶量为3.0%,液料比和酶解时间对鱼精蛋白水解度的影响
Fig.4 Effect of solvent-to-solid ratio and enzyme extraction time on the extraction rate of protamine, when pepsin amount is 3.0%
2.2.4 最佳工艺及验证
响应面软件经过拟合分析得到鲟鱼精蛋白肽的最佳提取工艺为:液料比为39.72∶1,木瓜蛋白酶添加量3%,酶解时间8.22 h,此时预测的鱼精蛋白水解度最大为5.36%。
经重复验证试验证明,在预测模型最佳提取工艺条件下,实际的鱼精蛋白水解度平均达到5.44%,与模型预测值极为接近,证明最佳工艺预测值准确。
2.2.5 抑菌性分析
最优工艺条件下,1%浓度的鱼精蛋白肽溶液浸泡滤纸处理的大肠杆菌和金黄色葡萄球菌培养基有明显的抑菌圈,蒸馏水浸泡的滤纸片周围菌落生长不受影响没有抑菌圈,鱼精蛋白肽抑制大肠杆菌和金黄色葡萄球菌效果显著,如图5、图6所示。
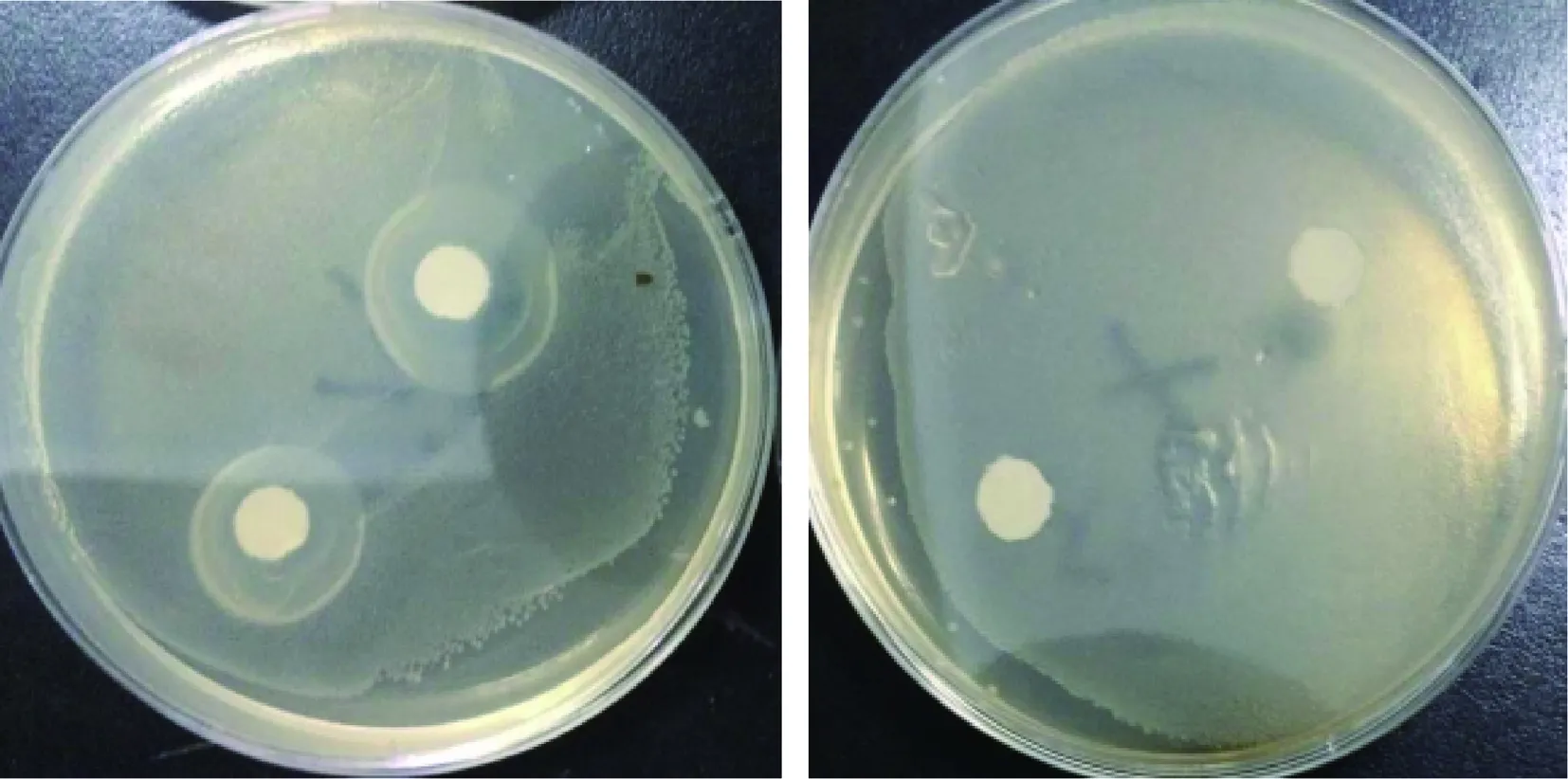
图5 鱼精蛋白肽与对照组对大肠杆菌的抑制作用
Fig.5 Inhibitory effect of protamine peptide and the contrast against Escherichia coli
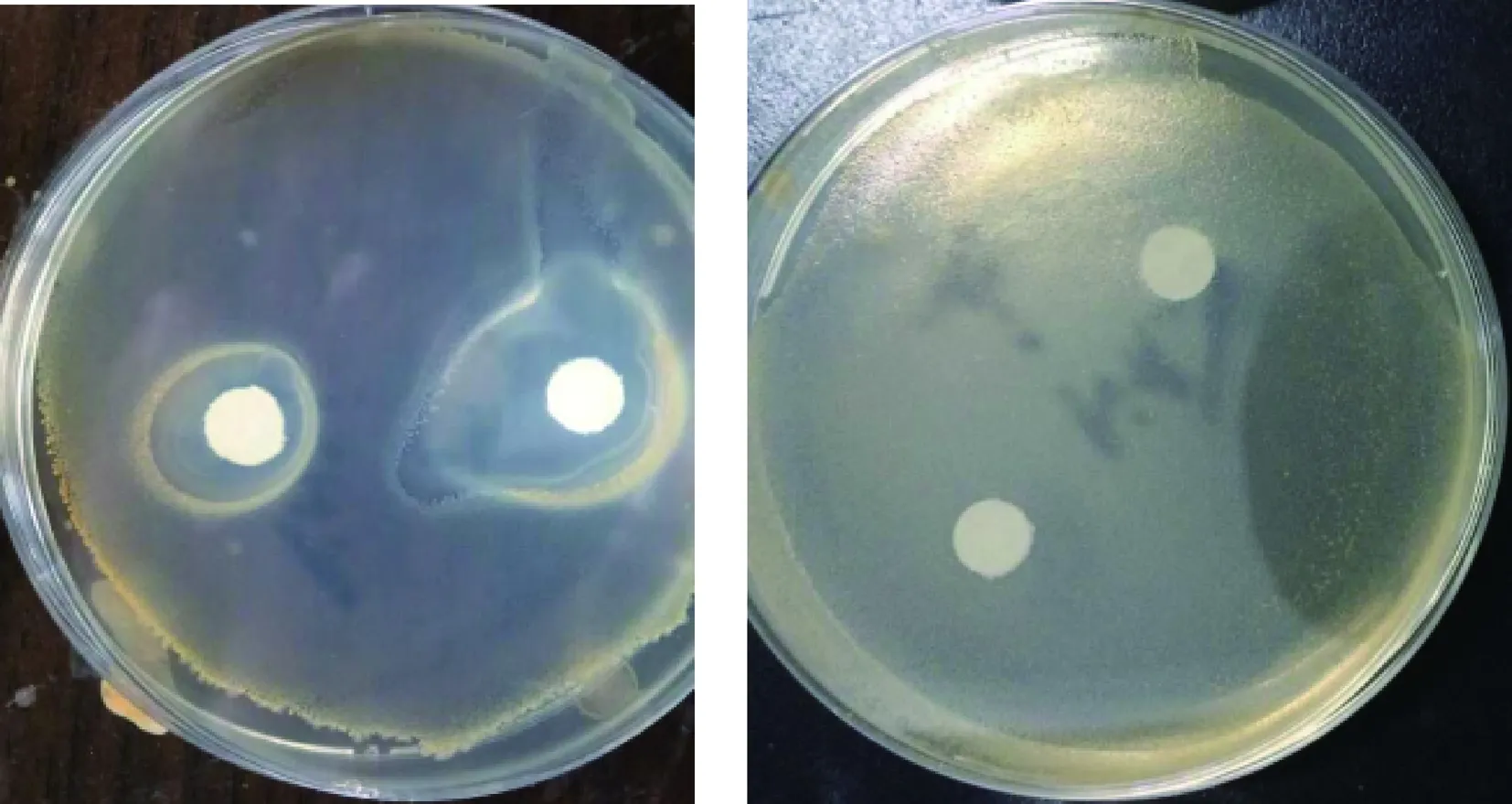
图6 鱼精蛋白肽与对照组对金黄色葡萄球菌的抑制作用
Fig.6 Inhibitory effect of protamine peptide and the contrast against Staphylococcus aureus
3 结论
本文首次对鲟鱼精蛋白功能活性肽进行提取,对比发现木瓜蛋白酶、胰蛋白酶和胃蛋白酶对鱼精蛋白酶解的影响存在明显差异,其中木瓜蛋白酶的酶解效率最高,在单因素条件实验基础上进一步利用Box-Behnken试验设计原理构建鲟鱼精蛋白肽酶解工艺的响应面模型,并通过回归分析优化得到最终的提取工艺为:液料比为39.72,木瓜蛋白酶添加量3%,酶解提取环境为pH 7.0,温度55 ℃,酶解反应时间8.22 h。并且验证实验表明最佳工艺条件下鱼精蛋白水解度最大达到5.44%。所制备的鲟鱼精蛋白肽对常见致病菌大肠杆菌和金黄色葡萄球菌具有明显的抑菌圈,抑菌活性良好,对鲟鱼精蛋白多肽的理化功能特性尚有待进一步研究,为多肽产品的开发提供理论依据。

