菊黄东方鲀鱼精蛋白提取工艺优化研究
刘淑集,陈梧英,许 旻,李 辉,苏永昌,张伯超,乔 琨,苏 捷,刘智禹
(1福建省水产研究所,国家海水鱼类加工技术研发分中心(厦门),福建省海洋生物增养殖与高值化利用重点实验室,福建省海洋生物资源开发利用协同创新中心,福建 厦门 361013;2闽南师范大学生物科学与技术学院,福建 漳州 363000)
河鲀(Tetraodontidae),俗称“河豚鱼”,属于脊索动物门、鲀形目、鲀科,是一种高蛋白、低脂肪的鱼类,具有很高的食用价值,野生河鲀有剧毒。雄性河鲀性成熟期的精巢(俗称鱼白)占整个雄鱼体质量的7 %[1]以上。除虫纹东方鲀(Takifuguvermicularis)精巢含有河豚毒素外,其他品种的精巢基本不含[2-3]。2016年,农业部等联合发布《关于有条件放开养殖红鳍东方鲀和养殖暗纹东方鲀加工经营的通知》[4];福建省也发布了关于加快推进养殖河鲀产业发展的实施意见,推进菊黄东方鲀(TakifuguFlavidus)和双斑东方鲀(Takifugubimaculatus)的人工养殖。据统计,福建省河鲀养殖面积约10万亩(6 666.67 hm2),产量9 200 t,占全国河鲀养殖总产量30%左右[5]。
鱼类精巢中含有丰富的营养成分,其中鱼精蛋白是利用价值较高的蛋白质。鱼精蛋白是一种富含精氨酸的天然多聚阳离子碱性蛋白质,通常与鱼精脱氧核糖核苷酸以1∶2的比例结合,形成精核蛋白存在于鱼类精巢组织中[6]。鱼精蛋白成分天然,安全性较高[7],具有良好的广谱抗菌特性[8-10]。此外,鱼精蛋白具有较高的营养和药理功能特性[11-12],在医学领域应用广泛。目前鱼精蛋白主要是从鳟鱼、鲱鱼、鲑鱼、鲤鱼、鱿鱼等[13-14]提取。常用的鱼精蛋白提取方法主要是利用NaCl溶液溶解硫酸或盐酸提取,再利用冷乙醇沉淀获得[15-18],而从河鲀提取鱼精蛋白的报道还未见。本研究以菊黄东方鲀精巢为原料,进行河鲀鱼精蛋白提取工艺研究,获得提取鱼精蛋白最佳工艺条件,为提取河鲀鱼精蛋白的相关研究提供工艺参考,也为河鲀加工产业提供技术支持。
1 材料与方法
1.1 材料与仪器
试验材料:菊黄东方鲀冻干精巢,购自福建省鲀之鲜水产有限公司,真空冷冻干燥;浓硫酸(分析纯)、NaCl(分析纯)、磷酸(分析纯)、考马斯亮蓝G-250(分析纯),均产自国药集团化学试剂有限公司;无水乙醇(分析纯),产自上海泰坦科技股份有限公司;河豚毒素ELISA检测试剂盒,购自江苏美正生物科技有限公司。
试验仪器:pH计(PB-10,赛多利斯科学仪器有限公司);高速冷冻离心机(centrifuge 5810R,德国 Eppendorf);电子分析天平(BS 124S,德国Sartorius);超低温冰箱(Forma -86 ℃,美国Thermo);酶标仪(M200 PRO,帝肯(上海)贸易有限公司);涡旋混合仪(XW-80A,海门市其林贝尔仪器制造有限公司);循环水式真空泵(SHZ-D,巩义市予华仪器有限公司);数显恒温水浴锅(HH-6,常州国华电器有限公司);数显磁力搅拌器(C-MAG HS7,艾卡中国仪器设备有限公司);数控超声波清洗器(KQ-500DE,昆山市超声仪器有限公司);真空冷冻干燥机(宁波新艺生物科技有限公司)。
1.2 试验方法
1.2.1 河鲀精巢成分及安全性测定
水分参照GB/T 5009.236—2016 中的直接干燥法测定[19];粗蛋白质参照GB 5009.5—2016 中的凯氏定氮法测定[20];粗脂肪参照GB/T 5009.6—2016 中的索氏抽提法测定[21];灰分测定参照GB/T 5009.4—2016 中的灼烧称重法测定[22]。河豚毒素( TTX ) 按照河豚毒素ELISA检测试剂盒说明书进行检测,评价标准[23]为:TTX ≥ 1 000 MU/g为剧毒,记为A级;100~999 MU/g为强毒,记为B级;10~99MU/g为弱毒,记为C级;<10 MU/g为无毒,记为D级,1MU=0.18 μg/g TTX。
1.2.2 鱼精蛋白提取工艺
鱼精蛋白提取工艺参照胡晓璐等[24]、饶丹华等[25]的方法并稍作修改。称取10.00 g的河鲀精巢干制品,加入100 mL不同pH、浓度为 0.14 mol/L的NaCl溶液,搅碎匀浆2 min,置于25 ℃下,10 000 r/min离心20 min,弃上清液。在沉淀物中按照比例加入硫酸溶液,在设定的温度条件下提取一定时间,6 000 r/min离心15 min,取上清液。加入不定量体积无水乙醇进行沉淀,静置过夜,8 000 r/min离心15 min,取沉淀液置于培养皿内,吹风晾干,在-20 ℃冰箱中冻藏一夜,真空冷冻干燥,所得干制品即为鱼精蛋白粗提物。此试验设置重复试验3次,结果取平均值。
1.2.3 试验指标的测定
鱼精蛋白提取率计算:真空冷冻干燥后取出样品,称取其重量,采用鱼精蛋白提取率Y表示:
Y=100%×(E/M)
(1)
式中:Y—鱼精蛋白提取率;E—冻干后鱼精蛋白粗提物,g;M—冻干河豚精巢,g。
1.2.4 鱼精蛋白提取条件单因素试验
以鱼精蛋白提取率为指标,在固定其他影响因素保持不变的状态下,分别考察硫酸浓度(0.2、0.4、0.6、0.8、1.0 mol/L)、pH(6.0、7.0、8.0、9.0、10.0)、硫酸用量(离心所得沉淀体积的1、2、3、4、5倍)、提取时间(1、2、3、4、5 h)、提取温度(4 ℃、25 ℃、45 ℃、65 ℃、85 ℃)、乙醇用量(分别设定为离心所得上清液体积的1、2、3、4、5倍)对鱼精蛋白提取效果的影响,每个水平试验重复3次。
1.2.5 响应面优化鱼精蛋白提取工艺条件
在单因素试验基础上,选取NaCl溶液pH(A)、硫酸用量(B)与提取时间(C)3个因素作为自变量,以鱼精蛋白提取率(Y)作为响应值,在pH(7、8、9)、硫酸用量(3、4、5倍)和提取时间(1.5、2、2.5 h)3因素3水平上对鱼精蛋白提取条件进行响应面优化,并进行验证。
1.2.6 数据分析处理

2 结果与分析
2.1 河鲀精巢成分测定结果
从菊黄东方鲀精巢成分的分析结果可以看出,冻干精巢的成分含量从高到低排列依次为蛋白质(78.0%)、灰分(10.4%)、粗脂肪(5.8%)、水分(5.0%)、碳水化合物(0.8%),蛋白质占比最大,可见该河鲀精巢中含有丰富的蛋白质,而鱼精蛋白是其中的主要蛋白,且具有良好的功能特性。同时对菊黄东方鲀精巢的河豚毒素进行测定,测定结果低于限值,属于D级(无毒),说明精巢是安全无毒的,与Itoi等[26]的研究结果一致。
2.2 各单因素对河鲀鱼精蛋白提取率的影响
2.2.1 NaCl溶液pH的影响
NaCl溶液的pH对鱼精蛋白的提取影响显著。鱼精蛋白为偏碱性蛋白质,保持中性至偏碱性,有利于鱼精蛋白的提取[27-28]。图1为各因素对鱼精蛋白提取率的影响结果。由图1a可知,随着溶液碱性的提高,鱼精蛋白提取率逐渐升高,当到达pH10时,提取率显著下降。因此,选取pH 8作为最佳提取点。
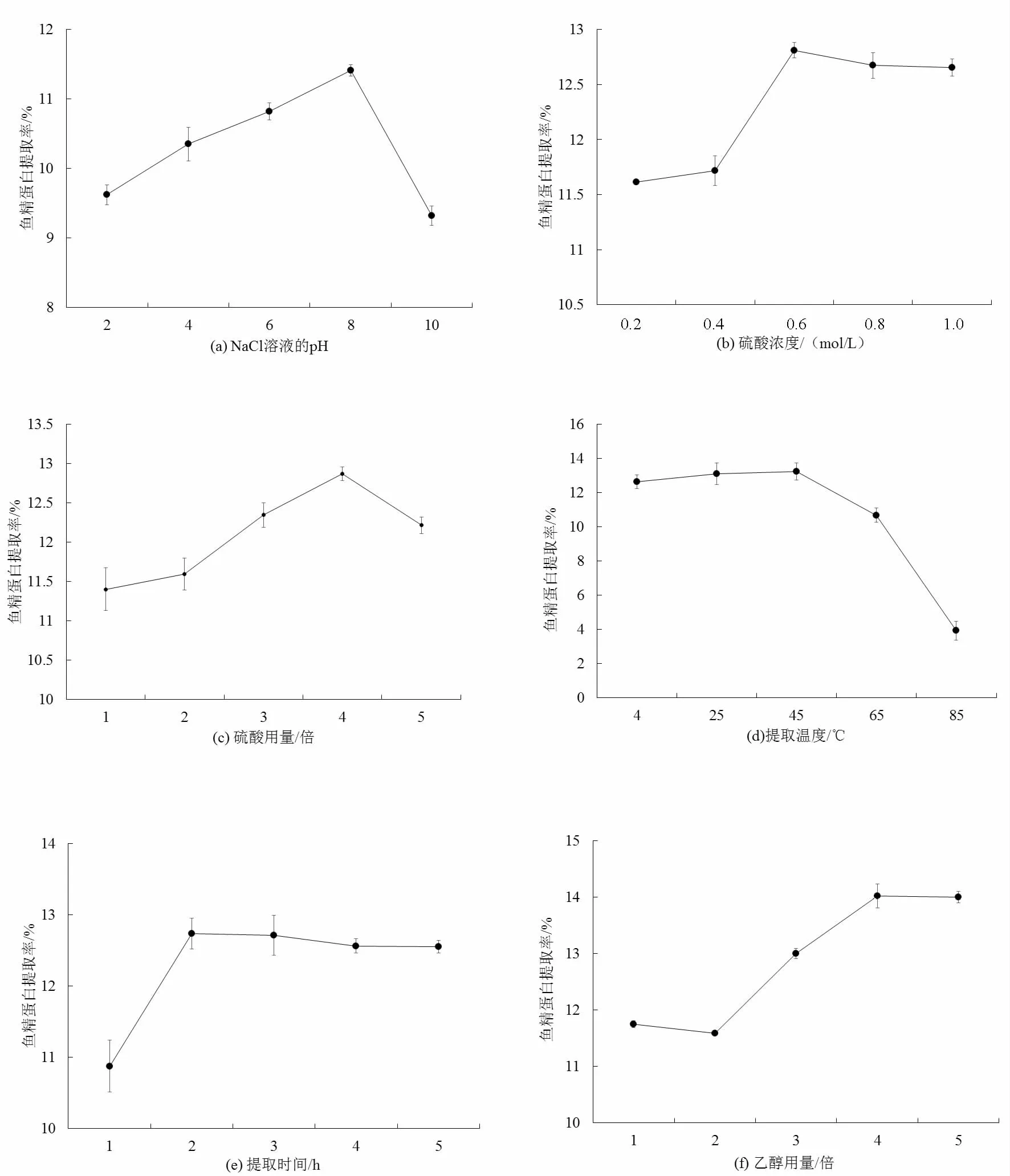
图1 各单因素对鱼精蛋白提取率的影响Fig.1 Effects of every single factor on the extraction rate of protamine
2.2.2 硫酸浓度的影响
鱼精蛋白的提取率在低浓度范围内受硫酸浓度的影响显著。从图1b可知,硫酸浓度在0.2~0.6 mol/L中变化时,鱼精蛋白的含量明显增加,浓度到达0.6 mol/L时,鱼精蛋白的提取率达到最大值,之后随着硫酸浓度的继续增加,鱼精蛋白的提取率反而呈下降趋势,当浓度增至0.8~1.0 mol/L之间时,提取率呈稳定趋势,说明鱼精蛋白的提取已接近饱和状态,再高浓度的硫酸可能会破坏蛋白质结构,降低提取率。因此,选取硫酸浓度为0.6 mol/L作为提取最佳浓度。
2.2.3 硫酸用量的影响
硫酸用量对鱼精蛋白的提取影响显著。如图1c所示,鱼精蛋白的提取率随着硫酸用量的增加呈先升后降的趋势,在1~2倍沉淀体积下鱼精蛋白溶解度较小,在2~4倍沉淀体积时提取率明显提高,随着硫酸用量的增加,鱼精蛋白与提取液的相互结合能力明显增强,但用量继续增加到5倍时,操作过程的繁琐程度增加,且转移溶液以及离心过程中的误差增大,提取率反而降低。考虑到成本以及提取率含量值,选择硫酸用量在4.0倍沉淀体积时为最佳。
2.2.4 提取温度的影响
提取温度对鱼精蛋白的影响如图1d所示。在较低温度范围内,鱼精蛋白提取率的变化趋势较为平缓,而在较高温度范围内提取率急剧降低。当温度到达45 ℃时提取率达到峰值,效果显著。适当提高温度对于提高鱼精蛋白提取率有积极作用。这可能是因为,适当提高温度能增大分子之间的相互作用,提高分子运动的速度,从而增大蛋白质分子的溶解性[25],但温度进一步升高会破坏蛋白质的原有结构,所提取得到的鱼精蛋白呈黄色甚至偏褐色状态,且后续表现出的水溶性较差。因此,选取45 ℃作为最佳提取温度较为合适。
2.2.5 提取时间的影响
由图1e可知,提取时间在1~2 h内,鱼精蛋白的提取速度增长明显,在2 h时达到最大值,随着时间的延长,提取率逐渐降低。这可能是由于提取过程中,鱼精蛋白与提取液的相互作用减弱,达到相对平衡后难以继续升高,且随着时间的延长,提取液与被提取物中的其他物质发生结合,易导致杂质增多。因此,以2 h为最佳提取时间。
2.2.6 乙醇用量的影响
乙醇用量对鱼精蛋白提取率的影响如图1f。随着乙醇用量的增加,鱼精蛋白提取率先明显上升,后逐渐趋于平缓。鱼精蛋白的提取率起先变幅较小,随着使用倍数增加提取率迅速上升,当达到4.0倍沉淀体积用量时,鱼精蛋白的溶解呈现饱和状态,而后逐渐平缓,说明鱼精蛋白的提取接近稳定。因此,选取4.0倍沉淀体积乙醇用量作为最佳沉淀剂用量。
2.3 响应面试验优化结果
对各单因素试验数据进行组间显著性分析发现,硫酸用量、提取时间、pH及乙醇用量4个因素在设定的水平之间均有显著性差异(P=0.000、0.000、0.016、0.016)。由于乙醇是后续用来沉淀蛋白的,用量比较大,后续还要离心,操作繁琐,因此选择以NaCl溶液pH(A)、硫酸用量(B)、提取时间(C)作为自变量,以鱼精蛋白提取率(Y)作为因变量,应用Design-Expert软件,进行3因素3水平的鱼精蛋白提取条件优化,试验结果见表1。
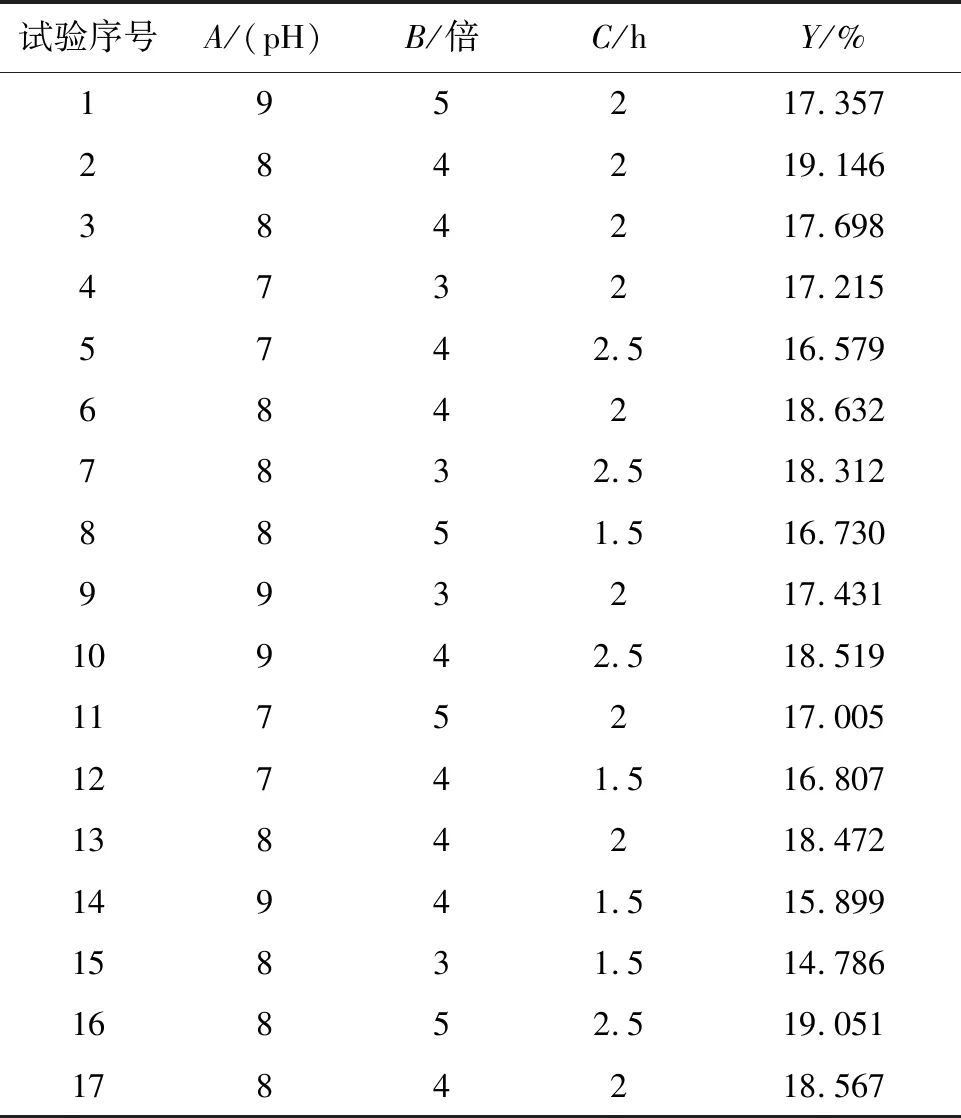
表1 响应面试验设计方案与结果Tab.1 Design scheme and result of response surface methodology
以鱼精蛋白提取率(Y)关于NaCl溶液pH(A)、硫酸用量(B)、提取时间(C)所建立的二次回归响应面模型,如以下方程所示:
Y=-38.528+9.374A+5.162B+5.752C+0.034AB+1.424AC-0.603BC-0.759A2-0.491B2-3.168C2
2.3.1 方差分析
二次模型的方差分析结果(表2)显示,模型P=0.042 5<0.05,说明鱼精蛋白提取率的回归方程模型显著;失拟项P=0.143 8>0.05,失拟不显著,回归方程较为可靠,回归模型具有统计学意义,可准确模拟各个因素对河鲀鱼精蛋白提取率的影响,且预测值能较好地与实际操作计算出的鱼精蛋白提取率相吻合。

表2 回归模型的方差分析结果Tab.2 Variance analysis of the regression model
2.3.2 响应面分析
各因素对鱼精蛋白提取率影响的交互作用响应面及等高线图如图2所示。NaCl溶液的pH与提取时间对鱼精蛋白提取率影响的交互作用效果如图2a、2b所示,随着提取时间的逐渐延长和NaCl溶液pH的增加,鱼精蛋白的提取率先升高后下降,交互曲面整体呈现凸起,呈倒U型变化,且等高线图呈椭圆形,说明NaCl溶液的pH与提取时间二者有一定交互作用。图2c、2d中,随着NaCl溶液pH的增大,鱼精蛋白的提取率先升高后降低,随着硫酸用量的加大,也呈现先升高后微降低并趋于稳定的态势,二者交互后整体曲面的变化趋势相对图2a的曲面比较平缓,但其等高线图仍呈椭圆形,说明NaCl溶液pH和硫酸用量存在交互作用。而在图2e、2f中,鱼精蛋白提取率随着提取时间的增加逐渐提高,随着硫酸用量的加大也缓慢增加,从相互作用的等高线图看,二者之间的交互作用不明显。
通过Design-Expert8.0分析软件,得到河鲀精巢鱼精蛋白的最佳提取条件是:NaCl溶液pH 8.55,硫酸浓度0.6 mol/L,硫酸用量为离心所得4.05倍沉淀体积,提取率预测值19.02%。为了便于实际操作,将模型优化出的最优提取条件简化为:NaCl溶液pH 8.5,硫酸用量为离心所得4.0倍沉淀体积,提取时间2.4 h,硫酸浓度0.6 mol/L,提取温度45 ℃,乙醇用量为上清液的4.0倍沉淀体积。在此条件下进行3次重复试验,计算得到鱼精蛋白的提取率为19.07%,与预测值相比没有显著性差异,说明此响应面法得到的回归模型具有一定的可靠性。
3 结论
检测了菊黄东方鲀精巢的河豚毒素含量,证实其属于无毒级别。在单因素试验的基础上,将响应面应用于优化河鲀精巢鱼精蛋白的提取,结果表明,响应面优化河鲀精巢鱼精蛋白提取方法合理可行,得到最佳的提取工艺条件为:NaCl溶液pH 8.5,硫酸用量4.0倍沉淀体积,提取时间2.4 h,硫酸浓度0.6 mol/L,提取温度45 ℃,乙醇用量为4.0倍沉淀体积,鱼精蛋白实际提取率为19.07%。

图2 各因素交互作用的响应面图和等高线 Fig.2 Response surface diagrams and contour of interaction between every factor
从河鲀精巢提取鱼精蛋白,对于研究鱼精蛋白的理化特性以及相关功能特性提供了试验基础,能够起到有效利用河鲀精巢组织的作用。未来关于鱼精蛋白的研究需要进一步深入,继续改进、创新以提高鱼精蛋白的提取率,增加鱼精蛋白提取纯度,最终能适应实际生产需要。
□

