神经干细胞提取与培养方法的比较研究
吴 增,李 媛,靳晓飞,周晓红,高维娟
(1.承德医学院病理生理学教研室,河北 承德 067000;2.河北中医学院河北省心脑血管病中医药防治重点实验室,河北 石家庄 050200)
神经干细胞(neural stem cells,NSCs)是指一类具有向多个细胞系分化(神经元、少突胶质细胞、星形胶质细胞),同时又能自我更新的细胞。在神经组织损伤后,处于静止状态的NSCs可被激活、增殖,并可迁移至损伤区,取代受损的细胞,并重建神经环路来修复受损的神经组织。但内源性NSCs数量不多,而且能迁移到损伤区的内源性NSCs的数量有限[1],所以积极开展外源性NSCs移植治疗神经系统损伤和退行性疾病成为近年来研究的热点[2]。目前,外源性NSCs提取和体外培养方法均有多种,得到活力和稳定性均较高的NSCs种子细胞效果不一。因此,比较、筛选、建立一套完善、实用、可靠的NSCs提取、体外培养方法,为获得外源性NSCs提供良好的技术支持,是本研究的目的所在。
1 材料
1.1实验动物清洁级健康SD孕鼠、乳鼠。由北京维通利华实验动物技术有限公司提供,许可证号为SCXK(京)2016-0011。
1.2试剂DMEM/F12(1 ∶1)、B-27、Accutase酶均购于Gibco公司;碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、表皮生长因子(epidermal growth factor,EGF)购于PeproTech公司;胎牛血清购于浙江天杭生物科技有限公司;巢蛋白(Nestin)抗体、Cy3标记的山羊抗兔IgG,购于北京博奥森生物技术有限公司;T1350型胰蛋白酶、多聚赖氨酸,购于北京索莱宝科技有限公司;CCK-8试剂盒,购于北京庄盟国际生物基因科技有限公司。
1.3仪器3111型二氧化碳培养箱、Varioskan LUX多功能微孔板读数仪,购于Thermo;DM5000B型荧光显微镜,购于Leica;IX73型生物显微镜,购于OLYMPUS;80-2型离心机,购于江苏金坛市金城国胜实验仪器厂。
2 方法
2.1NSCs的提取NSCs的来源分为2组:胎龄14 d胎鼠和新生24 h内乳鼠,提取步骤:取孕14 d SD大鼠1只,腹腔注射10%的水合氯醛(3.5 mL·kg-1),将其浸泡于75%乙醇中30 min(仅露出头部),然后用无菌器械取出子宫,置于75%乙醇中浸泡2 min。在超净台内解剖子宫,将胎盘包裹的胎鼠置于预冷的D-Hank’s液中。逐个取出胎鼠的大脑皮质,置于含有D-Hank’s液的培养皿中,迅速用无菌镊子仔细剥离脑膜,将剥离干净的脑组织转移至含有DMEM/F12(1 ∶1)培养基的平皿中,眼科剪剪碎,用无菌吸管转移到15 mL离心管内,轻柔吹打至肉眼无可见组织块为宜,以1000 r·min-1离心5 min,弃上清,加入NSCs无血清培养基,轻柔吹打成细胞悬液,先后过200目和500目细胞筛[3-5]。细胞计数后,调整浓度为1.0×109·L-1,接种于25 cm2培养瓶内,置37℃、5% CO2培养箱中。新生24 h内乳鼠大脑皮质NSCs提取同胎鼠NSCs提取法。原代培养4 d,观察两组神经球生成情况。
2.2NSCs的的培养
2.2.1培养基 培养基分为2组:A组:DMEM/F12[6](97%)+B27[7](2%)+bFGF(20 μg·L-1)+EGF[8](20 μg·L-1)+青链霉素(1%)配制成的NSCs无血清培养基;B组:DMEM/F12(90%)+胎牛血清(10%)配制成的NSCs含血清培养基。提取胎龄14 d胎鼠大脑皮质的NSCs,调整细胞密度为1.0×109·L-1,接种于25 cm2培养瓶内,悬浮培养法原代培养4 d,观察两组神经球生成情况。
2.2.2接种 按细胞接种密度不同,分为3组:1.0×108·L-1组[9]、1.0×109·L-1组[4]和1.0×1010·L-1组。提取胎龄14 d胎鼠大脑皮质的NSCs后,接种于25 cm2培养瓶内,采用无血清培养基,采取悬浮培养法,原代培养2、5 d,观察各组形成神经球数量和状态。
2.2.3培养方法 按NSCs培养方法,分为悬浮培养法和贴壁培养法2组。悬浮培养法:将提取的NSCs接种于培养瓶后,不做特殊处理;贴壁培养法:用浓度为0.01%的多聚赖氨酸包被25 cm2的培养瓶,并将培养瓶置于无菌环境中,室温下过夜干燥待用。提取胎龄14 d胎鼠大脑皮质的NSCs,采用无血清培养基,以1.0×109·L-1的密度接种,原代培养3 d,观察两组神经球的形成情况。
2.2.4换液方法 提取胎龄14 d胎鼠大脑皮质的NSCs,采用无血清培养基,以1.0×109·L-1的密度接种于25 cm2培养瓶,采用悬浮培养法进行培养,按照换液方法的不同分为3组:每2~3 d全量换液组、每2~3 d半量换液组[4]、每2~3 d不弃液只加液1~1.5 mL组,原代培养7 d,观察各组所形成的神经球活力的差异。
2.2.5传代方法 按NSCs传代方法不同,分为3组:胰酶消化组[10-11]、Accutase酶消化组[12]和机械吹打组[13-14]。酶消化法操作步骤:无菌吸管将含有神经球的培养基转移至15 mL离心管,静置15 min,去除上清液,加入1 mL 0.125%的胰酶或1 mL Accutase酶,并轻柔缓慢吹打10 min,加入4 mL无血清培养基终止消化,以1 500 r·min-1离心10 min,去除上清液,加入无血清培养基,调整细胞密度为1.0×109·L-1,接种于25 cm2培养瓶内。机械吹打法操作步骤:无菌吸管将含有神经球的培养基转移至15 mL离心管,静置15 min,去除上清液,加入2 mL 无血清培养基,轻柔缓慢吹打10 min,调整细胞密度为1.0×109·L-1,接种于25 cm2培养瓶内。比较采用以上3种不同传代方法传代后的NSCs状态。
2.3NSCs的鉴定将Nestin作为NSCs鉴定的依据,对培养至3、5、7代的神经球行Nestin免疫荧光染色。鉴定步骤:吸取适量含有神经球的培养基,接种于有多聚赖氨酸包被盖玻片的12孔板内,培养4 h后,显微镜下观察神经球已经贴壁生长,PBS洗3次,每次5 min,室温下4%多聚甲醛固定15 min,PBS洗3次,每次5 min,加0.3% Trition-100室温下孵育20 min,PBS洗3次,每次5 min,用山羊血清封闭液室温下封闭30 min,吸除封闭液,滴加一抗(PBS稀释的效价为1 ∶100兔抗鼠Nestin抗体)4°C孵育过夜,PBS洗3次,每次5 min,滴加二抗(Cy3标记的山羊抗兔 IgG)室温避光孵育2 h,PBS洗3次,每次5 min,滴加DAPI染液,避光室温孵育10 min,PBS洗3次,每次5 min,用抗荧光衰减封片剂封片,于荧光显微镜下观察并采集图像。
2.4NSCs活性的检测按鼠龄的不同和传代方法的不同,分为4组:24 h乳鼠胰酶消化组、24 h乳鼠Accutase酶消化组、14 d胎鼠胰酶消化组、14 d胎鼠Accutase酶消化组。按本文方法,分别提取新生24 h内乳鼠和胎龄14 d胎鼠大脑皮质的NSCs,采用无血清培养基,以1.0×109·L-1的密度接种于25 cm2培养瓶,采取悬浮培养法,每2~3 d加液1~1.5 mL,每6~7 d传代1次,在37℃、5% CO2培养箱中培养至第2代d 7,用无菌吸管将含有神经球的培养基转移至15 mL离心管,静置15 min,去除上清液,分别加入0.125%胰酶1 mL或Accutase酶1 mL,并轻柔缓慢吹打10 min左右,加入4 mL无血清培养基终止消化,以1 500 r·min-1离心10 min,去除上清液,加入无血清培养基,调整细胞密度为5.0×108·L-1,分别接种于96孔板内,每组6个复孔,每孔加入100 μL细胞悬液,再向细胞悬液中加入10 μL CCK-8溶液,轻轻敲击培养板以帮助混匀,置37℃、5% CO2培养箱中培养5 h后,用酶标仪测定450 nm处的吸光度。吸光度越高,代表NSCs活性越好。
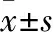
3 结果
3.1不同鼠龄大脑皮层提取的NSCs比较胎龄14 d胎鼠和新生24 h内乳鼠大脑皮质均可提取到大量的NSCs。原代培养4 d,观察两组均形成了悬浮的状态良好的神经球,但胎鼠大脑皮质内的杂细胞较乳鼠少(Fig 1)。
3.2不同培养基对神经球的影响采用无血清培养基组,原代培养4 d,观察形成了状态良好的神经球;采用含血清培基组,原代培养4 d,观察NSCs大部分贴壁分化(Fig 2)。
3.3不同接种密度对神经球的影响接种密度为1.0×108·L-1的NSCs,培养2 d形成极少量神经球,培养5 d神经球数量增多,但在3组中神经球数量最少,神经球状态良好;接种密度为1.0×109·L-1的NSCs,培养2 d形成少量神经球,培养5 d神经球数量明显增多,且状态良好;密度为1.0×1010·L-1的NSCs,培养2 d形成大量神经球,培养5 d神经球解体,且有大量细胞死亡的现象,在3组中神经球数量最多(Fig 3)。
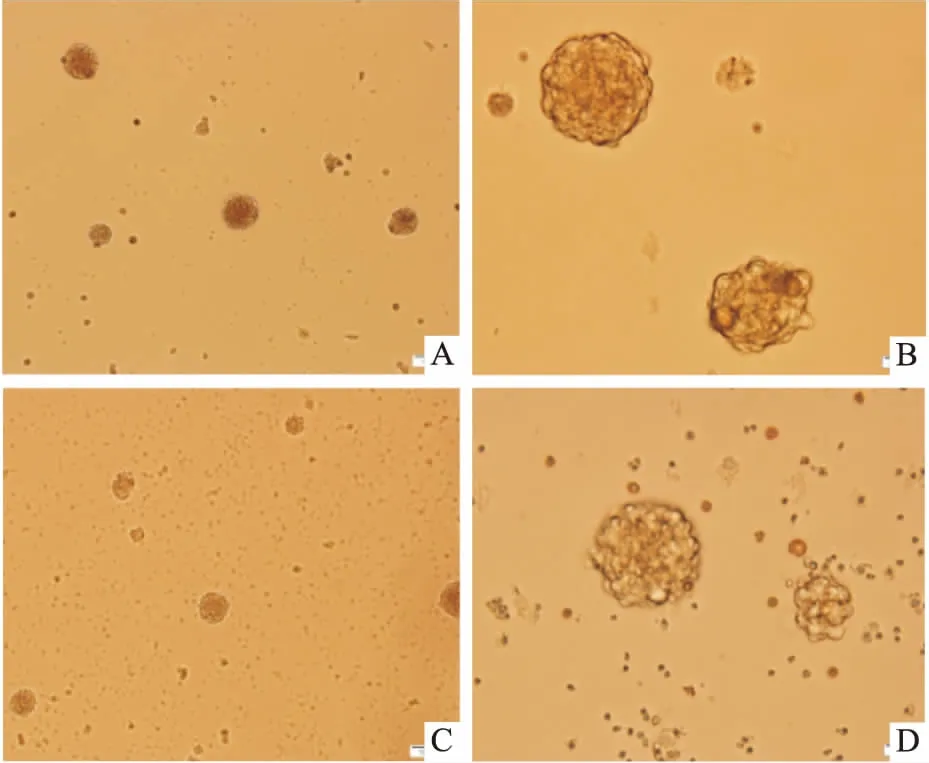
Fig 1 Comparison of formation of 4 d neurospheres between fetal rats and neonatal rats
A: The neurospheres formed by 4 d in fetal rats (×100); B: The neurospheres formed by 4 d in fetal rats (×400); C: The neurospheres formed by 4 d in neonatal rats (×100); D: The neurospheres formed by 4 d in neonatal rats (×400).

Fig 2 Comparison of formation of 4 d neurospheres by using different types of culture medium(×100)
A: Primary culture of serum-free medium for 4 d; B: Primary culture of containing serum medium for 4 d.
3.4不同培养方法对神经球的影响悬浮培养法培养3 d,原代NSCs可形成稳定的神经球,且未出现分化;贴壁培养法的原代NSCs增殖缓慢,培养3 d可见大量细胞分化(Fig 4)。
3.5不同换液方法对神经球的影响原代培养7 d观察,全量换液组形成的神经球透光性差,神经球边缘有少量死细胞,神经球活力低;半量换液组和只加液不弃液组形成的神经球透光均匀,神经球活力均较高(Fig 5)。
3.6不同传代方法对神经球的影响原代和1代的神经球:采用机械吹打法即可将神经球分离成单细胞悬液,活细胞比例高,再次成球率高,并可以保持稳定的未分化状态,且较胰酶和Accutase酶消化法方便。2代及以后神经球:采用机械吹打法不能使其完全分离为单细胞;采用胰酶消化法传代后,活细胞比例相对较低,成球率较低;采用Accutase酶消化法,对细胞损伤小,活细胞比例较高,成球率较高,神经球状态良好(Fig 6)。
3.7NSCs的鉴定结果对培养至3、5、7代的神经球行Nestin免疫荧光染色,荧光显微镜下观察Cy3标记Nestin发红光,表明Nestin免疫荧光染色为阳性,确定培养的细胞为NSCs(Fig 7)。
Fig 3 Comparison of formation of 5 d neurospheres by different inoculation densities
A: Inoculation at 1×108·L-1density, primary culture for 5 d (×40); B: Inoculation at 1×108·L-1density, primary culture for 5 d (×400); C: Inoculation at 1×109·L-1density, primary culture for 5 d (×40); D: Inoculation at 1×109·L-1density, primary culture for 5 d (×400); E: Inoculation at 1×1010·L-1density, primary culture for 5 d (×40); F: Inoculation at 1×1010·L-1density, primary culture for 5 d (×400).
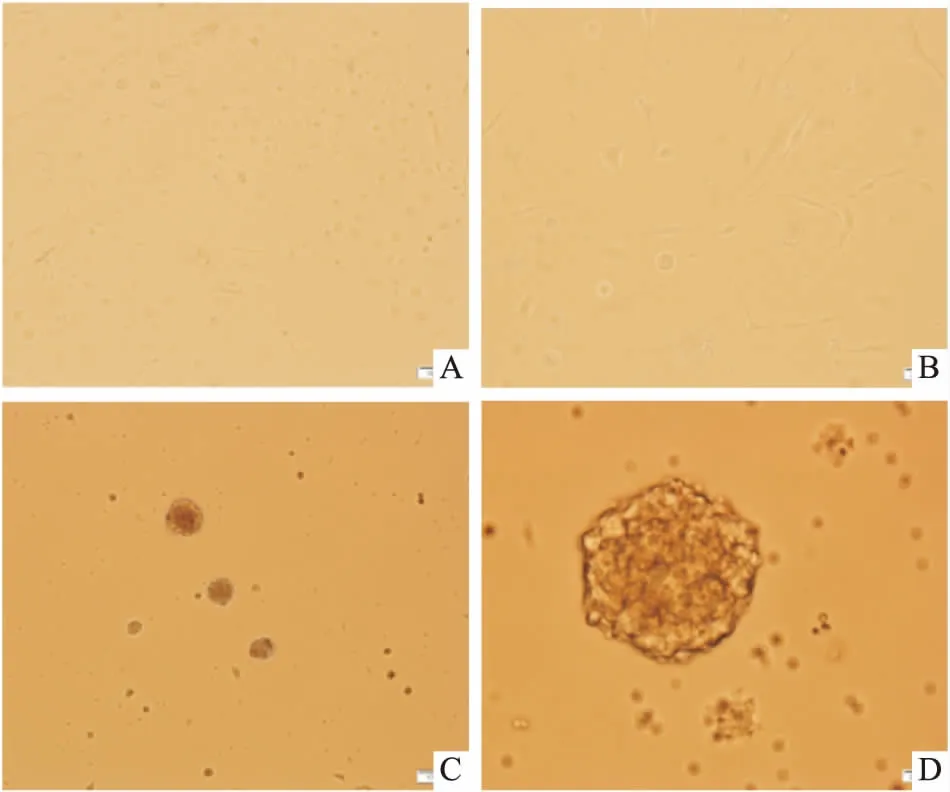
Fig 4 Comparison of formation of 3 d neurospheres by using adherent culture method and suspension culture method
A: Primary adherent culture for 3 d (×100); B: Primary adherent culture for 3 d (×400); C: Primary suspension culture for 3 d(×100); D: Primary suspension culture for 3 d (×400).
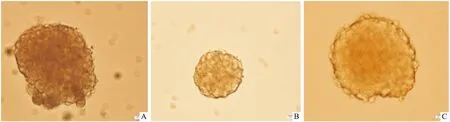
Fig 5 Comparison of state of primary culture of 7 d neurospheres by different methods of exchange of liquid(×400)
A: Primary culture for 7 d to observe the state of the formation of neurospheres per 2~3 d by all change of culture medium; B: Primary culture for 7 d to observe the state of the formation of neurospheres per 2~3 d by half of change of culture medium; C: Primary culture for 7 d to observe the state of the formation of neurospheres per 2~3 d by only addition of culture medium not discarding culture medium.
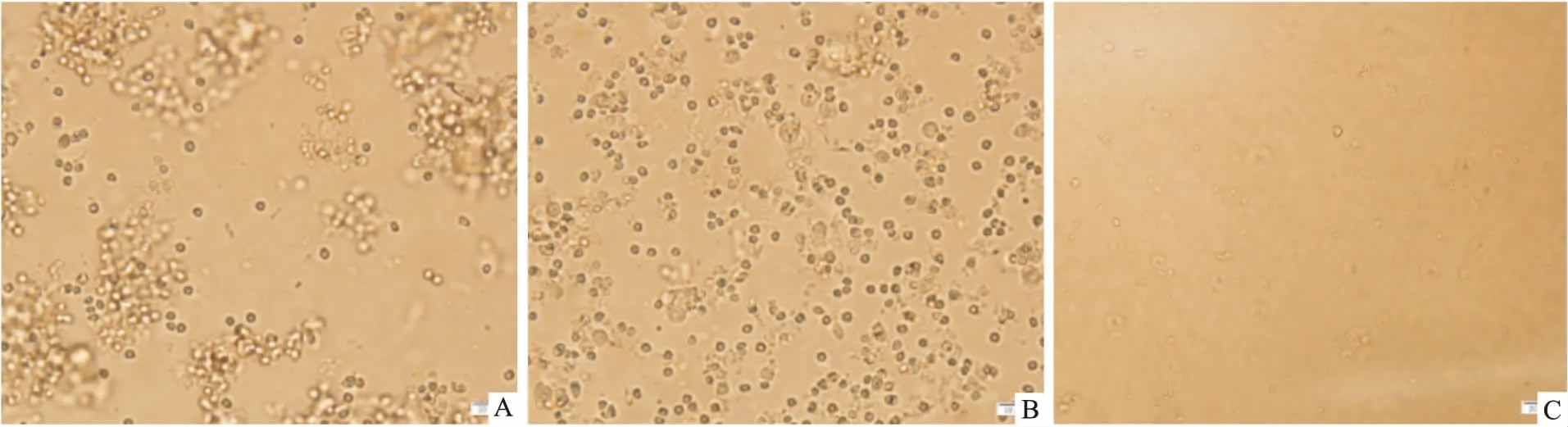
Fig 6 Pictures of different generation methods(×400)
A: The picture after the second generation of neurosphere passage by mechanical blow method; B: The picture after the second generation of neurosphere passage by Accutase digestion; C: The picture after the second generation of neurosphere passage by trypsin digestion.
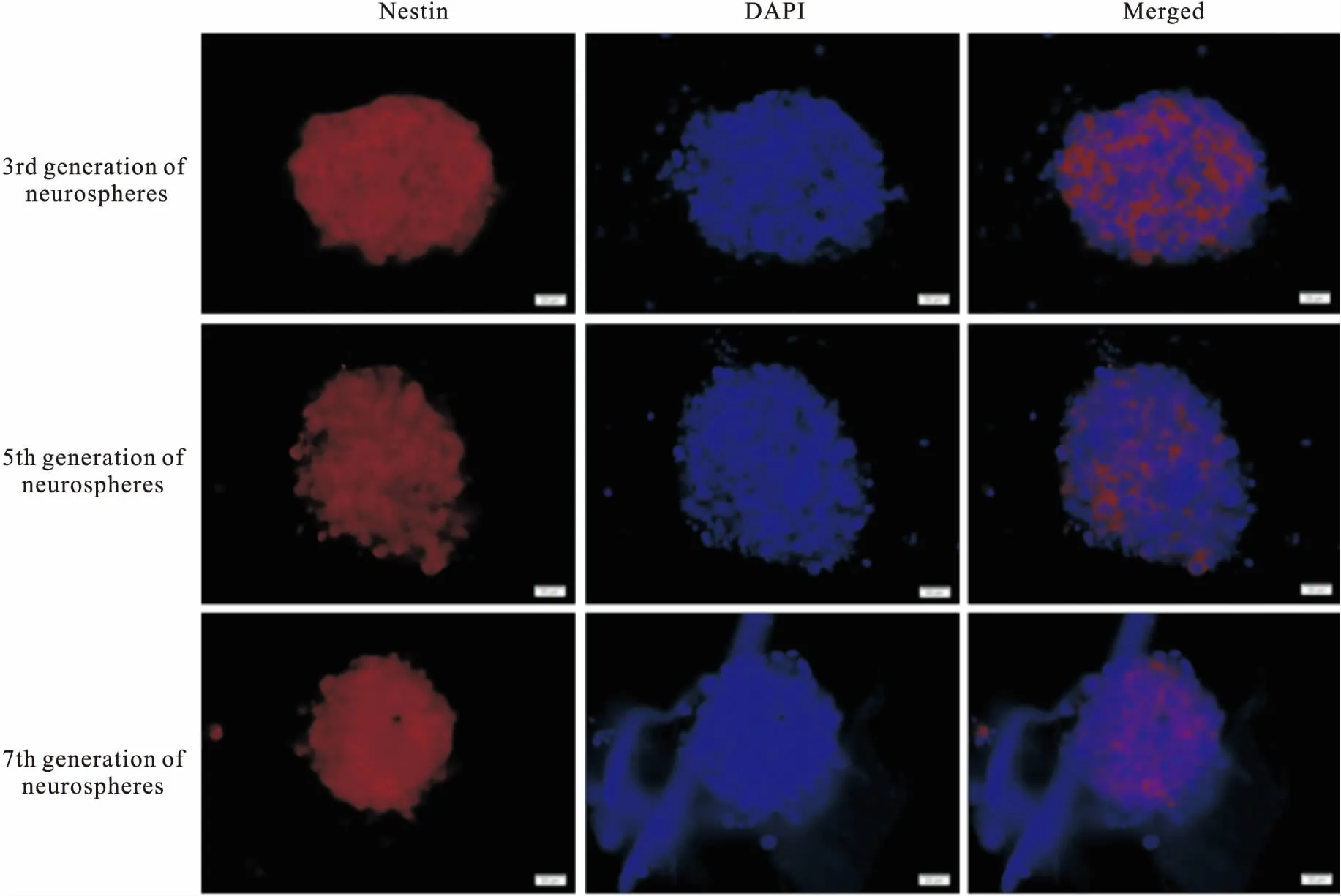
Fig 7 Immunofluorescent staining positive pictures of the 3rd, 5th, 7th generation of neurosphere nestin(×400)
3.8NSCs活性检测结果如Fig 8所示,24 h乳鼠胰酶消化组(0.343±0.056)、24 h乳鼠Accutase酶消化组(0.477±0.045)和14 d胎鼠胰酶消化组(0.468±0.107)的吸光度明显低于14 d胎鼠Accutase酶消化组(0.625±0.027),且差异具有显著性(P<0.05)。
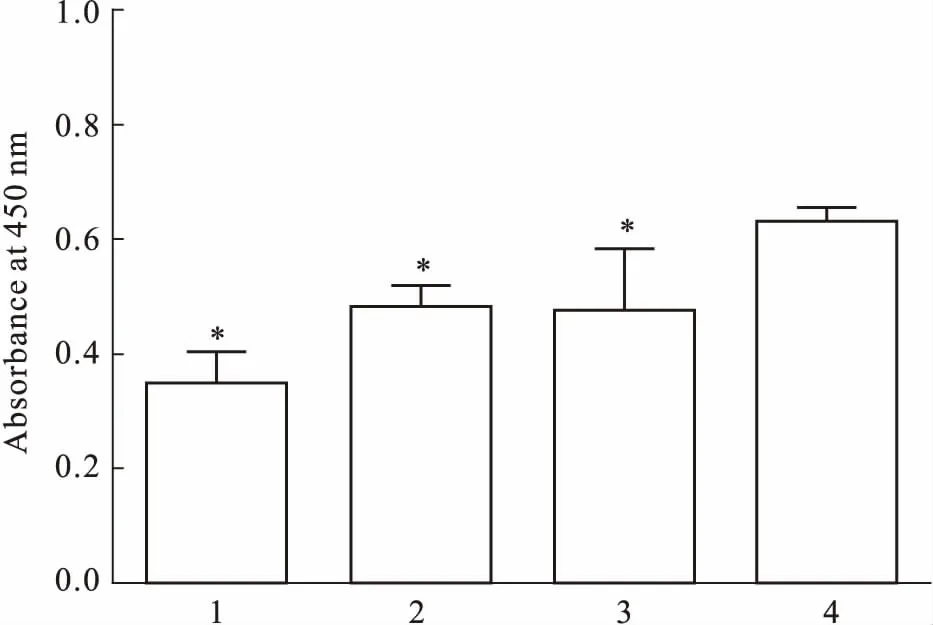
Fig 8 Activity of NSCs
1: 24 h neonatal rat trypsin digestion group; 2: 24 h neonatal rat Accutase digestion group; 3: 14 d fetal rat trypsin digestion group; 4:14 d fetal rat Accutase digestion group.*P<0.05vsgroup 4.
4 讨论
经大量实验反复摸索后,常规提取胎龄14 d胎鼠,采用无血清培养基,以1.0×109·L-1的密度接种于25 cm2培养瓶,采取悬浮培养法,每2~3 d加液1~1.5 mL,每6~7 d传代1次(神经球直径为150~250 μm),所得到的NSCs经Nestin免疫荧光染色呈阳性,且NSCs增殖分裂旺盛,成球率高,神经球状态良好,可以保持稳定的未分化状态。
NSCs所具有的迁移性、分化性、趋化性、低免疫原性等独特的生物学特性,使其成为备受瞩目的修复神经损伤的种子细胞,因此,也打破了成熟神经系统不可再生的传统观念。目前,NSCs移植已用于各类神经系统疾病治疗的研究,主要用于:① 缺氧缺血性脑损伤,将NSCs移植到缺血缺氧性脑损伤的大鼠脑内,可以提高缺血缺氧性大鼠学习能力和记忆能力[15];② 帕金森病,NSCs移植治疗帕金森病在基础和临床研究中已经取得了一定的进展。冷历歌等[16]临床研究发现,帕金森患者经NSCs移植治疗后,临床症状得到明显缓解,生活质量明显提高;③ 阿尔茨海默病,大量研究证实,NSCs移植可以明显改善阿尔茨海默病鼠的学习记忆能力。目前,关于NSCs治疗人类阿尔茨海默病的报道较少。此外,NSCs移植还在亨廷顿病、脑胶质瘤、外周神经损伤等疾病中发挥治疗作用。加速体外培养NSCs的增殖,控制其处于未分化状态是干细胞移植的首要前提,但是调控NSCs增殖、分化和迁移的机制尚未完全清楚,为了得到纯度更高、状态更好的NSCs,实现基础研究到临床应用的飞跃,我们不仅需要在培养方法上改进,更应该对NSCs的调控机制进行深层次的研究。
(致谢:本实验在河北省心脑血管病中医药防治重点实验室完成,感谢各位老师和同学的帮助!)
参考文献:
[1] Dai J,Li S Q, Qiu Y M, et al.Migration of neural stem cells to ischemic brain regions in ischemic stroke in rats[J].NeurosciLett,2013,552(1):124-8.
[2] 朱剑虹.神经干细胞和人脑再生医学[J].中华医学杂志,2005,85(3):2527-9.
[2] Zhu J H.Neural stem cells and human brain regenerative medicine[J].NatlMedJChina,2005,85(3):2527-9.
[3] 徐富翠,邹礼乐,梅欣明,等.神经干细胞培养及其影响因素[J].中国组织工程研究,2013,17(10):1835-40.
[3] Xu F C, Zou L L, Mei X M, et al.Culture of neural stem cells and the influencing factors[J].ChinJTissueEngRes, 2013,17(10):1835-40.
[4] 刘 畅,陈 晓,李 诚,等.神经干细胞移植对大鼠脊髓损伤后Caspase-3和c-fos表达的影响[J].上海交通大学学报(医学版),2015,35(3):343-7.
[4] Liu C, Chen X, Li C, et al.Effects of neural stem cell transplantation on expressions of Caspase-3 and c-fos after injury of rat spinal cord[J].JShanghaiJiaoTongUniv(MedSci),2015,35(3):343-7.
[5] 段奎甲,王向鹏,杨智勇,等.GDNF基因修饰神经干细胞移植治疗大鼠帕金森病[J].南方医科大学学报,2016,36(1):32-8.
[5] Duan K J, Wang X P, Yang Z Y, et al.Therapeutic effect of GDNF gene-modified mesencephalic neural stem cell transplantation in a rat model of Parkinson disease[J].JSouthMedUniv,2016,36(1):32-8.
[6] 蔡 明,陆耀飞,娄淑杰.大鼠大脑皮层神经干细胞培养方法比较[J].神经解剖学杂志,2013,29(1):70-4.
[6] Cai M, Lu Y F, Lou S J.Comparative study of different methods in the culture of rat cerebral cortex neural stem cells[J].ChinJNeuroanat,2013,29(1):70-4.
[7] Svendsen C N, Fawcett J W, Bentlage C.Increased survival of rat EGF generated CNS precursor cells or cells using B27 supplemented medium[J].ExpBrainRes,1995,102(3):407-14.
[8] Maric D, Maric I, Chang Y H, et al.Prospective cell sorting of embryonic rat neural stem cells and neuronal and glial progenitors reveals selective effects of basic fibroblast growth factor and epidermal growth factor on self-renewal and differentiation[J].JNeurosci,2003,23(1):240-51.
[9] 闫宇辉,李少恒,孔 亮,等.NT-3高表达促进神经干细胞向胆碱能神经元分化[J].中国药理学通报,2016,32(5):631-7.
[9] Yan Y H, Li S H, Kong L, et al.Neurotrophin 3 gene overexpression promotes cholinergic differentiation in neural stem cells[J].ChinPharmacolBull,2016,32(5):631-7.
[10] 武玉江,侯英诺,张子檀,等.早期运动训练联合神经干细胞移植对脊髓损伤模型大鼠后肢运动功能的影响[J].中国组织工程研究,2016,20(6):876-82.
[10] Wu Y J, Hou Y N, Zhang Z T, et al.Early exercise training combined with neural stem cell transplantation improves hindlimb motor function after spinal cord injury in rats[J].ChinJTissueEngRes,2016,20(6):876-82.
[11] 代丽丽,钟士江.新生小鼠神经干细胞体外培养、分化及鉴定[J].药物评价研究,2016,39(1):71-3.
[11] Dai L L, Zhong S J.Invitroculture, differentiation, and identification of neural stem cells in neonatal mice[J].DrugEvalRes,2016,39(1):71-3.
[12] Jager L D, Canda C M, Hall C A, et al.Effect of enzymatic and mechanical methods of dissociation on neural progenitor cells derived from induced pluripotent stem cells[J].AdvMedSci,2016,61(1):78-84.
[13] 刘晓薇,孙敬武.胎鼠神经干细胞的原代培养及体外诱导分化研究[J].听力学及言语疾病杂志, 2010,18(4):372-6.
[13] Liu X W, Sun J W.Primary culture of neurospheres obtained from fetal mouse central nervous system and differentiation of inner ear hair cell immunophenotypesinvitro[J].JAudiolSpeechPathol, 2010,18(4):372-6.
[14] 贾进明,陈菲菲,吴云飞,等.神经干细胞移植联合PEP-1-SOD1对颅脑损伤大鼠神经功能恢复的影响[J].南京医科大学学报(自然科学版),2015,35(11):1511-6.
[14] Jia J M, Chen F F, Wu Y F, et al.Effects of PEP-1-SOD1 combined with neural stem cells transplantation on the neurologic function of rats with traumatic brain injury[J].ActaUnivMedNanjing(NatSci),2015,35(11):1511-6.
[15] 刘相名,杨立业,惠国桢,等.神经干细胞移植治疗缺氧缺血性脑损伤的实验研究[J].中华神经外科杂志,2002,18(5):25-8.
[15] Liu X M, Yang L Y, Hui G Z, et al.Neural stem cells transplantation after hypoxic-ischemic brain injury[J].ChinJNeurosurg,2002,18(5):25-8.
[16] 冷历歌,田增民.神经干细胞移植治疗帕金森病21例[J].中国临床神经外科杂志,2014,19(7):412-3,417.
[16] Leng L G, Tian Z M.Treatment of Parkinson disease by implantation of neural stem cells into stratums (report of 21 cases)[J].ChinJClinNeurosurg,2014,19(7):412-3,417.