炎性环境与间充质干细胞自噬相互影响关系的研究进展
李程豪,刘永琦,2,骆亚莉,伍志伟
(甘肃中医药大学 1.甘肃省高校重大疾病分子医学与中医药防治研究省级重点实验室、2.敦煌医学与转化省部共建教育部重点实验室,甘肃 兰州 730000)
间充质干细胞(mesenchymal stem cells, MSCs)具有易于体外分离及扩增、免疫原性低、肿瘤趋向性及易于导入各种基因的优良特性[1],已成为多个领域细胞替代治疗和组织工程学首选的种子细胞[2]。多个研究证明,MSCs在受到炎症等应激因素的刺激下,可能出现细胞器及DNA的损伤,且增殖及分化能力出现异常改变[3]。这些损伤和改变将对MSCs的应用研究造成较大影响,并为其广泛推广于临床提出了挑战。细胞自噬是指细胞利用溶酶体降解自身细胞质和细胞器的过程,其被视为清除废物、重新合成的有效替代途径,对维持细胞内环境稳态十分重要[4]。自噬是一种广泛存在于真核细胞中的自我调节机制,一方面,炎症能够诱导细胞自噬的发生,并帮助细胞应对外界刺激、维持细胞内环境稳定[5],调节细胞生理过程[6];另一方面,被激活的自噬作用可以通过调节细胞的旁分泌功能,对细胞外炎性环境进行调节[7]。但目前对于炎性环境与自噬相互作用将如何影响炎性环境中的MSCs尚不清楚,本文将围绕炎性环境、自噬以及MSCs三者相互作用、相互影响的关系进行讨论。
1 炎性环境与MSCs
1.1MSCs在炎症疾病防治中的应用当局部炎症或损伤发生时,炎性细胞所释放出的大量黏附分子和趋化因子能够趋化MSCs循环到炎症部位[8]。Wang等[7]在损伤的脑组织周围发现大量被趋化的MSCs。依靠干细胞的趋化特性,MSCs常被作为靶向抗癌药物载体运用于肿瘤生物治疗研究中[9]。除此之外,鉴于MSCs自我更新及多向分化能力,研究人员通常将MSCs移植到机体损伤、炎症部位,研究其对炎症损伤组织的修复效果。被定植于肠道受损部位的MSCs通过促进损伤局部微循环重建等途径,对炎症性肠病肠道的炎症损伤组织进行修复[10]。移植于骨关节炎局部的MSCs能够有效地参与被炎症损伤的软骨、肌肉、骨骼再生[11]。因此,MSCs在损伤和炎症相关疾病的治疗中表现出良好的应用前景。
1.2炎性环境对MSCs应用的影响尽管MSCs在损伤和炎症相关疾病的治疗中具有极大的应用意义,但同时也面临着炎症对其本身的生物学功能影响提出的挑战。课题组前期研究发现,干细胞生存的微环境异常改变可诱发MSCs发生增殖异常、形态改变及遗传稳定性的变化[12]。近期研究发现,炎性环境可使骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)出现恶性转化或分化为肿瘤相关成纤维细胞(tumor-associated fibroblasts,TAFs)等异常分化情况[13]。因此,深入了解炎性环境对MSCs生物学特性的影响,规避不良的风险因素,将有利于MSCs更安全有效地应用于组织工程及再生医学领域。
2 炎性环境对MSCs自噬的影响
不管在生理状态还是病理状态下,细胞均有自噬的发生。众多研究报道显示,多种胁迫环境能够诱导细胞自噬发生,而在炎性环境中,炎性因子是引起MSCs自噬变化的重要因素之一。炎症会造成损伤细胞器及活性氧(reactive oxygen species,ROS)的产生和堆积,并成为激活细胞自噬活性的重要条件[14]。实验性自身免疫性脑脊髓炎相关炎性因子对小鼠骨髓来源MSCs自噬有激活作用,并通过自噬促使MSCs生物学功能发生改变[15]。在炎性因子IFN-γ的干预下,人胎盘胎儿侧来源 MSCs 胞内自噬小体的形成明显增多[16]。INF-γ可以通过IRF-1信号通路诱导自噬的发生,在此过程中,不但有与炎症密切相关的JAK、STAT等关键转录蛋白的激活,还有PI3K-mTOR自噬相关信号通路参与[17]。在IFN-γ和TNF-α模拟炎性环境联合干预下,MSCs自噬相关蛋白的表达明显增强[18]。在炎性环境中,炎性因子可以通过对多条炎性信号通路的调节,来实现对自噬的调控作用。TLR4/NF-κB通路能够同时参与炎症与自噬的调节[19],而PI3K、Akt、ERK等炎性信号通路均是调控细胞自噬的关键通路[20]。由此可见,炎症相关的炎性因子与MSCs自噬的发生关系密切,并在一定程度上可诱发其自噬作用增强。
但是,炎性环境对细胞自噬的调节是双重性的:过度的炎性刺激将加速细胞的凋亡,而凋亡信号的激活会抑制自噬的发生[21],见Fig 1。从炎症组织提取的颌骨骨髓间充质干细胞(jaw of bone marrow mesenchymal stem cells, JBMMSCs)相较于正常组织来源的JBMMSCs的自噬明显较弱[22]。造成这一现象的原因可能与炎症干预时间有关,同时与炎性环境中炎性因子的浓度也有一定相关性。当促炎因子TNF-α 短时间作用于JBMMSCs时,其自噬水平升高;但当用TNF-α持续干预时,细胞的自噬现象逐渐消失,凋亡更明显[23]。
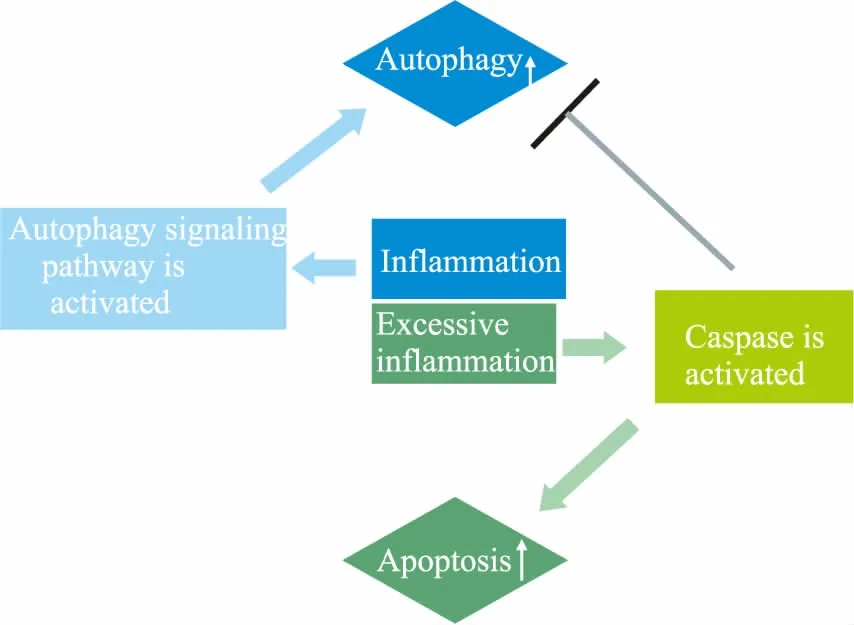
Fig 1 Double meaning of inflammation to autophagy
3 自噬对炎性环境中细胞旁分泌的影响
一方面,炎性环境可以诱导细胞自噬发生,通过对受损细胞器及蛋白的吞噬产生能量,提高细胞自身在特殊环境中的稳定性;另一方面,自噬也可以通过对细胞旁分泌的改变来影响所处炎性环境中细胞因子组成,进一步减少环境对细胞的刺激[7]。通过对小鼠小肠上皮细胞自噬的激活,在肠黏膜炎症反应减弱的同时,上皮细胞所分泌的促炎因子TNF-α、IL-6的降低也十分明显[24]。提示细胞自噬不仅可以维持本身在炎性环境中的相对稳态,还能通过调节细胞炎性因子的分泌来发挥对炎症的负向调控作用。自噬基因敲除后的小鼠出现自发性无菌性肺部炎症,局部炎性小体与血清中炎性因子IL-18均异常增多[25]。当细胞的自噬通道被阻断时,免疫细胞对IL-6和IL-1β等促炎因子的分泌有所增加,促进炎症发生[26]。提示自噬在细胞炎性因子的分泌过程中起重要作用。通过以上研究可以发现,自噬对炎性环境中细胞的旁分泌调节对炎症相关疾病是有积极意义的。
4 炎性环境与MSCs自噬的相互调节机制
如前文所述,炎性环境能够对自噬起到调节作用[20],而细胞自噬也能够通过细胞旁分泌对炎性环境进行调控[26],因此,自噬与炎性环境之间的相互作用形成了一种反馈调节的机制(Fig 2)。炎性环境具有诱导细胞自噬的功能,这是细胞在处于这种特殊环境中的一种应激反应;当自噬强度在炎症的诱导因素下增强时,其能够通过炎性信号通路的调节及细胞旁分泌的影响,使细胞所处的炎性环境发生改变[27]。近年来研究显示,细胞可以通过Toll 样受体(Toll-like receptor,TLR)病原相关分子模式(pathogen-associated molecular patterns,PAMP)促进炎性因子分泌,激活适应性免疫应答;在炎症反应被诱发的同时,TLR族信号分子可以激发细胞自噬,而细胞自噬对TLR信号和炎症反应有负向调控作用[14](Fig 3)。因此,细胞自噬的变化与炎症疾病的发生有密切联系。这种反馈-调节作用在自噬与炎性环境之间形成一个完整的网络关系,为我们进一步充分了解MSCs在炎性环境中的生理病理状态,以及自噬在其中的关键作用打下基础。
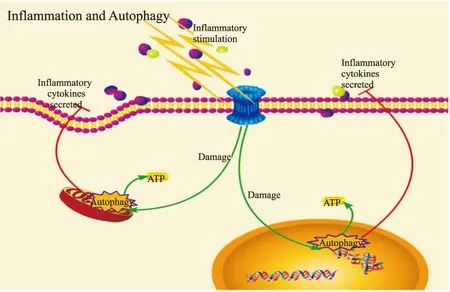
Fig 2 Regulatory effect between autophagy and inflammatory environment
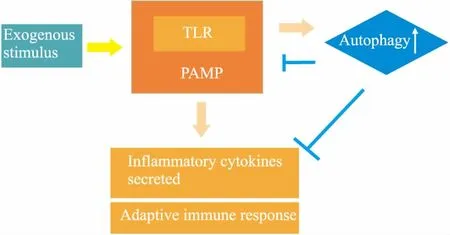
Fig 3 Relationship between inflammation and autophagy in pathogen-associated molecular patterns
5 小结与展望
综上所述,我们认为,炎性环境对MSCs的自噬作用具有双重性。一方面,炎症因素诱导细胞自噬作用增强,使细胞维持相对稳态[14];另一方面,过度的炎性刺激会增加细胞凋亡,反而抑制自噬作用[23]。当自噬被炎性因素激活时,其能够通过旁分泌以及对TLR相关信号通路的调控,来影响外环境细胞因子的组成,从而达到对炎症的负调控作用[27]。因此,炎性环境与自噬之间的相互作用形成了反馈-调节的模式。
适度的自噬是细胞应对炎症刺激的自我调节手段之一,不但能够协助维持特殊环境中MSCs的相对稳态,还能进一步对细胞外环境进行调节[27]。因此,全面、深入地了解自噬发生、发展的特点及其与炎性环境间的相互关系,对探索MSCs在炎性环境中的生理病理状态、维持其生物形状稳定具有重要意义。如何合理利用MSCs的自噬作用,对其在炎性环境中的存活以及在临床上的应用至关重要,值得我们进一步探讨。通过自噬强度的调控,将是协助干细胞在临床应用中面对炎性环境更好发挥治疗作用的重要途径。鉴于自噬与干细胞间的关系,依靠炎症相关的自噬信号通路转录因子作为药物作用靶点,有效地调控特殊环境中干细胞生物学稳定性将是我们未来药物研究的新方向。
参考文献:
[1] Stoltz J F, De I N, Li Y P, et al.Stem cells and regenerative medicine: myth or reality of the 21th century[J].StemCellsInt, 2014,2015(11): 1-19.
[2] Jiang Y, Jahagirdar B N, Reinhardt R L, et al.Pluripotency of mesenchymal stem cells derived from adult marrow[J].Nature, 2015,418(6893): 41-9.
[3] Liu Y, Wang L, Kikuiri T, et al.Mesenchymal stem cell-based tissue regeneration is governed by recipient T lymphocytes via IFN-α and TNF-α[J].NatMed, 2011,17(12): 1594-601.
[4] 李赫宁,李兰芳,陈临溪.内质网自噬——疾病防治的新靶标[J].中国药理学通报, 2015,31(3): 302-8.
[4] Li H N, Li L F, Chen L X.Endoplasmic reticulum of autophagy—disease prevention and control of new targets [J].ChinPharmacolBull, 2015,31(3): 302-8.
[5] Boya P, Reggiori F, Codogno P.Emerging regulation and functions of autophagy[J].NatCellBiol, 2013,15(8): 713-20.
[6] Zhang H, Gong Y, Wang Z, et al.Apelin inhibits the proliferation and migration of rat PASMCs via the activation of PI3K/Akt/mTOR signal and the inhibition of autophagy under hypoxia[J].JCellMolMed, 2014,18(3): 542-53.
[7] Wang Z, Wang Y, Wang Z, et al.Engineered mesenchymal stem cells with enhanced tropism and paracrine secretion of cytokines and growth factors to treat traumatic brain injury[J].StemCells, 2015,33(2): 456-67.
[8] Arnold K M, Opdenaker L M, Flynn D, et al.Wound healing and cancer stem cells: inflammation as a driver of treatment resistance in breast cancer[J].CancerGrowthMetastasis, 2015,8: 1-13.
[9] Saulite L, Dapkute D, Pleiko K, et al.Nano-engineered skin mesenchymal stem cells: potential vehicles for tumour-targeted quantum-dot delivery[J].BeilsteinJNanotechnol, 2017,8(8): 1218-30.
[10] Dave M, Mehta K, Luther J, et al.Mesenchymal stem cell therapy for inflammatory bowel disease: a systematic review and Meta-analysis.[J].InflammBowelDis, 2015,21(11): 2696.
[11] Hofer H R, Tuan R S.Secreted trophic factors of mesenchymal stem cells support neurovascular and musculoskeletal therapies[J].StemCellResTher, 2016,7(1): 131.
[12] 武有明,张 齐,刘永琦,等.黄芪多糖对肺癌微环境中BMSCs增殖及TAFs分化的影响[J].中药药理与临床, 2015,31(6): 76-9.
[12] Wu Y M, Zhang Q, Liu Y Q, et al.Astragalus polysaccharide on the proliferation and TAFs differentiation of BMSCs in lung cancer microenvironment influence [J].PharmacolClinChinMaterMed, 2015,31(6): 76-9.
[13] Zhu H, Guo S, Zhang Y,et al.Proton-sensing GPCR-YAP signalling promotes cancer associated fibroblast activation of mesenchymal stem cells[J].IntJBiolSci, 2016,12(4): 389-96.
[14] Zhong Z, Sanchez-Lopez E, Karin M.Autophagy, inflammation, and immunity: a Troika governing cancer and its treatment[J].Cell, 2016,166(2): 288-98.
[15] Dang S, Xu H, Xu C, et al.Autophagy regulates the therapeutic potential of mesenchymal stem cells in experimental autoimmune encephalomyelitis[J].Autophagy, 2014,10(7): 1301-15.
[16] 朱永朝, 李 芳, 韩 飞,等.IFN-γ诱导的自噬抑制人胎盘胎儿侧来源间充质干细胞增殖[J].基础医学与临床, 2016,36(3): 295-300.
[16] Zhu Y C, Li F, Han F, et al.IFN-gamma induced autophagy inhibition of human placenta fetal side between the source of mesenchymal stem cells proliferation[J].BasicClinMed, 2016,36(3): 295-300.
[17] 蔡永青,胡建辉,李小丽.炎症因子调节细胞自噬的研究进展[J].免疫学杂志, 2016,32(9): 821-4.
[17] Cai Y Q, Hu J H, Li X L.The research progress of inflammation factors regulating cell autophagy[J].ImmunolJ, 2016,32(9): 821-4.
[18] Han Z, Jing Y, Xia Y, et al.Mesenchymal stem cells contribute to the chemoresistance of hepatocellular carcinoma cells in inflammatory environment by inducing autophagy[J].CellBiosci, 2014,4(1): 22-37.
[19] Martinezoutschoorn U E, Whitakermenezes D, Lin Z, et al.Cytokine production and inflammation drive autophagy in the tumor microenvironment[J].CellCycle, 2011,10(11): 1784-93.
[20] Fan X, Wang J, Hou J, et al.Berberine alleviates ox-LDL induced inflammatory factors by up-regulation of autophagy via AMPK/mTOR signaling pathway[J].JTranslMed, 2015,13(1): 92-7.
[21] Kaminskyy V O, Zhivotovsky B.Free radicals in cross talk between autophagy and apoptosis[J].AntioxidRedoxSignal, 2014,21(1): 86-102.
[22] 安 莹.自噬调控人颌骨骨髓间充质干细胞旁分泌功能的机制研究[D].西安: 第四军医大学, 2016.
[22] An Y.Autophagy regulation between jaw bone marrow mesenchymal stem cell paracrine function mechanism research[D].Xian: the Fourth Military Medical University, 2016.
[23] 安 莹, 张立强, 薛 芃, 等.TNF-α对牙周膜干细胞和颌骨骨髓间充质干细胞自噬水平的影响[J].口腔生物医学, 2015,6(3): 119-23.
[23] An Y, Zhang L Q, Xue P, et al.TNF-α of periodontal membrane between stem cells and jaw bone marrow mesenchymal stem cell autophagy level influence [J].OralBiomed, 2015,6(3): 119-23.
[24] Negroni A, Colantoni E, Vitali R, et al.NOD2 induces autophagy to control AIEC bacteria infectiveness in intestinal epithelial cells[J].InflammRes, 2016,65(10): 803-13.
[25] Abdel Fattah E, Bhattacharya A, Herron A, et al.Critical role for IL-18 in spontaneous lung inflammation caused by autophagy deficiency[J].JImmunol, 2015,194(11): 5407-16.
[26] Wang W R, Li T T, Jing T, et al.SIRT1 regulates the inflammatory response of vascular adventitial fibroblasts through autophagy and related signaling pathway[J].CellPhysiolBiochem, 2017,41(2): 569-77.
[27] Rodgers M A, Bowman J W, Liang Q, et al.Regulation where autophagy intersects the inflammasome[J].AntioxidRedoxSignal, 2014,20(3): 495-511.