不同转移潜能肝癌细胞株miRNAs表达谱的差异性研究
孙嘉玲,文 彬,孙海涛, 陈冠新,杨雪梅,陈炜聪,安海燕,庞 杰,贺松其
(1.南方医科大学中医药学院,广东 广州 510515;2.中国人民解放军第四五八医院中医科,广东 广州 510602)
原发性肝细胞癌(hepatocellular carcinoma,HCC)是一种常见的恶性肿瘤,基于HCC起病隐匿、早期诊断困难、高转移、高复发的特性,导致每年死于HCC的人数高居世界恶性肿瘤死亡人数的第3位[1]。MicroRNAs(miRNAs)是一种高度保守的、非编码的单链小RNA,通过调节其靶基因的表达参与调控多种疾病的生理病理过程。研究发现,在HCC中异常表达的miRNAs可作为致癌或抑癌基因,参与调控HCC的增殖、凋亡、转移、侵袭等[2]。但在目前已有的研究中,缺乏同时对不同转移潜能肝癌细胞株miRNA差异表达谱的分析比较。因此,本研究采用高通量测序技术结合生物信息学分析的方法,对MHCC-97H(高转移)、Hep3B(不转移)两种不同转移潜能肝癌细胞株与正常肝细胞L02比较,以及两者相互比较的miRNA差异表达谱进行全面而系统的分析,对筛选HCC的诊断、治疗及预后的有效指标和寻找新的治疗靶点具有十分重要的临床意义。
1 材料
1.1细胞株肝癌细胞株Hep3B购自广州浩玛生物科技有限公司;正常肝细胞L02、肝癌细胞株MHCC-97H购自南京凯基生物科技发展有限公司。
1.2试剂DMEM(高糖)培养基、胎牛血清购自Gibco公司;TRIzol购自北京全式金生物有限公司;Agilent Human miRNA(V21.0)芯片、miRNA Complete Labeling and Hyb Kit及Gene Expression Wash Buffer Kit购自Agilent公司;miRNA第一链cDNA合成(加尾法)试剂盒及引物购自上海生工生物工程股份有限公司;SYBR®Premix Ex TaqTMⅡ (Tli RNaseH Plus)(RR820A)购自TaKaRa公司。
1.3仪器Allegra64R台式高速冷冻离心机(美国Beckman Coulter);Mx3005P荧光定量PCR仪(美国Agilent Stratagene)等。
2 方法
2.1细胞培养肝癌细胞株Hep3B(不转移)、MHCC-97H(高转移)及正常肝细胞L02用含10%胎牛血清的DMEM培养基在37℃、5% CO2饱和湿度的培养箱中培养。
2.2细胞总RNA提取及质量监控常规收集细胞后,采用TRIzol一步法提取细胞中总RNA,具体操作按说明书进行。所得总RNA使用Agilent Bioanalyzer 2100和NanoDrop ND-2000分光光度计进行质检,检测样本的总量、RNA完整指数(RNA integrity number,RIN)、28S/18S以及A260/A280数据,质检合格的样本可用于后续芯片实验。
2.3miRNA芯片分析采用Agilent公司生产的人miRNA(V21.0)芯片进行miRNA表达谱分析。根据Agilent芯片配套试剂盒说明书,对实验样本中的miRNA进行荧光标记、芯片杂交及洗片后,用Agilent Microarray Scanner进行扫描,用Agilent Feature Extraction Software 10.7.1.1读取数据,最后采用R语言程序包AgiMicroRna进行归一化处理[3],所用的算法为Quantile。采用t检验计算差异表达的miRNA(P<0.01),筛选出差异表达2倍以上(Fold change值≥2或≤0.5)的miRNAs。
2.4荧光定量RT-PCR验证芯片结果按上述方法提取总RNA,按照miRNA第一链cDNA合成(加尾法)试剂盒说明书,Poly A加尾法逆转录RNA。qRT-PCR过程按照说明书操作,qPCR反应条件:95℃ 30 s,(95 ℃ 15 s,60 ℃ 20 s)40个循环。内参选用U6,内参及目的miRNAs引物由上海生工生物工程股份有限公司提供。用2-△△CT法进行相对定量分析。
2.5靶基因预测及生物信息学分析采用TargetScan、miRanda、miRWalk、miRDB 4种靶基因预测软件对经过验证的差异表达明显的miRNAs进行靶基因预测,对结果进行重叠与筛选,选择同时被2个以上miRNAs靶向的基因,运用OmicshareTools(www.omicshare.com/tools)来构建差异表达miRNAs与靶基因调控网络图。筛选出的靶基因运用David 6.8软件(https://david.ncifcrf.gov/home.jsp)进行Gene Ontology(GO)和Kyoto encyclopedia of genes and genomes(KEGG)分析。
3 结果
3.1样本RNA质量鉴定各组RNA样本的RIN≥7.0,且28S/18S≥0.7,28S rRNA和18S rRNA条带清晰,无过多的5S rRNA,表明RNA样本完整性好,无明显降解,符合后续芯片实验要求(Fig 1)。
3.2肝癌细胞株Hep3B(不转移)与正常肝细胞株L02之间的miRNA差异表达谱与L02相比,在Hep3B中差异表达明显的miRNAs共有46个(P<0.01,Fold change≥2),上调的miRNAs有20个,下调的miRNAs有26个。其中,上调、下调最明显的5个miRNAs见Tab 1。

Fig 1 Results of sample RNA quality test
3.3肝癌细胞株MHCC-97H(高转移)与正常肝细胞株L02之间的miRNA差异表达谱与L02相比,在MHCC-97H中差异表达明显的miRNAs共有22个(P<0.01,Fold change≥2),上调的miRNAs有8个,下调的miRNAs有14个。其中,上调、下调最明显的5个miRNAs见Tab 2。
3.4肝癌细胞株MHCC-97H(高转移)与Hep3B(不转移)之间的miRNA差异表达谱与Hep3B相比,在MHCC-97H中差异表达明显的miRNAs共有90个(P<0.01,Fold change≥2),上调的miRNAs有46个,下调的miRNAs有44个。其中,上调、下调最明显的5个miRNAs,见Tab 3。
3.5qRT-PCR验证差异表达miRNA芯片结果显示,与正常肝细胞相比,miR-192-5p、miR-215-5p在不同转移潜能的肝癌细胞株中都明显上调,而miR-130a-3p及miR-196a-5p则都明显下调,归为组1。而在肝癌细胞株MHCC-97H(高转移)与Hep3B(不转移)比较的芯片结果中,miR-224-5p 在高转移的肝癌细胞株MHCC-97H中明显增高,而miR-146a-5p、miR-483-3p、miR-200b-3p则明显降低,归为组2。利用荧光定量RT-PCR法分别检测组1、组2的miRNA差异表达情况,所得结果与芯片结果相一致,见Fig 2。
3.6差异表达miRNAs的靶基因预测与生物信息学分析运用miRanda、Targetscan、miRWalk、miRDB 4种靶基因预测软件分别对组1、组2中差异表达miRNAs的靶基因进行预测,结果取交集,得到组1靶基因548个,组2靶基因996个。根据靶基因预测结果,选择同时被同组2个以上miRNAs靶向的基因来构建差异表达miRNAs与靶基因调控网络图,见Fig 3。
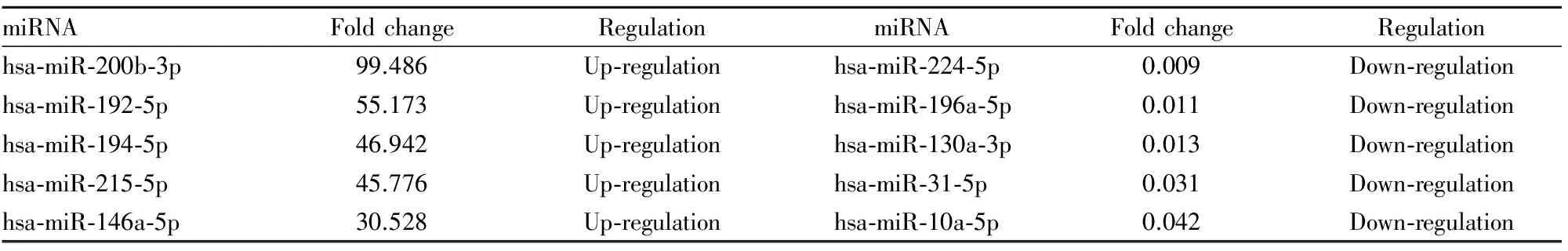
Tab 1 Differential expression of miRNAs between liver cancer cell Hep3B and normal hepatocytes L02
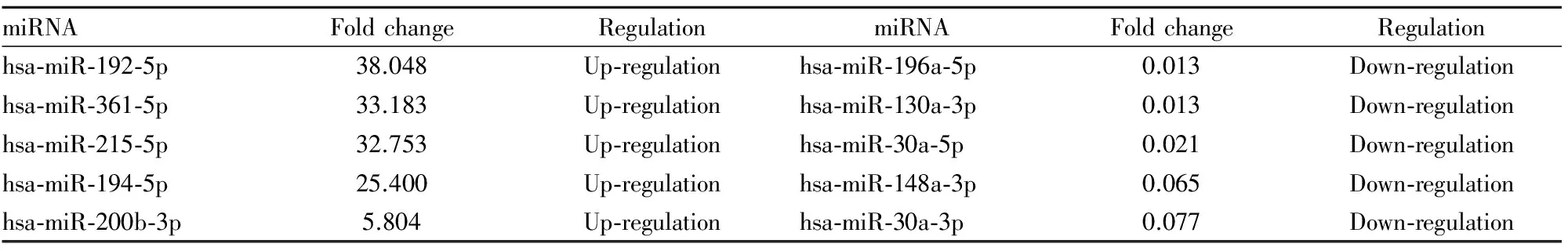
Tab 2 Differential expression of miRNAs between liver cancer cell MHCC-97H and normal hepatocytes L02
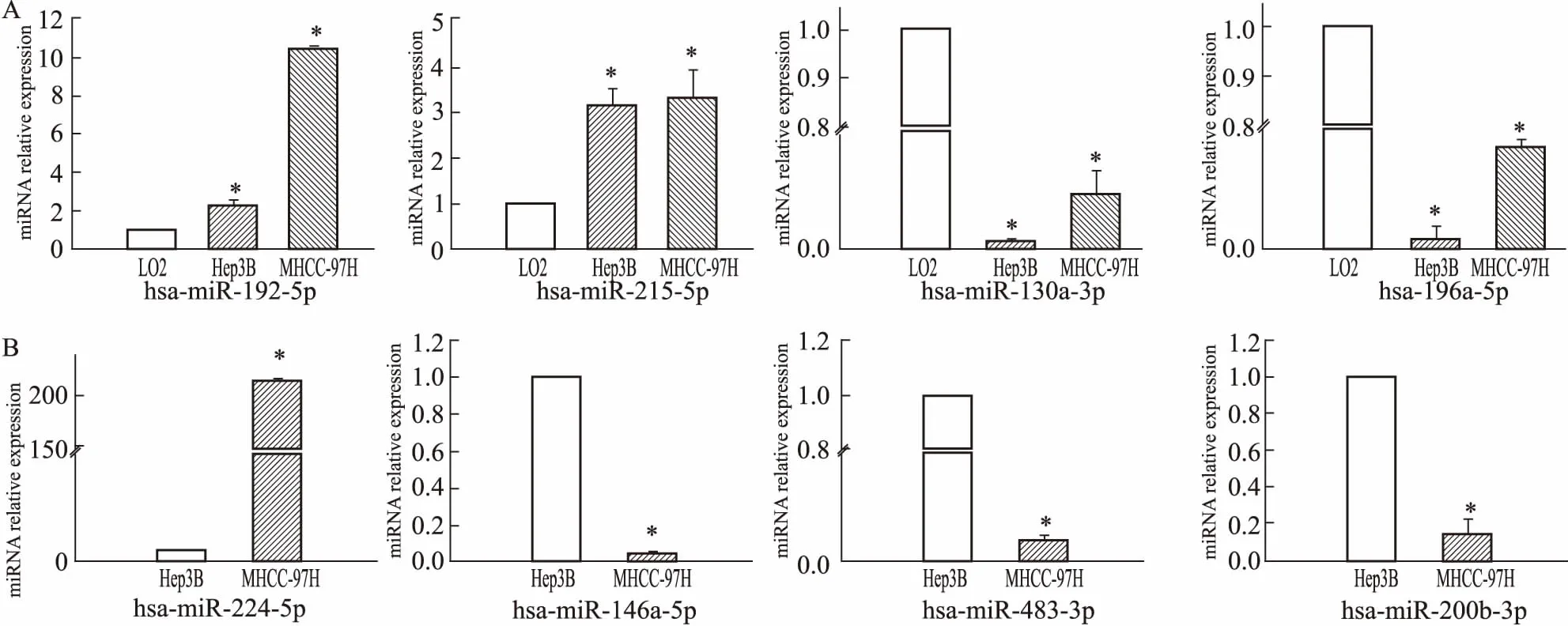
Fig 2 Validation of miRNAs microarray data via n=3, normalized to U6)
A: The relative expression value of miR-192-5p, miR-215-5p, miR-130a-3p and miR-196a-5p in group 1.*P<0.05vsL02; B: The relative expression value of miR-224-5p, miR-146a-5p, miR-483-3p and miR-200b-3p in group 2.*P<0.05vsHep3B.
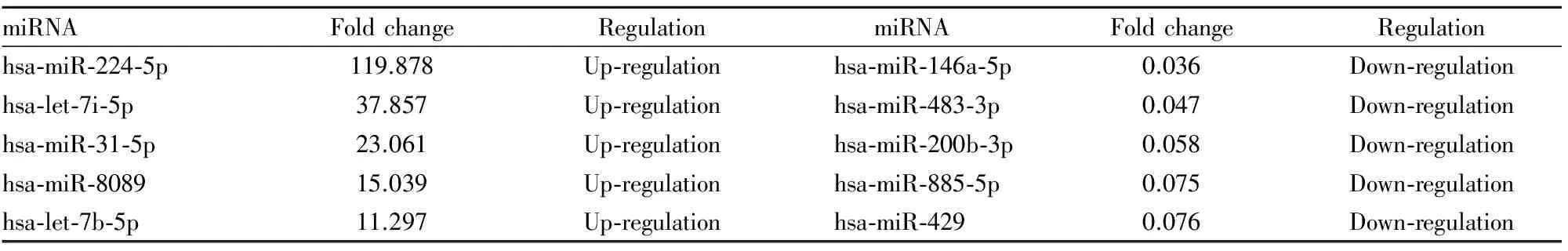
Tab 3 Differential expression of miRNAs between liver cancer cell MHCC-97H and Hep3B
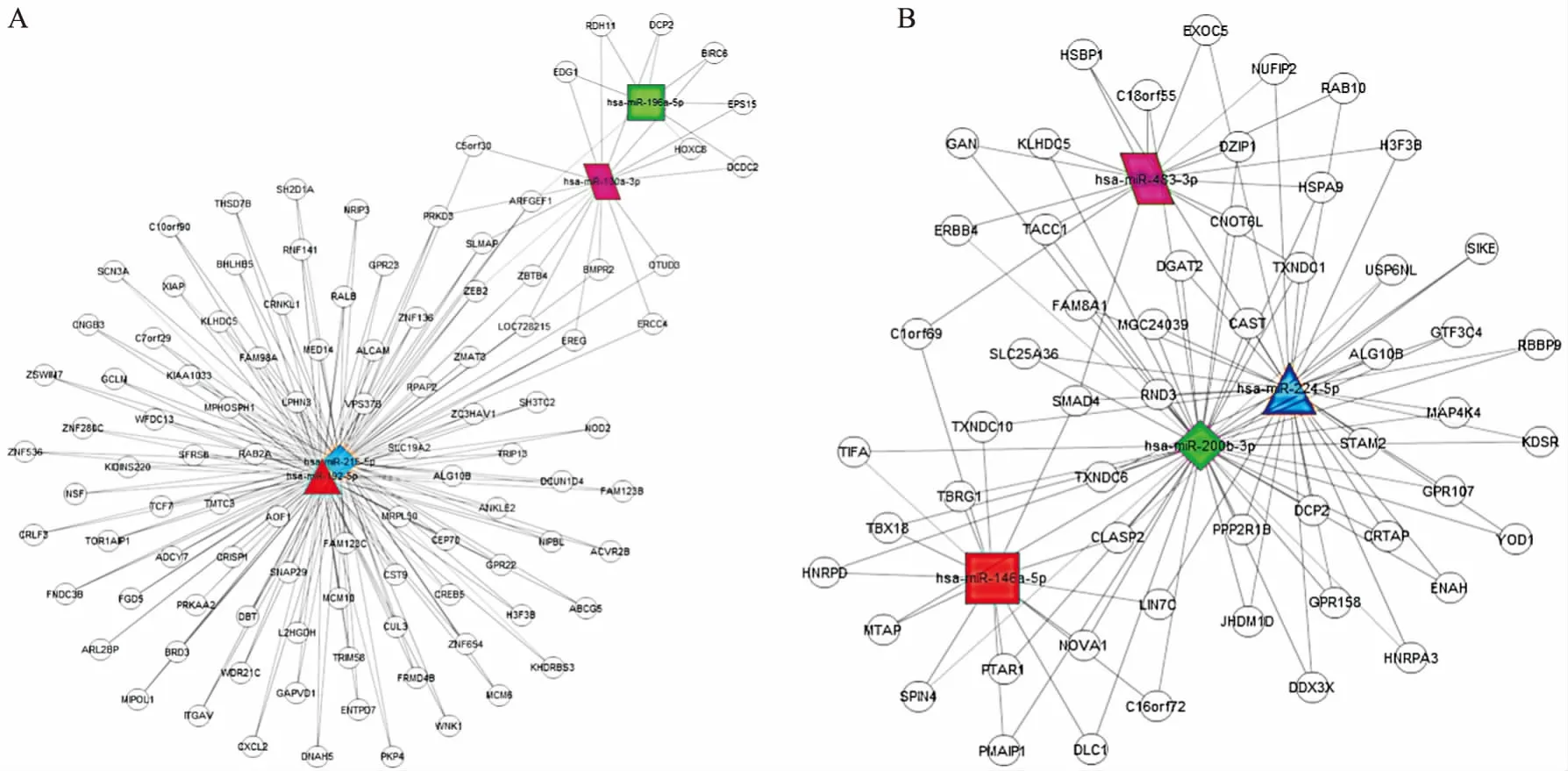
Fig 3 Predicted target network of differentially expressed miRNAs
分别对组1、组2的miRNAs靶基因预测结果进行GO富集分析及KEGG通路分析。结果显示,组1中miRNAs调控的靶基因功能主要富集于21个GO(P<0.01,Fig 4A)。其中12个GO涉及生物学过程(biological process, BP),包括自噬体成熟、对苯丙胺的反应、腺苷酸环化酶活性的激活等;5个GO涉及细胞组分(cellular component, CC),包括细胞皱褶、受体复合物、核内体、中心体、核浆;4个GO涉及分子功能(molecular function, MF),包括Ral GTP酶结合、磷脂酰肌醇-3-磷酸结合、序列特异性DNA结合、蛋白结合。组1的KEGG通路分析结果显示,靶基因明显富集于18条信号通路(P<0.01,Fig 4B),包括肿瘤相关通路、p53信号通路、FoxO信号通路等。组2中miRNAs调控的靶基因功能主要富集于66个GO(P<0.01,Fig 5A)。其中30个GO涉及生物学过程,包括α-β T细胞增殖的正调控、溶酶体运输、心内膜垫发展、蛋白质泛素化等;19个GO涉及细胞组分,包括细胞质应激颗粒、Cul3-RING泛素连接酶复合体、髓鞘、泛素连接酶复合体、肌动蛋白细胞骨架等;17个GO涉及分子功能,包括异天冬氨酸甲基转移酶活性、磷酸苏氨酸结合、棕榈酰转移酶活性等。组2的KEGG通路分析结果显示,靶基因明显富集于3条信号通路(P<0.05,Fig 5B),分别为泛素调节蛋白水解通路、内吞作用通路和Hippo信号通路。
4 讨论
目前,大量研究表明,miRNAs的异常表达与HCC的发生发展、转移侵袭密切相关。在本实验中,我们先以正常肝细胞L02为对照组,运用miRNA芯片技术,分别筛选MHCC-97H、Hep3B两种不同转移潜能肝癌细胞株与正常肝细胞L02相比的miRNA差异表达谱,发现miR-192-5p、miR-215-5p、miR-130a-3p、miR-196a-5p在两种肝癌细胞株中的表达都明显改变,并使用qRT-PCR对以上4个miRNAs进行检测验证,所得结果与芯片结果基本一致。目前研究发现,miR-192-5p在HCC组织及多种肝癌细胞株中都表达上调,可通过靶向调节SEMA3A的表达来促进肝癌细胞HCCLM3的增殖、转移和侵袭[4]。miR-215-5p已被证实在多种恶性肿瘤中表达异常,并发挥关键的促癌或抑癌作用,包括胃癌、HCC、食管腺癌、结肠直肠癌等[5]。作为HCC的致癌基因,过表达miR-215可明显降低其靶基因PTPRT的表达,促进肝癌细胞的增殖[6]。与癌旁组织相比,miR-130a在肝癌组织中的表达明显下调,且与肿瘤大小、肿瘤淋巴转移分期密切相关,伴有miR-130a低表达的肝癌患者的总生存期与miR-130a高表达的患者相比要明显缩短[7]。miR-196a在多种肿瘤中都表达异常,包括乳腺癌、肺癌、宫颈癌、HCC、胰腺癌、结直肠癌、胃癌等[8],但其在HCC中的作用机制尚不明确。
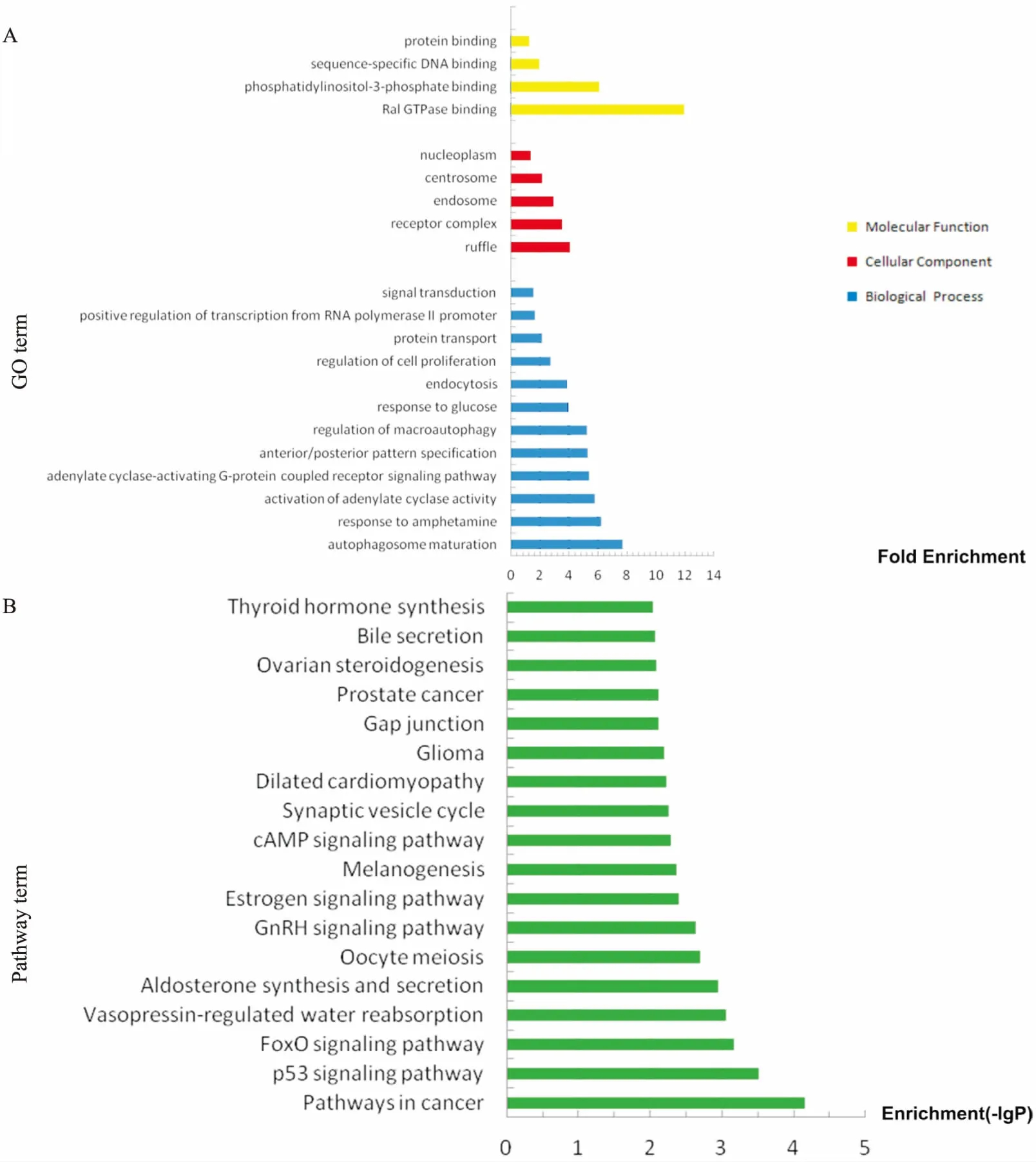
Fig 4 GO and KEGG pathway analysis on differentially expressed miRNAs of group 1
为进一步研究与HCC转移侵袭密切相关的miRNAs,本研究还分析比较了两种肝癌细胞株MHCC-97H(高转移)与Hep3B(不转移)之间的miRNA差异表达谱。结果显示,miR-224-5p 在高转移的肝癌细胞株MHCC-97H中增高最明显,而miR-146a-5p、miR-483-3p、miR-200b-3p则明显下调。miR-224已被证实在HCC组织及肝癌细胞MHCC-97H、MHCC-97L、HepG2中的表达均明显增高,可下调其靶基因HOXD10的表达,通过miR-224/HOXD10/p-PAK4/MMP-9信号通路来增强肝癌细胞的转移侵袭能力[9]。研究发现,miR-146a定位于人类染色体5q34(这个区域在人类肿瘤中经常缺失)上,在HCC、前列腺癌、胰腺癌等肿瘤中表达降低[10]。已知miR-483-3p在HCC组织中与相邻正常组织相比表达降低[11],但目前尚缺乏其对HCC调控机制的研究。上皮间质转化(epithelial-mesenchymal transition,EMT)与肿瘤的转移侵袭密切相关,而miR-200家族在HCC组织及细胞中表达普遍降低,是EMT的主要调节基因,可有效抑制肿瘤的侵袭转移。miR-200家族由5个进化上保守的成员组成,可分为两群,包括位于染色体1p36的miR-200a、miR-200b和miR-429,及位于染色体12p13的miR-200c及miR-141。miR-200家族表达的缺失会导致ZEB1和ZEB2表达的上调,随后导致E-cadherin转录抑制,从而促进肝癌细胞发生EMT[12]。在本次实验中,与不转移肝癌细胞Hep3B相比,hsa-miR-200b-3p、hsa-miR-429、hsa-miR-200a-3p在肝癌细胞MHCC-97H中都是明显降低的。
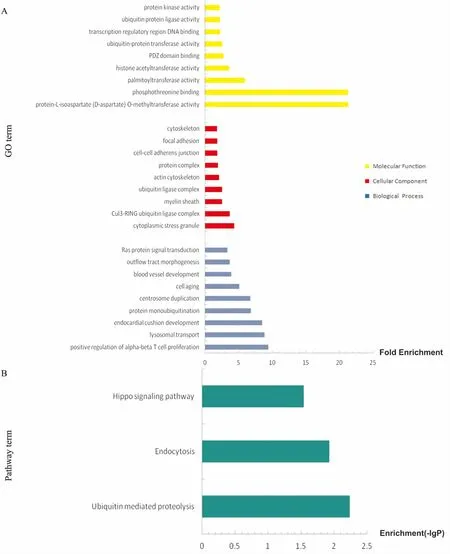
Fig 5 GO and KEGG pathway analysis on differentially expressed miRNAs of group 2
A: Top 27 of GO terms enriched in group 2(P<0.01); B: 3 KEGG pathway enriched in group 2(P<0.05, the -lgPis the negative logarithm ofP-value).
高通量测序与生物信息学分析常常相辅相成。在HCC中,生物信息学分析对筛选肿瘤诊断及预后标志物、放化疗敏感性相关基因和潜在异常通路等具有重要意义。本研究运用miRanda、Targetscan、miRWalk、miRDB 4种靶基因预测软件,分别对组1、组2中差异表达的miRNAs进行靶基因预测,并分别对两组靶基因结果进行了GO富集分析和KEGG通路分析。在组1的GO富集分析的分子功能部分, Ral GTP酶结合条目的靶基因富集值最高。Ral GTP酶不仅可与特定的效应器蛋白相互作用参与调控细胞的胞外分泌和相关的细胞活性,而且其被致癌基因Ras的异常激活还是肿瘤形成的主要原因,在多种肿瘤的增殖、转移和侵袭中起重要作用[13]。在生物学过程中,组1的靶基因主要富集于自噬体成熟条目,而组1的KEGG通路分析结果显示,肿瘤相关通路和p53信号通路是组1中miRNAs的靶基因主要涉及的通路。p53基因不仅可作为肿瘤的抑癌基因,还参与了自噬的调控。Di等[14]研究发现,p53可通过调控其靶基因Rap2B(属于Ras-相关GTP结合蛋白家族,并在多种肿瘤中表达上调)来抑制自噬。在组2的KEGG通路分析中,泛素调节蛋白水解通路是组2中miRNAs的靶基因主要涉及的通路,这与组2的靶基因GO富集分析结果相一致。GO富集分析结果显示,组2中的靶基因也与蛋白质泛素化、Cul3-RING泛素连接酶复合体、泛素连接酶复合体等密切相关。因此,组2中的miRNAs可能是通过调节蛋白质的泛素化来调控HCC的转移侵袭。蛋白质泛素化是一种不涉及到溶酶体的降解蛋白质的作用,是真核生物中一种关键的转录后修饰,其过程由一系列酶联反应催化而成。其中,泛素连接酶E3(E3 ubiquitin ligases)中的RING-finger E3s参与调控了许多细胞的生物过程,包括细胞周期进程、DNA损伤应答、细胞信号传导和基因组稳定性的维护等,其功能异常会导致多种恶性肿瘤(包括HCC)的发生[15]。
综上所述,本研究运用miRNA芯片技术对不同转移潜能肝癌细胞株的miRNA差异表达谱进行筛选,对筛选诊断HCC灵敏的生物指标和有效的治疗靶点具有十分重要的临床意义。基于本课题组前期在鳖甲煎丸抗肝癌研究中的良好工作基础,今后,本课题组将通过体外及体内实验验证这些差异表达的miRNAs对HCC的调控作用及分子机制,并在此基础上观察鳖甲煎丸对这些差异表达miRNAs的影响,深入研究鳖甲煎丸抗肝癌转移侵袭的分子机制,有助于进一步诠释鳖甲煎丸多途径、多层次抗肝癌的科学内涵。
(致谢:本文实验在南方医科大学中医药学院分子生物学实验室完成。感谢贺松其教授课题组的老师和同学的尽心协助,以及文彬老师、安海燕老师、庞杰老师的悉心指导。)
参考文献:
[1] 孙嘉玲,文 彬,孙海涛,等.miRNAs与肝细胞癌的相关性研究进展[J].中国药理学通报, 2017,33(4): 445-9.
[1] Sun J L, Wen B, Sun H T, et al.Research progress of relevance between miRNAs and hepatocellular carcinoma[J].ChinPharmacolBull, 2017,33(4): 445-9.
[2] 魏小丽,顾康生,高梦如.MicroRNA与肿瘤铂类耐药的研究[J].中国药理学通报, 2017,33(5): 593-7.
[2] Wei X L, Gu K S, Gao M R.Research of microRNAs and tumor platinum-resistance[J].ChinPharmacolBull, 2017,33(5): 593-7.
[3] López-Romero P.Pre-processing and differential expression analysis of Agilent microRNA arrays using the AgiMicroRna Bioconductor library[J].BMCGenomics, 2011,12:64.
[4] Yan-Chun L, Hong-Mei Y, Zhi-Hong C, et al.MicroRNA-192-5p promote the proliferation and metastasis of hepatocellular carcinoma cell by targeting SEMA3A[J].ApplImmunohistochemMolMorphol, 2017,25(4): 251-60.
[5] Li N, Zhang Q Y, Zou J L, et al.miR-215 promotes malignant progression of gastric cancer by targeting RUNX1[J].Oncotarget, 2016,7(4): 4817-28.
[6] Liu F, You X, Chi X, et al.Hepatitis B virus X protein mutant HBxΔ127 promotes proliferation of hepatoma cells through up-regulating miR-215 targeting PTPRT[J].BiochemBiophysResCommun, 2014,444(2): 128-34.
[7] Li B, Huang P, Qiu J, et al.MicroRNA-130a is down-regulated in hepatocellular carcinoma and associates with poor prognosis[J].MedOncol, 2014,31(10):230.
[8] Li H L, Xie S P, Yang Y L, et al.Clinical significance of upregulation of miR-196a-5p in gastric cancer and enriched KEGG pathway analysis of target genes[J].AsianPacJCancerPrev, 2015,16(5): 1781-7.
[9] Li Q, Ding C, Chen C, et al.miR-224 promotion of cell migration and invasion by targeting Homeobox D 10 gene in human hepatocellular carcinoma[J].JGastroenterolHepatol, 2014,29(4): 835-42.
[10] Zhang Z, Zhang Y, Sun X X, et al.microRNA-146a inhibits cancer metastasis by downregulating VEGF through dual pathways in hepatocellular carcinoma[J].MolCancer, 2015,14: 5.
[11] Wang W, Zhao L J, Tan Y X, et al.MiR-138 induces cell cycle arrest by targeting cyclin D3 in hepatocellular carcinoma[J].Carcinogenesis, 2012,33(5): 1113-20.
[12] Wong C M, Wei L, Au S L, et al.MiR-200b/200c/429 subfamily negatively regulates Rho/ROCK signaling pathway to suppress hepatocellular carcinoma metastasis[J].Oncotarget, 2015,6(15): 13658-70.
[13] Shirakawa R, Horiuchi H.Ral GTPases: crucial mediators of exocytosis and tumourigenesis[J].JBiochem, 2015,157(5): 285-99.
[14] Di J, Tang J, Qian H, et al.p53 upregulates PLCepsilon-IP3-Ca2+pathway and inhibits autophagy through its target gene Rap2B[J].Oncotarget, 2017,8(39): 64657-69.
[15] Yin J, Zhu J M, Shen X Z.The role and therapeutic implications of RING-finger E3 ubiquitin ligases in hepatocellular carcinoma[J].IntJCancer, 2015,136(2): 249-57.