和厚朴酚对咪喹莫特诱导小鼠银屑病的干预作用
钟淇滨,祝曙光,陆少君,蔡肇栩,臧林泉
(广东药科大学1.药学院药理系、2.附属第一医院胸心外科,广东 广州 510006)
银屑病是一种慢性皮肤病,病情长,容易反复发作,全球发病率为2%~3%[1]。有研究调查中国银屑病的流行病学,在12 000例患者中,男女比例为1.49 ∶1,平均发病年龄男性为(30.2±14.5)岁,女性为(27.1±15.6)岁,常见部位在头皮,表现为中度至重度银屑病,多为寻常型银屑病(96.5%)[2]。
咪喹莫特(imiquimod,IMQ)是一种小分子免疫调节剂,被美国FDA批准用于治疗尖锐湿疣。咪喹莫特能通过激活Toll样受体,激发免疫系统,外用能上调表皮细胞血管内皮生长因子(vascular endothelial growth factor,VEGF),诱导表皮细胞产生银屑病样的皮肤损伤[3]。因此,咪喹莫特局部涂抹是一种理想的小鼠寻常型银屑病造模方法。
和厚朴酚(honokiol,HK)是厚朴的有效成分之一,有研究发现HK具有抗炎作用。原代培养风湿性关节炎患者外周血单核细胞,其中IL-1β、TNF-α、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)比正常人单核细胞高,HK能剂量依赖性降低IL-1β、TNF-α、GM-CSF的表达[4]。HK能通过PI3K/Akt、ERK1/2、JNK1/2[5]、p38[6]等信号通路,抑制脂多糖(lipopolysaccharides,LPS)、前列腺素E2和TNF-α诱导产生的炎症。在小鼠脑缺血/再灌注炎症模型中,HK能通过抑制NF-κB活性,降低一氧化氮、TNF-α的产生,保护小鼠脑细胞[7]。在K14-VEGF转基因小鼠银屑病模型中,HK能抑制皮肤组织VEGFR-2的表达,治疗银屑病[8]。银屑病是一种难以根治的非致命性疾病,而中药具有安全性高、副作用少、不容易耐药的特点。本实验先灌胃给予HK 5 d,使小鼠达到血药稳态浓度,然后使用咪喹莫特诱导小鼠造模,观察HK预防和延缓银屑病进展的作用,为将其开发成新药或保健产品提供理论依据。
1 材料与方法
1.1实验动物BALB/c小鼠,♂,体质量(20±2)g,共42只,由广东省医学实验动物中心提供,动物许可证编号:SCXK(粤)2013-0002,于SPF级环境饲养。
1.2试剂HK(广州市合诚化学有限公司,HS-170554),咪喹莫特乳膏(湖北科益药业股份有限公司,170502),医用凡士林(天津大茂化学试剂厂,20161101),地塞米松磷酸钠注射液(湖北天药药业股份有限公司,51611071),大豆磷脂(上海太伟药业有限公司,102604022),胆固醇(上海阿拉丁生化科技股份有限公司,J15120),IL-17、IL-23、TNF-α、JAK、STAT3、NF-κB抗体(万类生物科技有限公司)。
1.3仪器脱水机(武汉俊杰电子有限公司,JJ-12J),包埋机(武汉俊杰电子有限公司,JB-P5),病理切片机(上海徕卡仪器有限公司,RM2016),组织摊片机(浙江省金华市科迪仪器设备有限公司,KD-P),显微镜(CIC公司,XSP-C204)。
1.4药物的制备称取HK 270 mg、卵磷脂810 mg、胆固醇113.4 mg,混合,加入5 mL无水乙醇,搅拌加热至50℃溶解。称量30 mL PBS加热至50℃,搅拌下滴加乙醇混合物,最后减压旋转蒸发除去乙醇,定容至30 mL,即得9 g·L-1HK脂质体。按同样方法制备3、1 g·L-1HK脂质体和阴性对照脂质体。
1.5动物的分组、造模和给药小鼠先灌胃给药5 d,每天1次,灌胃量10 mL·kg-1,达到血药稳态浓度后,再用咪喹莫特乳膏涂抹背部造模7 d,d 13取皮肤组织。42只BALB/c小鼠按体质量随机分为正常组(Normal)、模型组(Model)、脂质体溶剂对照组(Liposome)、地塞米松(dexamethasone,DEX)5 mg·kg-1阳性对照组、HK高、中、低剂量组(90、30、10 mg·kg-1),共7组,每组6只。用剃毛刀和脱毛膏去除背部的毛发,露出2 cm×3 cm的皮肤区域。正常组每天灌胃生理盐水,背部涂抹凡士林,持续12 d;模型组每天灌胃生理盐水;Liposome组每天用脂质体灌胃;DEX组每天DEX 5 mg·kg-1灌胃;HK高、中、低剂量组每天灌胃相应剂量的HK。除正常组外,其余各组小鼠从d 6开始背部涂抹咪喹莫特乳膏60 mg·d-1,持续7 d。
1.6小鼠银屑病样皮损面积和疾病严重程度(psoriasisareaandseverityindex,PASI)评分从d 6咪喹莫特乳膏涂抹造模开始,每天观察小鼠背部情况,按照PASI评分表,分别得出红斑、皮厚、鳞屑的分值(0:无症状;1:轻度;2:中度;3:重度;4:极其严重),相加得出总分,d 13解剖前拍照记录。
1.7皮损处HE染色观察细胞形态学小鼠处死后,按照九宫格法取皮损处组织,浸泡于4%多聚甲醛中固定24 h,脱水、石蜡包埋、切片、HE染色。每组6张切片,随机挑选3个视野,按照同一参数拍照记录,另外拍摄血球计数板充当参照物,利用Image Pro Plus 6.0的标尺功能测量皮层厚度。
1.8免疫组织化学法观察相关蛋白表达石蜡切片脱蜡至水后,加入3%双氧水阻断内源性过氧化物酶,3% BSA室温封闭30 min,一抗4 ℃孵育过夜,二抗(HRP标记)室温孵育50 min,DAB染色、苏木精复染。每组6张切片,随机挑选3个视野,按照同一参数拍照记录。用Image Pro Plus 6.0进行半定量分析,在Segmentation中使用HSI模式,H:0~30,S:0~255,I:0~230,并且根据照片微调。用irregular工具圈出真皮层组织,计算光密度总和(IOD SUM)、测量区域(Area),算出平均光密度(mean density):mean density=(IOD SUM)/Area。
1.9统计学处理PASI、皮肤厚度、免疫组化半定量均采用SPSS 22软件进行数据处理,多组间采用单因素方差分析(One-Way ANOVA)处理,如果方差齐,两组间对比采用LSD检验统计;如果方差不齐,则采用Games-Howell检验统计。
2 结果
2.1HK对咪喹莫特诱导小鼠银屑病样皮损的影响d 6开始在小鼠背部露出皮肤涂抹咪喹莫特乳膏,模型组和Liposome组从d 8开始皮肤出现微小鳞屑;d 10开始皮肤明显增厚,鳞屑变成块状,伴有少量红斑,两组病情没有明显区别。DEX组鳞屑增生不明显,皮肤没有明显变厚。HK高、中、低剂量组的病情随剂量依赖性减轻(Fig 1)。PASI得分用Levene显示方差不齐,采用Games-Howell方法统计。在d 13,各组红斑没有明显区别;正常组和模型组之间鳞屑及肥厚有明显差异,DEX组比模型组有改善;高剂量HK能降低PASI总分(P<0.05),DEX也能明显降低PASI总分(P<0.01),见Fig 2。
2.2小鼠银屑病皮损处HE染色及表皮厚度Fig 3的HE染色显示,实验d 13时,正常组表皮层仅为1~3层细胞,皮脂腺/毛囊呈长条状且中空;模型组和Liposome组表皮厚度为正常组表皮的4倍,角质层出现角化不全,真皮层出现炎症细胞浸润,伴随很多细胞碎片,皮脂腺内聚集大量死细胞,形成Munro微脓肿,在棘层上部出现Kogoj海绵状微脓肿;HK组随剂量依赖性减轻表皮层厚度,真皮层炎症细胞浸润减轻,且皮脂腺导管未完全堵死;DEX组病情最轻,表皮层接近正常对照组,真皮层细胞堆积稍多,皮脂腺结构也依然完好。各组之间皮层厚度差异有显著性。模型组平均表皮厚度为正常组的4倍(P<0.01),DEX组及HK高、中剂量组能明显降低表皮厚度(P<0.01,P<0.05);Liposome组、HK低剂量组与模型组相比差异无统计学意义,见Fig 4。
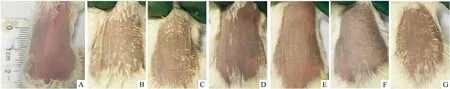
Fig 1 Observation of back skin in mice (day 13)
A: Normal; B: Model; C: Liposome; D: DEX; E: HK 90 mg·kg-1; F: HK 30 mg·kg-1; G: HK 10 mg·kg-1.Model group skin was thickened, scales were massive, accompanied by a small amount of erythema.The symptoms of HK group decreased in a dose-dependent manner, DEX was the most similar to the normal group.
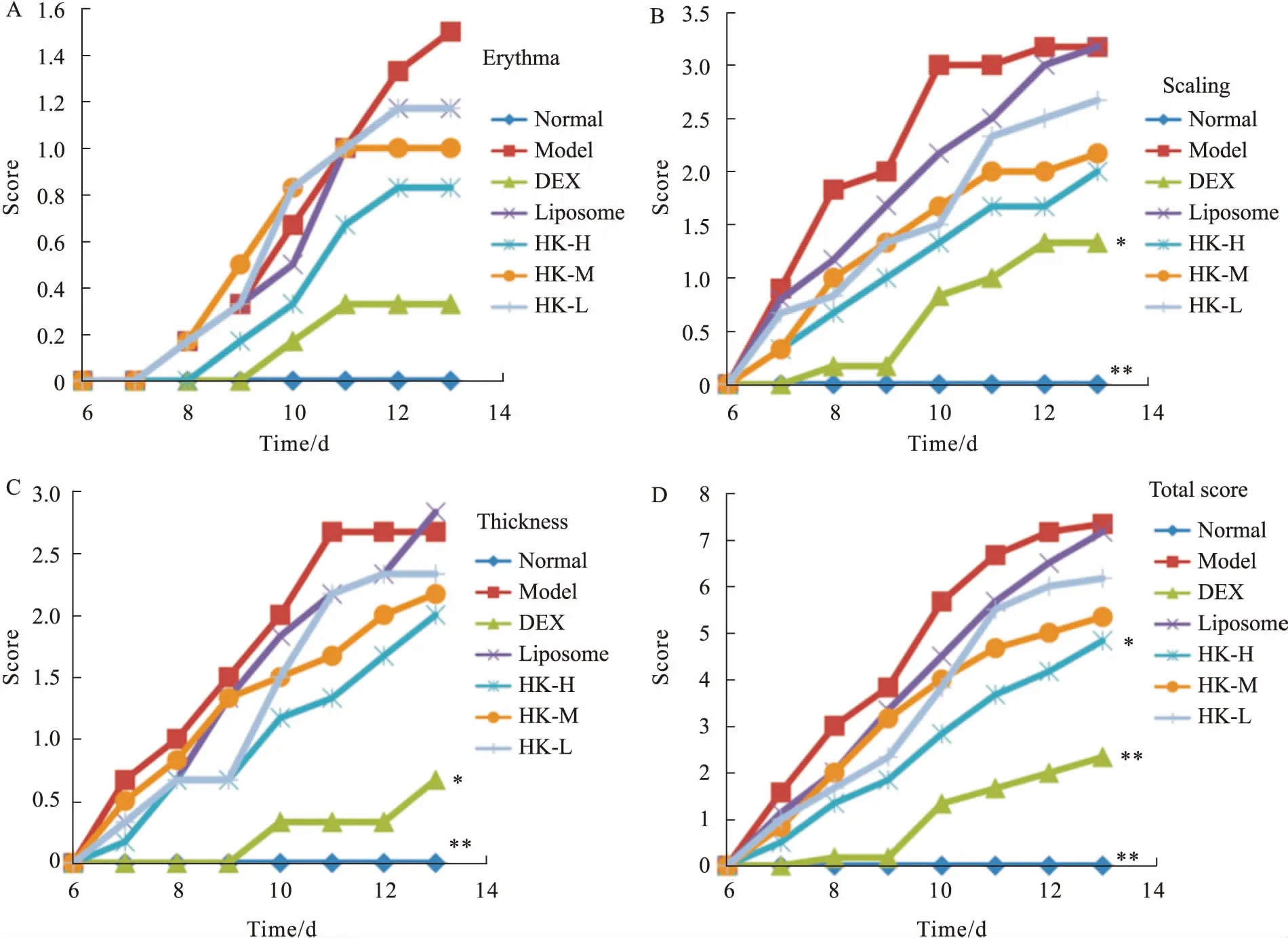
Fig 2 The PSAI scores in mice induced by IMQ
2.3小鼠银屑病皮损处免疫组化以及半定量分析免疫组化图中黄色是阳性表达,如Fig 5所示,正常组小鼠皮肤组织的棕黄色集中在棘层和皮脂腺/毛囊细胞,真皮层则是淡黄色;模型组和Liposome组的真皮层几乎都是棕色;HK能剂量依赖性减少阳性反应。从半定量数据上看,模型组的IL-17、IL-23、JAK、STAT3、NF-κB、TNF-α均比正常组明显增高(P<0.01);DEX和HK高剂量组能明显降低各指标(P<0.05);HK低剂量组、Liposome组与模型组之间差异没有统计学意义。
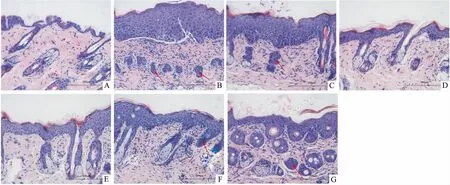
Fig 3 The histological changes of skin lesions in mice(HE, ×200)
A: Normal; B: Model; C: Liposome; D: DEX; E: HK 90 mg·kg-1; F: HK 30 mg·kg-1; G: HK 10 mg·kg-1.Infiltration of inflammatory cells occurred in the dermis of the model group with much cellular debris.A large number of dead cells accumulated in sebaceous glands, forming Munro microabscess.
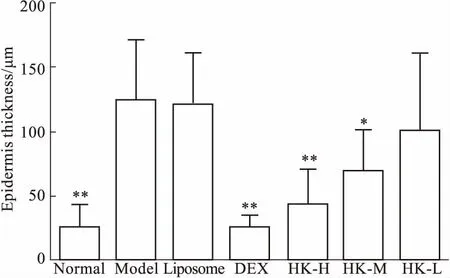
Fig 4 The changes of epidermis thickness of mouse skin (n=6)
*P< 0.05,**P<0.01vsmodel
3 讨论
HK是一种多羟基酚类化合物,水溶性不佳,可能导致生物利用度个体差异较大。因此,采用乙醇注入法制备一种脂质体,从而避免了难溶药物的灌胃损失问题,而设立的脂质体溶剂对照组证明了卵磷脂等脂质体成分并不能改善银屑病,适宜各种难溶性药物的灌胃给药。连续局部外用咪喹莫特7 d能够诱导皮肤银屑病损伤,可能的机制是增强IL-23/IL-17炎症轴及其下游JAK/STAT3、NF-κB、TNF-α的表达。
近年来研究发现,银屑病的发病和进展与Th17细胞介导的IL-23/IL-17炎症轴有关。有研究表明,在银屑病患者中,IL-23、IL-12、TNF-α、IL-22、IL-17表达增加。IL-17是由Th17细胞产生的细胞因子,IL-17包括不同的亚型(IL-17A、IL-17B、IL-17C、IL-17D、IL-17E、IL-17F),IL-6和TGF-β诱导Th0细胞转化成Th17细胞,而IL-23可以促进Th17细胞的分化。IL-17结合IL-17受体后,募集NF-κB,激活MAPK通路。另外,IL-17也能激活JNK/ERK、JAK/STAT3通路,表达炎症相关细胞因子(IL-1β、IL-6、TNF-α)[9]。三硝基苯磺酸致小鼠结肠炎模型中,JAK/STAT表达增加[10],NF-κB上调会加重心肌缺血/再灌注损伤[11]和免疫性肝损伤[12],以上实验均表明JAK/STAT、NF-κB上调能介导各种炎症。
目前已经有针对IL-17/IL-23炎症轴的治疗银屑病新药进行临床试验。Brodalumab是一种人类抗IL-17受体(IL-17RA)单克隆抗体抑制剂,给药12周后,PASI-75指数达到83%~86%[13]。Ixekizumab通过结合IL-17A,阻断其与IL-17受体结合,治疗银屑病,目前已被美国FDA批准上市[14]。口服JAK1/2的抑制剂Baricitinib 12周后,8、10 mg组比安慰剂组明显改善银屑病症状[15]。
本实验免疫组化说明HK能剂量依赖性地抑制炎症通路IL-17/IL-23、JAK/STAT3、TNFα、NF-κB的表达,从而延缓咪喹莫特诱导小鼠银屑病的进展。DEX的抗炎作用效果最佳,可能跟糖皮质激素除了能抑制IL-23/IL-17炎症轴,还能抑制磷脂酶A2,从而减少前列腺素和白三烯等其他炎症通路有关。但是糖皮质激素类药物具有广泛的药理作用,而且糖皮质激素抗炎特异性低,不适宜长期服用,HK能作为一种长期控制银屑病的协同药物和补充方案,本实验为开发HK的新用途和新剂型提供了理论帮助。
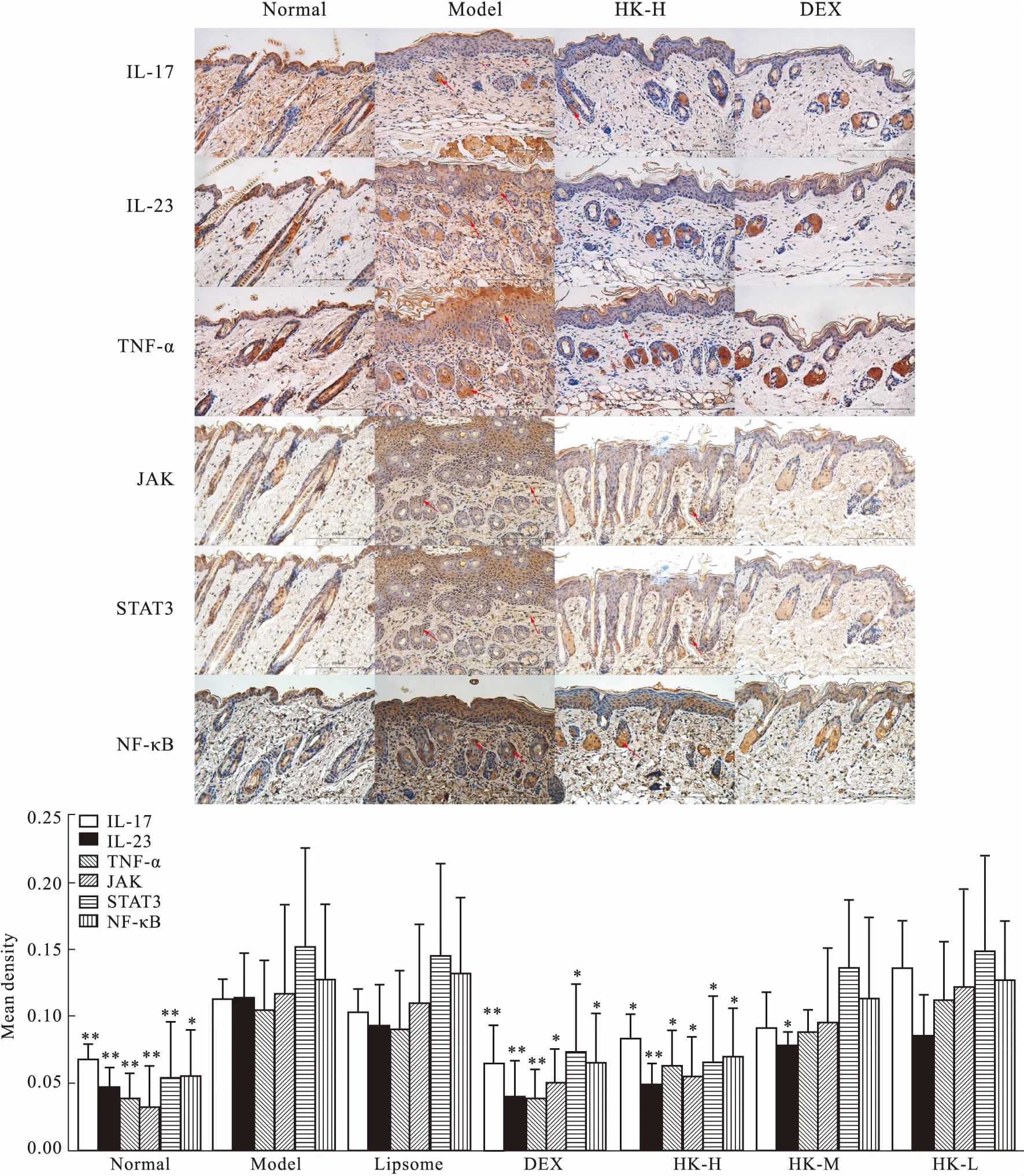
Fig 5 Changes of protein expression in lesions of mouse skin(×200, n=6)
(致谢:本实验是在广东药科大学新药筛选中心完成,感谢指导老师与各位实验室人员的帮助与支持!)
参考文献:
[1] Boehncke W H, Schon M P.Psoriasis [J].Lancet, 2015,386(9997): 983-94.
[2] Chen K, Wang G, Jin H, et al.Clinic characteristics of psoriasis in China: a nationwide survey in over 12 000 patients [J].Oncotarget, 2017,8(28): 46381-9.
[3] Wu H H, Xie W L, Zhao Y K, et al.Imiquimod increases cutaneous VEGF expression in imiquimod-induced psoriatic mouse model [J].CurrVascPharmacol, 2016,14(3): 275-9.
[4] Wang X D, Wang Y L, Gao W F.Honokiol possesses potential anti-inflammatory effects on rheumatoid arthritis and GM-CSF can be a target for its treatment [J].IntJClinExpPathol, 2015,8(7): 7929-36.
[5] Li C Y, Chao L K, Wang S C, et al.Honokiol inhibits LPS-induced maturation and inflammatory response of human monocyte-derived dendritic cells [J].JCellPhysiol, 2011,226(9): 2338-49.
[6] Chao L K, Liao P C, Ho C L, et al.Anti-inflammatory bioactivities of honokiol through inhibition of protein kinase C, mitogen-activated protein kinase, and the NF-kappaB pathway to reduce LPS-induced TNFalpha and NO expression [J].JAgricFoodChem, 2010,58(6): 3472-8.
[7] Zhang P, Liu X, Zhu Y, et al.Honokiol inhibits the inflammatory reaction during cerebral ischemia reperfusion by suppressing NF-kappaB activation and cytokine production of glial cells [J].NeurosciLett, 2013,534: 123-7.
[8] Wen J, Wang X, Pei H, et al.Anti-psoriatic effects of Honokiol through the inhibition of NF-kappaB and VEGFR-2 in animal model of K14-VEGF transgenic mouse [J].JPharmacolSci, 2015,128(3): 116-24.
[9] Adami S, Cavani A, Rossi F, et al.The role of interleukin-17A in psoriatic disease [J].BioDrugs, 2014,28(6): 487-97.
[10] 赵海梅, 鹿秀云, 岳海洋, 等.黄芪多糖对结肠炎小鼠结肠黏膜JAK/STAT信号的调控作用 [J].中国药理学通报, 2018,34(1): 145-6.
[10] Han H M, Lu X Y, Yue H Y, et al.Regulation of Astragalus polysaccharide treated colitis mice by JAK/STAT signaling pathway [J].ChinPharmacolBull, 2018,34(1): 145-6.
[11] 杨 晶, 张晓坚, 胡长平.吴茱萸次碱通过抑制TLR4/NF-κB信号通路保护大鼠心肌缺血/再灌注损伤 [J].中国药理学通报, 2017,33(12): 1707-12.
[11] Yang J, Zhang X J, Hu C P.Rutaecarpine protects against myocardial ischemia/reperfusion injury through inhibiting Toll like receptor 4/NF-κB signaling pathway in rats [J].ChinPharmacolBull, 2017,33(12): 1707-12.
[12] 李学峰, 郭海军, 张小谦, 等.抑制NF-κB的活化对免疫性肝损伤小鼠CYP3A代谢活力的影响 [J].中国药理学通报, 2017,33(5): 733-5.
[12] Li X F, Guo H J, Zhang X Q, et al.Effect of blunting NF-κB activation on CYP3A in immunological liver injury mice [J].ChinPharmacolBull, 2017,33(5): 733-5.
[13] Puig L.Brodalumab: the first anti-IL-17 receptor agent for psoriasis [J].DrugsToday(Barc), 2017,53(5): 283-97.
[14] Hanley T L, Yiu Z Z.Role of IL-17 in plaque psoriasis: therapeutic potential of ixekizumab [J].TherClinRiskManag, 2017,13: 315-23.
[15] Papp K A, Menter M A, Raman M, et al.A randomized phase 2b trial of baricitinib, an oral Janus kinase (JAK) 1/JAK2 inhibitor, in patients with moderate-to-severe psoriasis [J].BrJDermatol, 2016,174(6): 1266-76.