丹皮酚激活CKIP-1对高糖诱导的肾小球系膜细胞纤维化的影响
张 蕾,邹叶子,公文艳,陈志泉,黄河清
(中山大学药学院药理与毒理学实验室,广东 广州 510006)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病主要的“微血管综合症”之一,是目前导致终末期肾病的主要原因,也是导致糖尿病患者致死、致残的重要原因。DN亦称为糖尿病肾小球硬化症,其主要病理改变是肾脏纤维化。DN早期特征性的表现为肾小球系膜细胞(glomerular mesangial cells, GMCs)增殖、肾小球肥大,晚期逐渐发展为肾小球系膜区细胞外基质(extracellular matrix, ECM)进行性积聚如纤维连接蛋白(fibronectin,FN),以及细胞间黏附分子1(intercellular cell adhension molecule-1,ICAM-1)等炎性纤维化成分表达增加,最终发展成为以肾小球硬化为主要特征的肾实质损害[1-2]。研究资料表明,DN发病机制复杂,目前认为是多种因素综合作用的结果,包括高血糖、高血脂、活性氧及炎症因子等[3]。
酪蛋白激酶2相互作用蛋白1(casein kinase 2 interacting protein-1,CKIP-1)作为一种酪蛋白激酶2(casein kinase 2,CK2)α亚基的相互作用蛋白而被首次发现。作为一个支架蛋白,CKIP-1可与CK2α、caspase等多种蛋白结合,在细胞生长、凋亡、骨形成等过程中发挥重要的作用[4-5]。近年来研究表明,CKIP-1具有明确的抑制细胞增殖、调节脂肪生成、抗炎效应[6-7]。我们课题组的前期研究表明,CKIP-1可通过调控Nrf2/ARE信号通路,减少FN、ICAM-1的蛋白表达,在DN中发挥着重要的保护作用[8]。
丹皮酚(paeonol,PA)是一种从中药徐长卿和牡丹皮的干燥根皮中分离得到的小分子酚类化合物,研究表明其具有多种药理活性,包括抗氧化、抗炎、抗动脉粥样硬化等[9-11]。近年来有研究发现,丹皮酚有潜在的肾脏保护作用,能降低高糖诱导下GMCs中FN和转化生长因子β1(transforming growth factor β1,TGF-β1)的表达[12],但具体调控机制未有报道。丹皮酚发挥肾脏保护作用是否与激活CKIP-1,活化Nrf2通路相关,有待进一步证实。本研究主要探讨丹皮酚是否能通过激活CKIP-1,活化Nrf2信号通路,改善高糖诱导的GMCs纤维化。
1 材料与方法
1.1细胞培养GMCs由大鼠肾脏皮质部分离获得,培养于含10%胎牛血清完全培养基。细胞孵箱维持5% CO2和37℃培养条件。取3~12代间的细胞进行实验,当细胞密度达到90%时,按照1 ∶6比例传代。
1.2药物与试剂丹皮酚标准品,规格50 mg(中国食品药品检定研究院,批号:110708-201407)。DMEM培养基(美国Gibco公司);Lipofectamine®RNAiMAX(美国Invitrogen公司);DHE(碧云天公司); FN、ICAM-1抗体(美国Santa Cruz Biotechnology公司);CKIP-1抗体(Abcam公司);超氧化物歧化酶1(superoxide dismutase 1,SOD1)、Nrf2抗体(Proteintech 公司);血红素加氧酶1(heme oxygenase 1,HO-1)抗体(美国Abclone公司);辣根过氧化物酶标记的二抗(美国Promega公司)。
1.3药物处理以合适的密度在培养皿中接种细胞,当细胞生长汇合度到60%左右时,将完全培养基更换为无血清培养基DMEM,饥饿处理过夜,然后进行后续处理。丹皮酚用DMSO配成20 g·L-1母液,储存于-80℃,临用前用无血清培养基DMEM稀释成相应浓度。不同浓度的丹皮酚预处理2 h后,再给予相应刺激。
1.4siRNA干扰实验上海吉玛有限公司设计合成3对CKIP-1小分子干扰序列(siCKIP-1)。经筛选得到干扰效率最高的序列S2,其序列如下:5′-CUCCGGAAAUCCAAGAGUATT-3′,3′-UACUCUUGGAUUUCCGGAGTT-5′。当细胞融合度在50%左右开始转染。瞬时转染按照Lipofectamine®RNAiMAX试剂盒说明书进行。将5 μL相应干扰序列瞬时转染入细胞中,置于孵箱培养36 h,无血清处理12~14 h后进行下一步实验,而后收获细胞用于后续实验。
1.5免疫印迹法(Westernblot) 各组细胞结束培养后,PBS冲洗3次,用细胞裂解液(含有蛋白酶抑制剂cocktail)刮下细胞于1.5 mL EP管中,冰上裂解30 min。12 000×g、4℃离心15 min取上清。用BCA法进行蛋白定量,每组上样15 μg,经5%浓缩胶,8%或10%分离胶SDS-PAGE电泳分离蛋白(FN、ICAM-1、Nrf2用8%分离胶,CKIP-1、HO-1、SOD1用10%分离胶)。220 mA、1 h条件下将蛋白电转到PVDF膜上,然后室温封闭1 h,TBST冲洗3次后,4℃孵育相应的抗体过夜。次日用对应的二抗室温孵育1 h后,增强型化学发光液孵育2 min后,用Image Quant LAS4000mini(USA)仪器检测蛋白条带。
1.6超氧化物含量检测按照1 ∶1 000比例用无血清DMEM稀释荧光探针DHE,使其终浓度为10 μmol·L-1。细胞经过各种因素处理后,吸弃培养基,用无血清的培养基冲洗细胞2次。将培养皿置于冰上,加入新鲜培养基稀释好的DHE探针37℃孵育30 min,期间不时晃动培养板使混匀。用高内涵系统ArrayScan VTI 600 plus检测细胞荧光密度。
1.7过氧化氢(H2O2)含量检测按照碧云天过氧化氢检测试剂盒说明书,首先校准试剂盒内的1 mol·L-1过氧化氢标准品的实际浓度。然后测定1~100 μmol·L-1浓度范围内的标准曲线。检测时每孔加入50 μL样品和100 μL检测试剂,轻摇,室温静置30 min后,检测560 nm波长下的吸光值,代入标准曲线,计算各组过氧化氢浓度。
2 结果
2.1丹皮酚降低高糖诱导的超氧化物、H2O2水平GMCs内的超氧化物和H2O2含量能反映胞内的活性氧(reactive oxygen species, ROS)水平。如Fig 1所示,给予高糖刺激12 h后,GMCs内超氧化物、H2O2水平明显提高,给予丹皮酚预处理2 h,再给予高糖处理12 h后,与高糖组相比,丹皮酚能明显降低胞内超氧化物、H2O2含量。
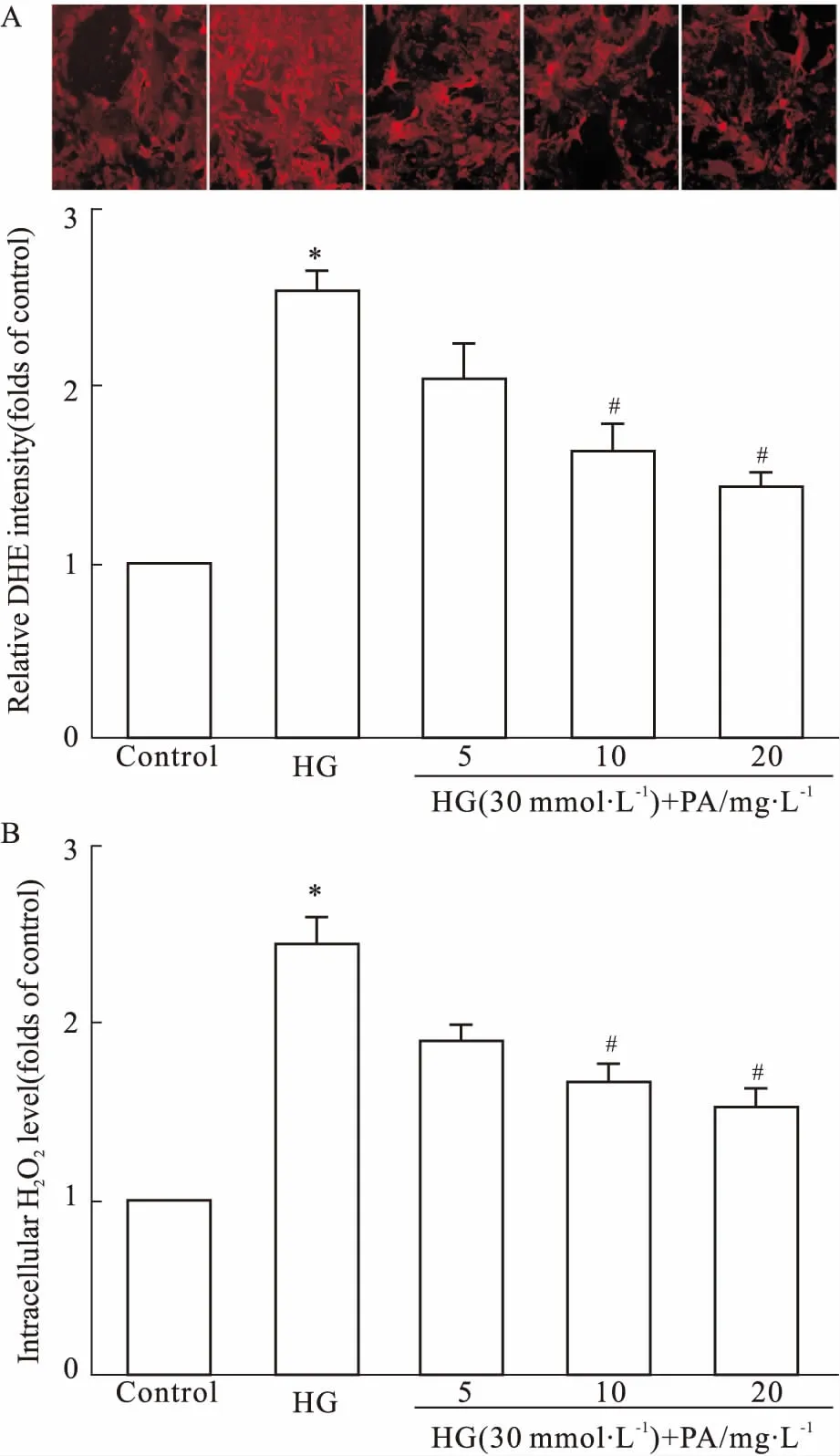
Fig 1 Effects of paeonol on superoxide(A) and H2O2(B) levels in GMCs n=3)
*P<0.05vscontrol;#P<0.05vsHG
2.2丹皮酚降低高糖诱导的FN、ICAM-1水平高糖刺激GMCs 24 h后,FN、ICAM-1蛋白表达明显高于正常水平;丹皮酚(5、10、20 mg·L-1)明显降低FN、ICAM-1蛋白水平(Fig 2)。
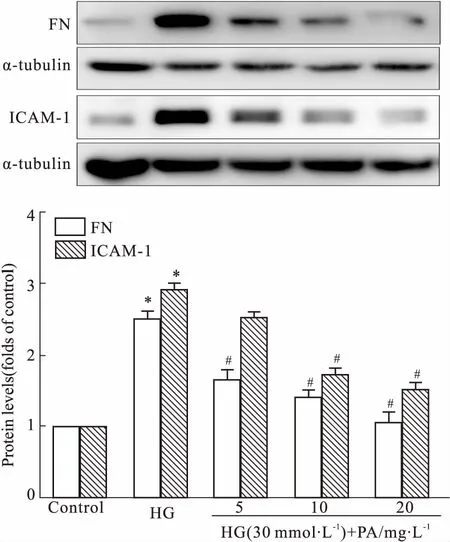
Fig 2 Effects of paeonol on FN and ICAM-1 expressions in HG-induced GMCs n=3)
*P<0.05vscontrol;#P<0.05vsHG
2.3丹皮酚对高糖诱导的GMCs内CKIP-1、Nrf2蛋白表达的影响Fig 1、2结果显示,丹皮酚能降低高糖刺激下GMCs内超氧化物、H2O2水平,最终降低FN、ICAM-1蛋白水平。我们进一步探讨了丹皮酚对CKIP-1介导的Nrf2信号通路的影响。Fig 3的Western blot结果显示,高糖刺激肾小球系膜细胞6 h后,模型组CKIP-1水平和正常组相比差异无显著性,丹皮酚(5、10、20 mg·L-1)明显升高CKIP-1蛋白水平。短时间高糖刺激短暂性提高核内Nrf2水平,丹皮酚处理组进一步升高Nrf2核蛋白水平。
2.4丹皮酚对高糖诱导的GMCs内HO-1、SOD1蛋白表达的影响接下来,我们检测了丹皮酚对Nrf2下游靶抗氧化酶HO-1、SOD1表达的影响。如Fig 4所示,作为Nrf2抗氧化应激通路的下游靶蛋白,HO-1在高糖诱导12 h后,表达轻微上调,而SOD1表达无明显变化。不同浓度的丹皮酚均能明显上调HO-1、SOD1蛋白表达。
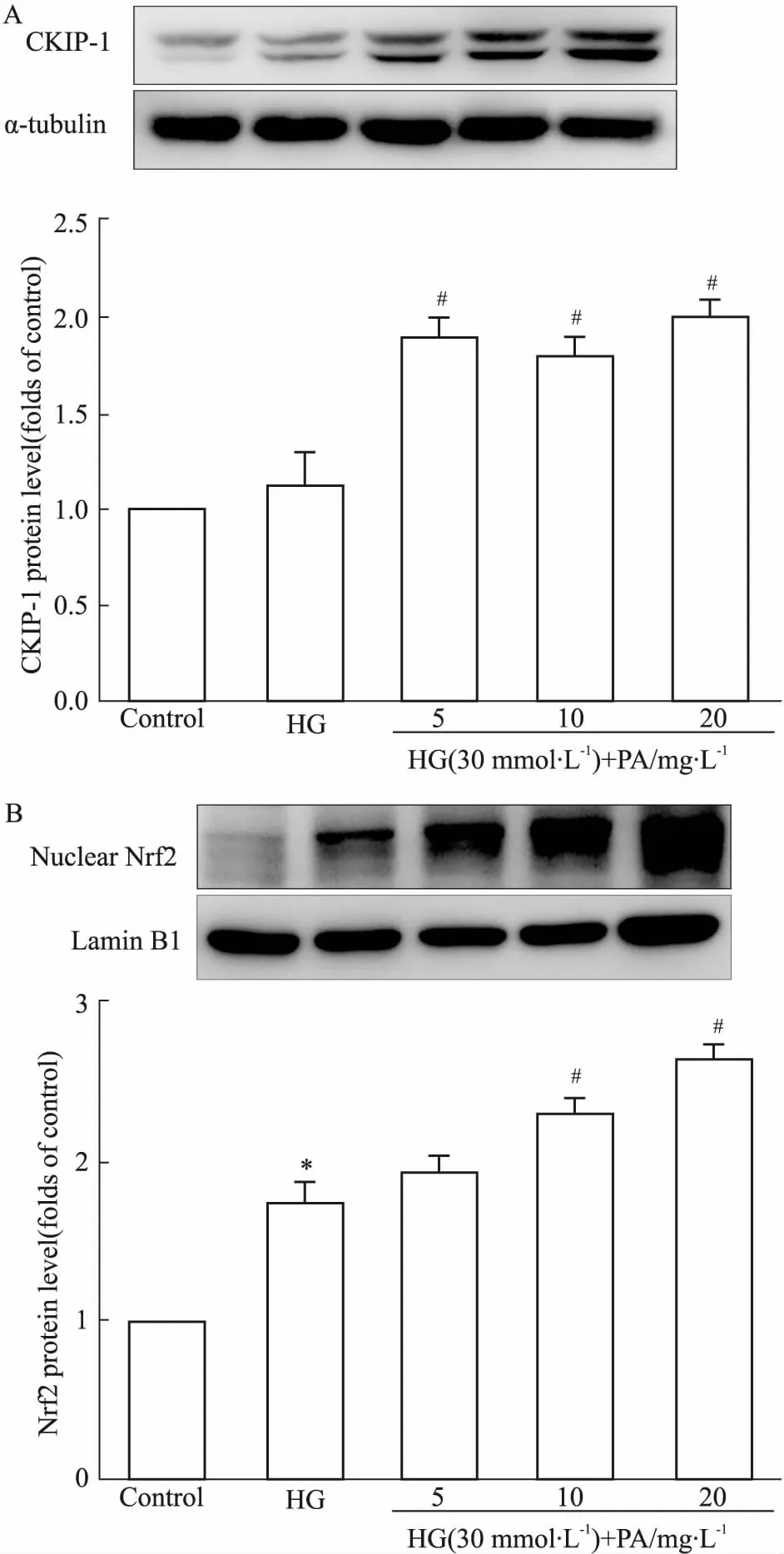
Fig 3 Effects of paeonol on CKIP-1(A) and Nrf2(B) expressions in HG-induced GMCs n=3)
*P<0.05vscontrol;#P<0.05vsHG
2.5敲低CKIP-1逆转丹皮酚升高GMCs内Nrf2、HO-1、SOD1蛋白表达的作用上述结果显示,丹皮酚降低高糖诱导GMCs内超氧化物、H2O2含量增加,抑制FN、ICAM-1纤维化相关因子的表达。并且,丹皮酚能激活CKIP-1介导的Nrf2信号通路。为了更加明确CKIP-1在丹皮酚激活Nrf2通路中的作用,我们敲低CKIP-1,同时给予丹皮酚处理。Fig 5结果显示,CKIP-1干扰序列的干扰效率达到了70%。相比于丹皮酚处理组,同时给予丹皮酚和siCKIP-1后,丹皮酚升高总Nrf2的作用被取消,且同时给予丹皮酚和siCKIP-1逆转了丹皮酚诱导的HO-1、SOD1表达增加。
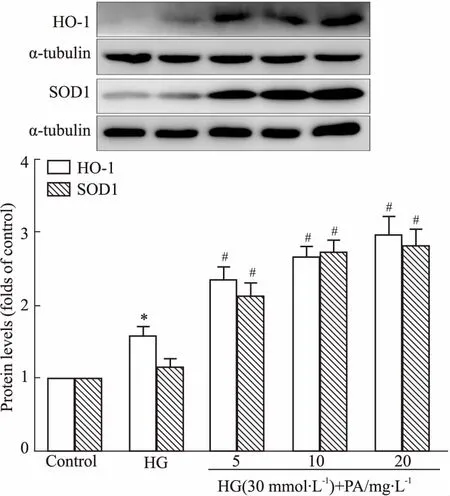
Fig 4 Effects of paeonol on HO-1 and SOD1 expressions in HG-induced GMCs n=3)
*P<0.05vscontrol;#P<0.05vsHG
2.6敲低CKIP-1逆转丹皮酚降低GMCs内活性氧水平的作用Fig 6结果显示,和单独高糖刺激组相比,10 mg·L-1丹皮酚处理组能明显降低高糖引起的GMCs内超氧化物、H2O2含量的增加。然而,在给予siCKIP-1后,丹皮酚减少超氧化物、H2O2的作用被取消。
2.7敲低CKIP-1逆转丹皮酚抑制GMCs中FN、ICAM-1表达的作用Fig 7结果显示,同时加入siCKIP-1和丹皮酚后,GMCs中FN、ICAM-1蛋白表达水平较单纯丹皮酚给药组明显升高。以上结果说明,CKIP-1/Nrf2信号通路介导了丹皮酚抑制高糖诱导GMCs中FN、ICAM-1表达上调的作用。
3 讨论
大量临床研究证明,高血糖是导致DN在内的各种糖尿病血管并发症的主要决定因子,高血糖培养环境能模拟DN时人体内环境[13]。课题组的前期研究证实,30 mmol·L-1高糖可以成功诱导包括FN在内的糖尿病肾脏纤维化标志蛋白表达明显升高[14]。
CKIP-1广泛表达于各种组织和细胞中,在各种细胞生理进程,包括细胞生长、分化、凋亡、细胞骨架形成等中发挥重要作用。研究表明,用高脂饲料饲养的CKIP-1基因敲除鼠,其较野生小鼠脂肪沉积、体质量和瘦素水平均明显增加[7]。同时,CKIP-1能通过抑制TRAF6介导的Akt信号通路的激活,减少巨噬细胞炎症反应[15]。上述研究证实,CKIP-1在糖脂代谢、炎症领域有明确的调节作用,而炎症、糖脂代谢紊乱是DN的重要发病机制。我们前期的研究亦证实,在GMCs中,CKIP-1可通过活化Nrf2-ARE抗氧化应激通路,减少细胞中ROS积聚,抵抗高糖诱导的GMCs中纤维化相关指标FN、ICAM-1表达上调,最终阻抑DN的病理发展[9]。
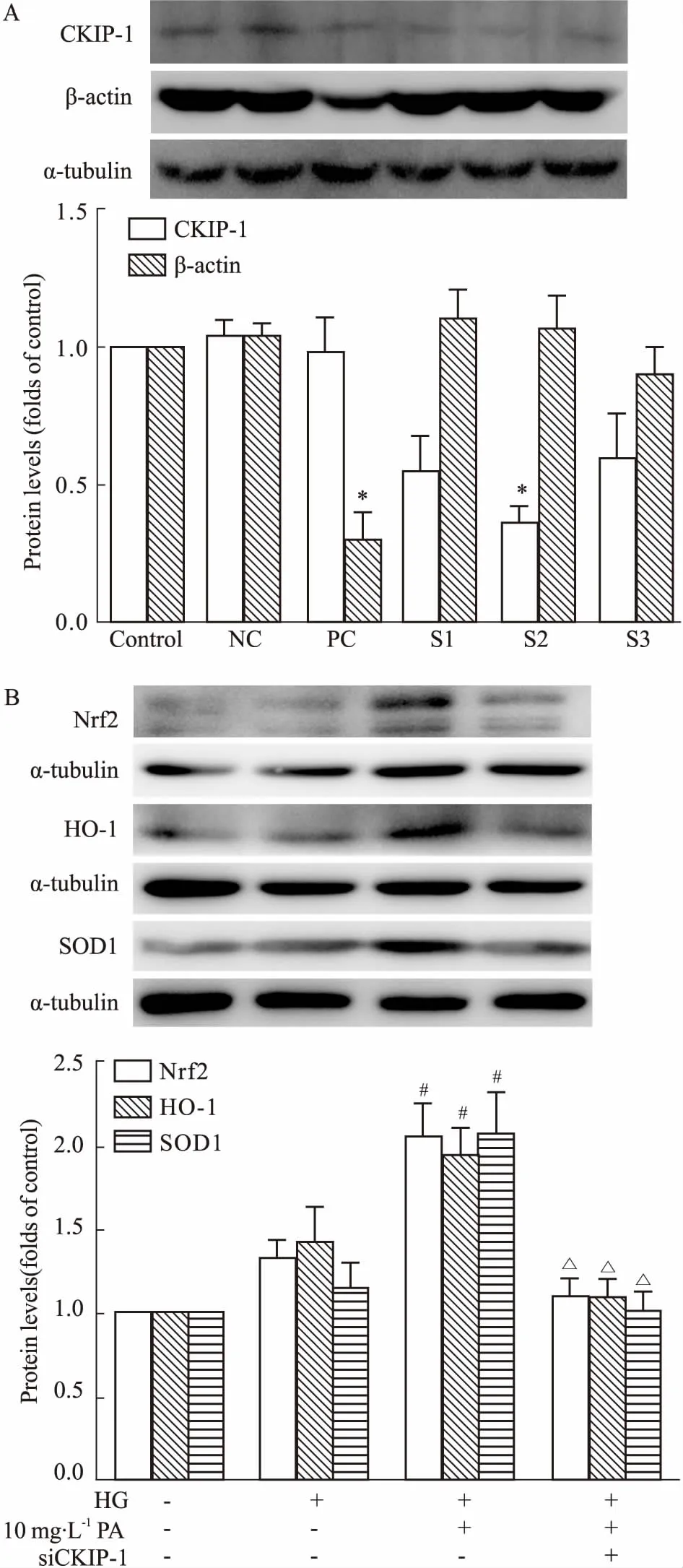
Fig 5 Depletion of CKIP-1 blocks effect of PA on Nrf2 signaling pathway n=3)
A:The interfering sequences were screened by Western blot.NC: negative control siRNA; PC:positive control siRNA; S1, S2, S3: three pairs of siRNA oligonucleotides targeting CKIP-1.B: Effects of siCKIP-1 on expressions of Nrf2, HO-1 and SOD1.*P<0.05vscontrol;#P<0.05vsHG;ΔP<0.05vsHG+PA.
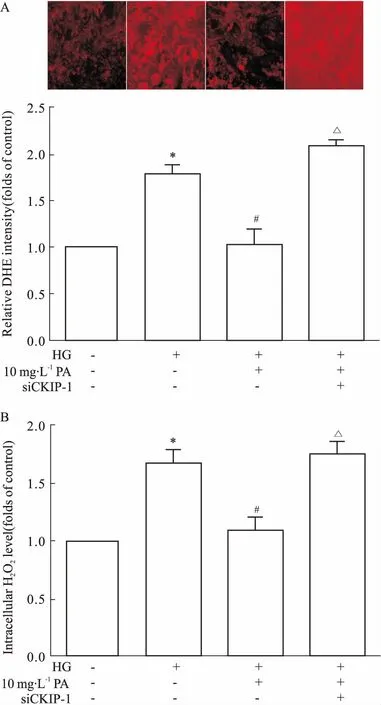
Fig 6 Depletion of CKIP-1 blocks effects of PA on superoxide(A) and H2O2(B) levels n=3)
*P<0.05vscontrol;#P<0.05vsHG;ΔP<0.05vsHG+PA
研究表明,丹皮酚能明显降低高糖刺激的GMCs中ROS水平,以及高糖刺激下TGF-β1和FN的表达[13],提示丹皮酚具有通过抗氧化、改善糖尿病状态下GMCs炎性纤维化的药理活性,然而,丹皮酚对糖尿病状态下GMCs确切的调节作用及其抗氧化作用机制有待进一步阐明。本实验主要观察了丹皮酚能否通过激活CKIP-1/Nrf2抗氧化应激通路,抑制高糖刺激下培养的GMCs中FN、ICAM-1等炎性纤维化成分表达增加。结果显示,30 mmol·L-1高糖条件下,丹皮酚处理明显降低了高糖刺激的GMCs中ROS水平,能够明显逆转高糖诱导的GMCs中FN和ICAM-1表达的增加。此外,丹皮酚能激活CKIP-1,上调Nrf2信号通路蛋白表达,包括Nrf2及其下游靶蛋白HO-1、SOD1的表达。而干扰CKIP-1表达后,丹皮酚升高CKIP-1表达作用被取消,提高Nrf2、HO-1、SOD1蛋白表达的作用也同样被抑制,最终逆转了丹皮酚降低GMCs内ROS的作用,丹皮酚抑制FN、ICAM-1表达的作用也被取消。这些结果提示,激活CKIP-1,上调Nrf2信号通路,可能是丹皮酚抵抗高糖诱导GMCs纤维化的机制之一。
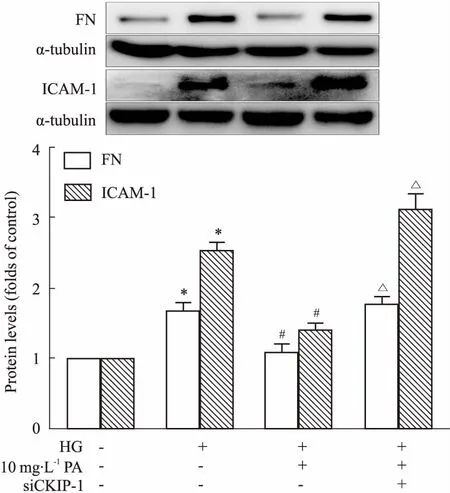
Fig 7 Depletion of CKIP-1 blocks effects of PA on FN and ICAM-1 expressions n=3)
*P<0.05vscontrol;#P<0.05vsHG;ΔP<0.05vsHG + PA
本研究初步阐明了丹皮酚抵抗高糖诱导GMCs中FN、ICAM-1的高表达,阻抑DN病理进程的作用与其调节CKIP-1、激活Nrf2抗氧化通路密切相关,本研究为丹皮酚防治DN提供了一定的实验基础和理论依据。
参考文献:
[1] Kolset S O, Reinholt F P, Jenssen T.Diabetic nephropathy and extracellular matrix[J].JHistochemCytochem, 2012,60(12):976-86.
[2] 陈秋红,陈志泉,黄佳妮,黄河清.MRTF-A通过NF-κB参与AGEs诱导肾小球系膜细胞中FN、ICAM-1的表达[J].中国药理学通报,2017,33(4):572-7.
[2] Chen Q H, Chen Z Q, Huang J N, Huang H Q.MRTF-A mediates FN and ICAM-1 expressions by NF-κB pathway in AGEs-induced GMCs[J].ChinPharmacolBull, 2017,33(4):572-7.
[3] Navarro-Gonzalez J F, Mora-Fernandez C, Muros de Fuentes M, Garcia-Perez J.Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy[J].NatRevNephrol, 2011,7(6):327-40.
[4] Nie J, Liu L, He F, et al.CKIP-1: a scaffold protein and potential therapeutic target integrating multiple signaling pathways and physiological functions[J].AgeingResRev, 2013,12(1):276-81.
[5] Olsten M E, Canton D A, Zhang C, et al.The Pleckstrin homology domain of CK2 interacting protein-1 is required for interactions and recruitment of protein kinase CK2 to the plasma membrane[J].JBiolChem, 2004,279(40):42114-27.
[6] Li D, Zhu H, Liang C, et al.CKIP-1 suppresses the adipogenesis of mesenchymal stem cells by enhancing HDAC1-associated repression of C/EBPalpha[J].JMolCellBiol, 2014,6(5):368-79.
[7] Nie J, Liu L, Xing G, et al.CKIP-1 acts as a colonic tumor suppressor by repressing oncogenic Smurf1 synthesis and promoting Smurf1 autodegradation[J].Oncogene, 2016,35(6):800.
[8] Gong W, Chen C, Xiong F, et al.CKIP-1 ameliorates high glucose-induced expression of fibronectin and intercellular cell adhesion molecule-1 by activating the Nrf2/ARE pathway in glomerular mesangial cells[J].BiochemPharmacol, 2016,116:140-52.
[9] Jin X, Wang J, Xia Z M, et al.Anti-inflammatory and anti-oxidative activities of paeonol and its metabolites through blocking MAPK/ERK/p38 signaling pathway[J].Inflammation, 2016,39(1):434-46.
[10] Ping M, Xiao W, Mo L, et al.Paeonol attenuates advanced oxidation protein product-induced oxidative stress injury in THP-1 macrophages[J].Pharmacology, 2014,93(5-6):286-95.
[11] Li X, Zhou Y, Yu C, et al.Paeonol suppresses lipid accumulation in macrophages via upregulation of the ATP binding cassette transporter A1 and downregulation of the cluster of differentiation 36 [J].IntJOncol, 2015,46(2):764-74.
[12] Sun M, Huang L, Zhu J, et al.Screening nephroprotective compounds from cortex Moutan by mesangial cell extraction and UPLC[J].ArchPharmRes, 2015,38(6):1044-53.
[13] Tahara A, Tsukada J, Tomura Y, et al.Effects of high glucose on AVP-induced hyperplasia, hypertrophy, and type IV collagen synthesis in cultured rat mesangial cells[J].EndocrRes, 2012,37(4):216-27.
[14] 熊凤霄,杨志英,王少贵,等.胆汁酸膜受体TGR5对高糖培养的大鼠肾小球系膜细胞FN、TGF-β1的调控作用[J].中国药理学通报,2016,32(1):33-7.
[14] Xiong F X, Yang Z Y, Wang S G, et al.Regulatory effects of the bile acid membrane receptor TGR5 on FN and TGF-β1 in rat glomerular mesangial cells cultured under high glucose condition [J].ChinPharmacolBull, 2016,32(1):33-7.
[15] Zhang L, Wang Y, Xiao F, et al.CKIP-1 regulates macrophage proliferation by inhibiting TRAF6-mediated Akt activation[J].CellRes, 2014,24(6):742-61.